Слайд 2
Анализ состава и структуры ДНК
Гены локализованы на хромосомах
и контролируют проявление признаков в фенотипе.
гены должны содержать информацию,
которая передается новым поколениям и определяет признаки потомства.
генетическая информация определяет сложные процессы дифференцировки организмов.
Слайд 3
До 1944 г. о химическом составе и структуре
хромосом было известно крайне мало.
генетическим материалом могут служить как
нуклеиновые кислоты, так и хромосомные белки.
1944 г. Появились первые экспериментальные доказательства роли нуклеиновых кислот в наследственности.
Слайд 4
1944 – 1953 г. во многих лабораториях были
получены результаты, позволяющие ответить на вопрос о роли ДНК
как генетической основы жизненных процессов.
Слайд 5
Первые исследования генетического материала
В конце девятнадцатого века стали
активно развиваться исследования химической структуры биомолекул.
до 40-х годов ХХ
века считалось, что генетическим материалом в клетках могут быть как нуклеиновые кислоты, так и белки.
Белок – единственное вещество, молекулы которого обладают достаточным структурным разнообразим, чтобы служить генетическим материалом.
Слайд 6
Первым в 1868 г. исследовал ДНК шведский химик
Фридрих Мишер.
Из суспензии клеточных ядер он выделил кислое вещество,
которое назвал нуклеином.
Считалось, что молекулы ДНК не обладают химическим разнообразием, достаточным для хранения генетической информации.
1910 г. Фебус А. Ливен показал, что ДНК состоит из приблизительно равных количеств нуклеотидов.
одинаковые группы из четырех нуклеотидов многократно повторяются по длине молекулы ДНК – тетрануклеотидная гипотеза строения ДНК.
Слайд 7
в 40-х годах ХХ века Эрвин Чаргафф убедительно
показал, что ДНК у большинства организмов содержит неодинаковые соотношения
четырех нуклеотидов и опроверг выводы Ливена.
Слайд 8
Доказательство ведущей роли ДНК у бактерий и бактериофагов
1944
г. Освальд Эвери, Колин Мак-Леод и Маклин Мак-Карти обнаружили,
что при трансформации у бактерий в качестве генетического материала передается именно ДНК.
Слайд 9
Опыты по трансформации
1927 г. сотрудник Британского Министерства здравоохранения
Фредерик Гриффит проводил опыты с различными штаммами бактерии Diplococcus
pneumoniae (Streptococcus pneumonia).
Результаты его экспериментов и легли в основу исследований группы Эвери.
Некоторые из штаммов были вирулентными и вызывали у позвоночных (особенно у человека и мышей) заболевание пневмонией.
Другие штаммы оказались невирулентными и не приводили к пневмонии.
Слайд 10
различия в вирулентности пневмококков обусловлены наличием полисахаридной капсулы:
вирулентные клетки имели капсулу,
невирулентные – нет.
Слайд 11
Вирулентные и невирулентные штаммы различались по морфологии клеток:
инкапсулированные формировали гладкие блестящие колонии (S)
бактерии без капсулы –
грубые, шероховатые (R).
Bacteria pneumococci, Streptococcus pneumoniae, gram-positive spherical bacteria, diplococci which cause pneumonia, 3D illustration
Слайд 12
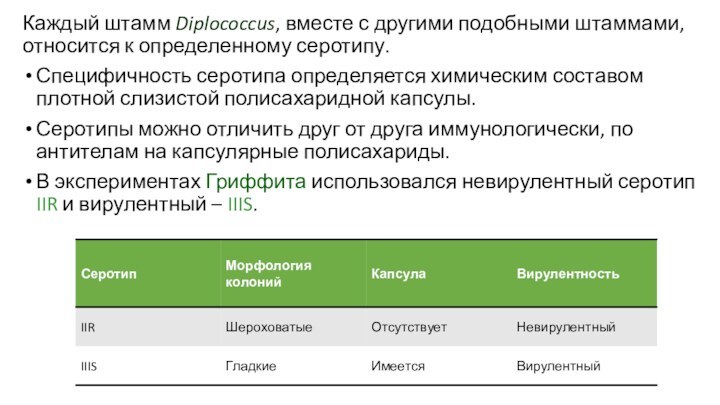
Каждый штамм Diplococcus, вместе с другими подобными штаммами,
относится к определенному серотипу.
Специфичность серотипа определяется химическим составом плотной
слизистой полисахаридной капсулы.
Серотипы можно отличить друг от друга иммунологически, по антителам на капсулярные полисахариды.
В экспериментах Гриффита использовался невирулентный серотип IIR и вирулентный – IIIS.
Слайд 13
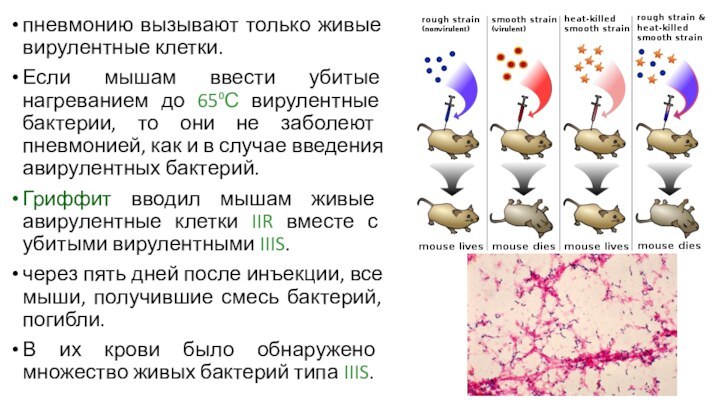
пневмонию вызывают только живые вирулентные клетки.
Если мышам ввести
убитые нагреванием до 65⁰С вирулентные бактерии, то они не
заболеют пневмонией, как и в случае введения авирулентных бактерий.
Гриффит вводил мышам живые авирулентные клетки IIR вместе с убитыми вирулентными IIIS.
через пять дней после инъекции, все мыши, получившие смесь бактерий, погибли.
В их крови было обнаружено множество живых бактерий типа IIIS.
Слайд 14
эти бактерии идентичны клеткам IIIS, убитым перед инъекцией
нагреванием.
Контрольные мыши, которым вводили живые невирулентные клетки IIR, были
здоровы.
невирулентные клетки IIR не мутировали в вирулентные IIIS, но живые невирулентные и убитые вирулентные клетки взаимодействовали между собой.
Слайд 15
Гриффит предположил, что убитые клетки каким-то образом превращают
невирулентные бактерии в вирулентный тип IIIS.
Он назвал это
явление трансформацией и полагал, что фрагмент полисахаридной капсулы или составляющие ее вещества могут стать трансформирующим фактором.
По Гриффиту, трансформирующая основа убитых клеток IIIS служит «пищей» для бактерий IIR и, таким образом, попадает внутрь бактерий.
Слайд 16
В начале 30-х годов Генри Доусон с сотрудниками
показали, что трансформация возможна также in vitro, в пробирке
с бактериальными клетками.
К 1933 г. Лионель Дж. Элловей усовершенствовала эксперименты in vitro.
растворимый фильтрат из убитых вирулентных бактерий индуцировал трансформацию также эффективно, как живые вирулентные бактерии.
Элловей и другие исследователи рассматривали трансформацию как физиологическую трансформацию клетки, а не генетический процесс.
Схема опыта, демонстрирующего явление трансформации
Слайд 17
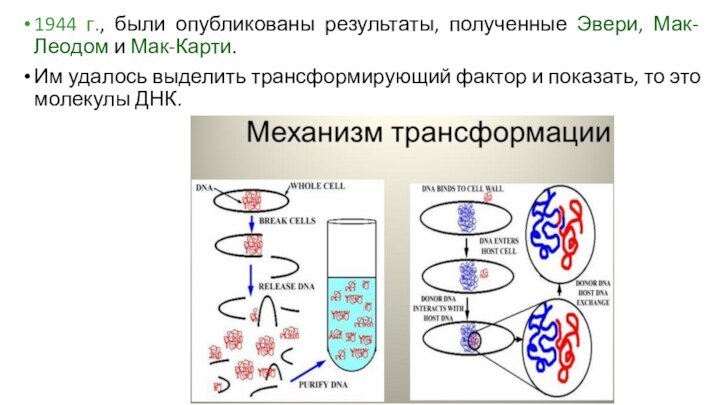
1944 г., были опубликованы результаты, полученные Эвери, Мак-Леодом
и Мак-Карти.
Им удалось выделить трансформирующий фактор и показать, то
это молекулы ДНК.
Слайд 18
Сначала исследователи выращивали большие объемы (50 – 70
л) жидких культур вирулентных бактерий типа IIIS.
Затем клетки
осаждали центрифугированием и убивали нагреванием.
После их ферментативной обработки был получен растворимый фильтрат этих клеток, сохранивший способность трансформировать непатогенные клетки типа IIR.
Фильтрат обрабатывали ферментом протеазой, разрушающей белки, а также рибонуклеазой, разрушающей молекулы РНК, - поэтому ни белки, ни РНК не могли быть трансформирующим фактором.
После обработки фильтрата дезоксирибонуклеазой из сыворотки собаки или кролика трансформирующая активность фильтрата исчезала.
Слайд 19
Эвери с коллегами решили, что трансформирующий фактор взаимодействует
с клетками типа IIR и координирует, таким образом, ряд
ферментативных реакций, приводящих к синтезу полисахарида, который содержится в капсулах клеток IIIS.
при трансформации клетки следующих поколений становятся инкапсулированными.
Слайд 20
трансформация происходит у Hemophilus influenzae, Bacillus subtilis, Sigella
paradysenteriae, Escherichia coli.
трансформация
морфологии колоний
устойчивость к антибиотикам
метаболизм различных
питательных веществ
Слайд 21
Эксперимент Херши-Чейз
Другие доказательства роли ДНК как переносчика генетической
информации были получены при исследовании бактериофага Т2, инфицирующего Escherichia
coli.
Внутри белковой головки капсида этого фага находится молекула ДНК.
В 1952 г. был исследован жизненный цикл некоторых Т-четных бактериофагов, включая и фаг Т2.
Структура бактериофага T2.
Слайд 22
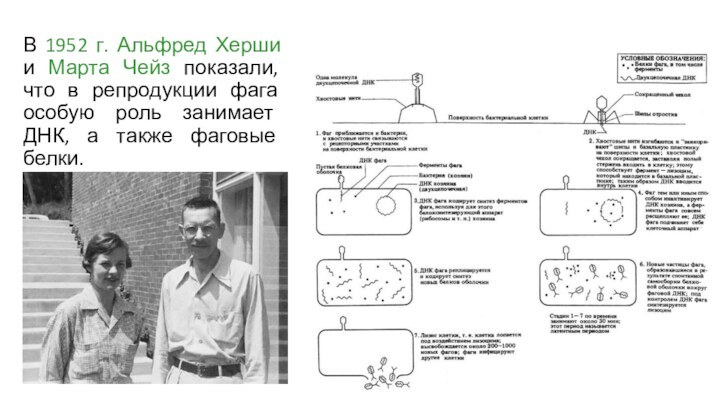
В 1952 г. Альфред Херши и Марта Чейз
показали, что в репродукции фага особую роль занимает ДНК,
а также фаговые белки.
Слайд 23
Из предыдущих исследований было известно, что:
1. Фаги Т2
примерно на 50% состоят из белков и на 50%
- из ДНК.
2. Инфекция клеток начинается с абсорбции фага на бактериальной стенке с помощью хвостовых фибрилл.
3. Новые фаговые частицы образуются внутри бактериальной клетки.
Слайд 24
Если предположить, что некоторые из молекулярных компонентов фага
(ДНК или белки) проникают внутрь бактерии, то какие из
них «руководят» сборкой вирусных частиц?
Слайд 25
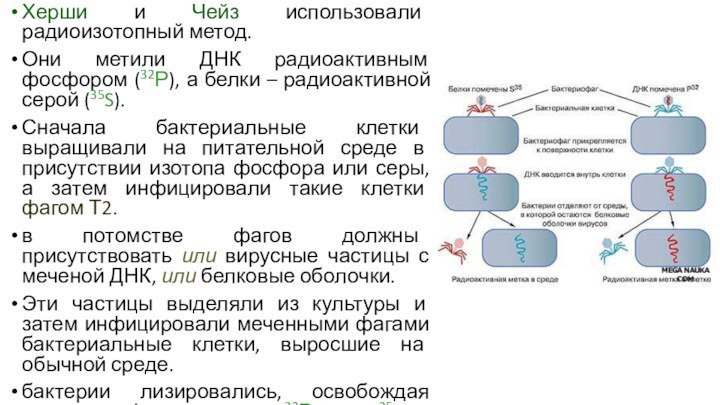
Херши и Чейз использовали радиоизотопный метод.
Они метили ДНК
радиоактивным фосфором (32Р), а белки – радиоактивной серой (35S).
Сначала
бактериальные клетки выращивали на питательной среде в присутствии изотопа фосфора или серы, а затем инфицировали такие клетки фагом Т2.
в потомстве фагов должны присутствовать или вирусные частицы с меченой ДНК, или белковые оболочки.
Эти частицы выделяли из культуры и затем инфицировали меченными фагами бактериальные клетки, выросшие на обычной среде.
бактерии лизировались, освобождая потомство фага, меченное 32Р, но не 35S.
Слайд 26
Из опыта Херши и Чейз сделали вывод, что
белки фага остаются снаружи бактериальной клетки-хозяина, а для образования
новых фаговых частиц важна только вирусная ДНК, которая и является генетическим материалом фага Т2.
Слайд 27
Эксперименты Херши и Чейз, а также Эвери с
сотрудниками убедительно показали, что носителями наследственности служат молекулы ДНК.
Слайд 28
Опыты по трансфекции
1957 г. – опубликовано несколько работ,
которые показали, что после ферментативной обработки клеток E.coli лизоцимом
клеточная стенка у бактерий легко удаляется, и они представляют собой протопласты, или сферопласты.
Дж. Шпизицен и Д. Фрейзер, независимо друг от друга, инфицировали такие лишенные клеточной стенки протопласты фагами Т2 с разрушенной белковой оболочкой.
Слайд 29
1960 г. – проведены сходные эксперименты с использованием
очищенной фаговой ДНК.
Заражение клеток-хозяев вирусной нуклеиновой кислотой называется трансфекцией.
Слайд 30
Прямые и непрямые доказательства значения ДНК у эукариот
В
50-х годах ХХ века эксперименты, демонстрирующие роль и значение
ДНК, проводились на бактериях и вирусах.
Слайд 31
Непрямое доказательство: распределение ДНК
ДНК локализована в клетке там,
где определяются определенные генетические функции, а белки встречаются повсюду.
Поскольку
было известно, что хромосомы внутри ядер содержат генетический материал, предполагалась корреляция между плоидностью клеток (n, 2n и т.д.) и количеством молекул – носителей генетического материала.
Слайд 32
Очевидна тесная корреляция между количеством хромосом и содержанием
ДНК в клетках.
Однако такой корреляции по содержанию белка в
гаметах и диплоидных клетках не обнаруживается.
Слайд 33
Непрямое доказательство: мутагенез
Ультрафиолетовый свет (УФ) – один из
агентов, индуцирующих мутации генетического материала.
Можно облучить дрожжи или другие
простейшие грибы ультрафиолетом с разной длиной волны, а эффективность мутагенного воздействия измерить по количеству индуцированных мутаций.
молекулы-носители генетического материала будут поглощать спектр в той области, где наблюдается мутагенный эффект.
Слайд 34
УФ обладает максимальным мутагенным действием при длине волны
260 нанометров (нм).
Наиболее сильно поглощают свет в области 260
нм молекулы ДНК и РНК.
Белки наиболее сильно поглощают свет при длине волны 280 нм, но в этой области не наблюдается заметного мутагенного эффекта.
Слайд 35
Прямое доказательство:
анализ рекомбинантных ДНК
доказательства этой гипотезы были получены
с помощью метода рекомбинантных ДНК.
Выделенные фрагменты ДНК, которые соответствуют
специфическим генам эукариот, можно встраивать в бактериальную хромосому и затем наблюдать за экспрессией этих генов в бактерии.
после встраивания в бактериальную хромосому человеческих генов, кодирующих инсулин и интерферон, в бактериях обнаружили синтез этих белков.
Слайд 36
в оплодотворенные мышиные яйцеклетки с помощью микроинъекций можно
ввести ген человеческого бета-глобина.
продукты этого гена обнаружили в тканях
взрослых мышей, развивающихся из таких яйцеклеток.
Беатриса Минц
трансгенные животные.
Слайд 37
Позже в оплодотворенные мышиные яйцеклетки ввели ген rat,
кодирующий гормон роста.
Около трети мышей, выросших из этих яйцеклеток,
оказались вдвое крупнее сородичей.
Слайд 38
В эукариотических клетках происходит экспрессия генетической информации записанной
в ДНК.
Слайд 39
Структурный анализ ДНК
1953 г. Джеймс Уотсон и Фрэнсис
Крик предположили, что молекула ДНК двуспиральная.
Nature.
Слайд 40
В распоряжении Уотсона и Крика было две группы
данных:
(1) результаты анализа состава оснований в молекулах ДНК
после гидролиза
(2) дифракционный анализ структуры ДНК с помощью Х-лучей.
Опираясь на эти данные, Уотсон и крик сконструировали модель ДНК, отвечающую экспериментальным результатам.
Слайд 41
Химия нуклеиновых кислот
Когда Уотсон и Крик работали над
своей моделью ДНК, уже был известен химический состав нуклеиновых
кислот.
Слайд 42
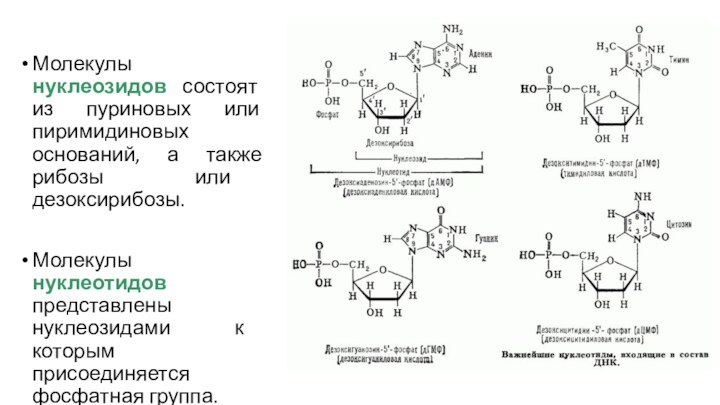
Звеньями, или строительными блоками в молекуле всех нуклеиновых
кислот служат нуклеотиды.
Они состоят из трех компонентов:
азотистых оснований,
сахара (пентозы)
фосфатной группы.
Различают два вида азотистых оснований:
девятичленные бициклические пурины (аденин (А) и гуанин (G))
шестичленные моноциклические пиримидины (цитозин (С), тимин (Т) и урацил (U)).
Слайд 43
В состав молекул рибонуклеиновой кислоты (РНК) входит сахар
рибоза, а в состав дезоксирибонуклеиновой кислоты (ДНК) – дезоксирибоза.
Слайд 44
Молекулы нуклеозидов состоят из пуриновых или пиримидиновых оснований,
а также рибозы или дезоксирибозы.
Молекулы нуклеотидов представлены нуклеозидами к
которым присоединяется фосфатная группа.
Слайд 45
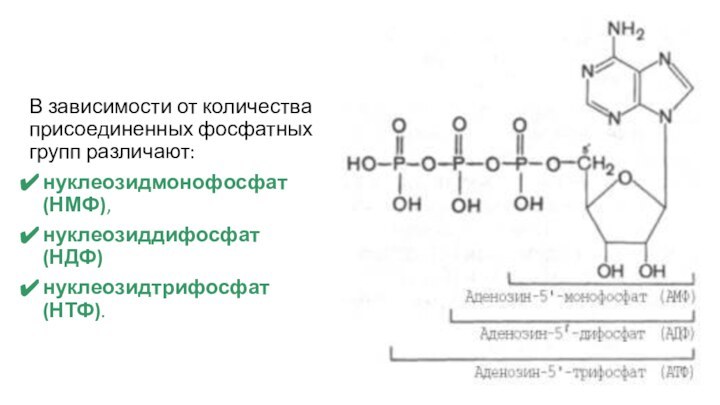
В зависимости от количества присоединенных фосфатных групп различают:
нуклеозидмонофосфат
(НМФ),
нуклеозиддифосфат (НДФ)
нуклеозидтрифосфат (НТФ).
Слайд 46
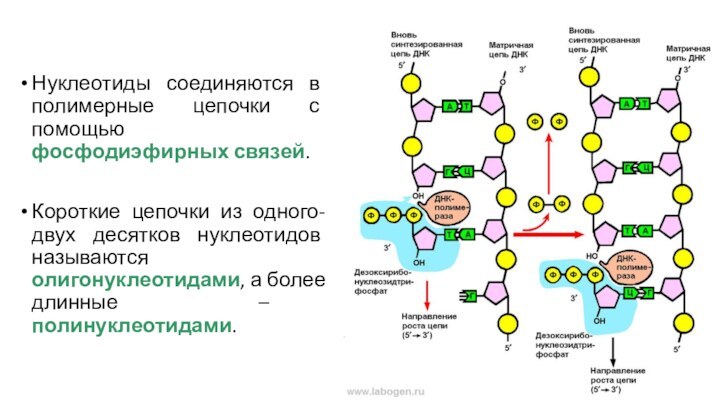
Нуклеотиды соединяются в полимерные цепочки с помощью фосфодиэфирных
связей.
Короткие цепочки из одного-двух десятков нуклеотидов называются олигонуклеотидами, а
более длинные – полинуклеотидами.
Слайд 47
Химический состав оснований
В 1949 – 1953 гг. Эдвин
Чаргафф с сотрудниками обнаружили с помощью хроматографии, что ДНК
разных организмов состоит из четырех различных оснований.
1. Количество остатков аденина (их молярное содержание) в ДНК пропорционально количеству остатков тимина, а количество остатков гуанина пропорционально количеству остатков цитозина.
2. На основании этих пропорций сумма пуринов (А+G) равна сумме пиримидинов (С+Т).
3. Процентное содержание G+С не обязательно равно А+Т и различно у разных организмов.
Слайд 48
Если молекулы облучают рентгеновскими лучами, то часть Х-лучей,
сталкиваясь с атомами, рассеивается, и на фотопленку появляются темные
пятна, соответствующие структуре молекулы.
рентгеновский дифракционный анализ структуры белковых молекул успешно использовали Лайнус Поллинг и другие химики.
В начале 1938 г. Вильям Эстбури попытался применить этот метод для анализа ДНК.
Он обнаружил похожую на виток структуру, которая повторялась по длине молекулы с интервалом 3,4 ангстрема (10 ангстрем = 1 нм)
Слайд 49
В 1950 – 1953 гг. Розалинда Франклин, работавшая
в лаборатории Мориса Уилкинса, исследовала более чистые образцы ДНК
и подтвердила обнаруженную Эстбури периодичность.
Она предположила, что молекула ДНК имеет спиральную структуру с шагом между витками 3,4 А, однако точной модели ДНК построено не было.
На основании этих и других данных Поллинг ошибочно предположил, что ДНК представляет собой тройную спираль.
Слайд 50
Модель Уотсона-Крика
Уотсон и Крик в 1953 г. предположили,
что ДНК имеет форму двойной спирали со следующими свойствами:
1.
две длинные полинуклеотидные цепочки закручены вокруг центральной оси, формируя правостороннюю спираль.
2. Эти две цепи ориентированы в противоположных направлениях, то есть их 5’ и 3’-концы не совпадают.
3. Основания в составе каждой полинуклеотидной цепи лежат в плоскости, перпендикулярной оси молекулы и располагаются внутри двойной спирали плоскопараллельно, один над другим, с интервалом 3,4А (0,34 нм).
4. Азотистые основания противоположных цепей ДНК спарены с помощью водородных связей в строго определенном виде: только А = Т или G ≡ С.
5. Полный оборот спирали занимает 34А (3,4 нм), включая 10 оснований в каждой цепи.
6. По длине молекулы чередуются большие и малые бороздки.
7. Диаметр двойной спирали ДНК составляет 20А (2,0 нм).
Слайд 51
Согласно правилам Чаргаффа, молярное содержание А равно молярному
содержанию Т, а молярное содержание G – содержанию С.
Это
соотношение соблюдается в том случае, если А спарен при помощи водородных связей с Т, а G – с С.
Как показывает дифракционный анализ ДНК, пурины (А или G) располагаются напротив пиримидинов (Т или С), так что диаметр спирали составляет 20 А (2 нм).
Слайд 52
Специфичность спаривания между этими основаниями обусловлена комплементарностью –
химическим сродством, обусловленным водородными связями между основаниями.
Водородные связи возникают
за счет очень слабого электростатического притяжения между ковалентно связанным атомом водорода (+) и атомом неразделенной (лишней) парой электронов (-), кислородом или азотом.
Слайд 53
Более точный анализ структуры ДНК, проведенный впоследствии, выявил
небольшие отклонения от классической модели.
Так, на один виток спирали
приходится 10,4 пары нуклеотидов (п.н.), а не 10.
Это объясняется тем, что каждая пара нуклеотидов закручена вокруг оси молекулы на 36,6⁰, а не на 36 ⁰, как предполагали Уотсон и Крик.
Слайд 54
Уже в 1953 г. авторы заметили, что из
предлагаемого ими принципа комплементарности следует возможный механизм копирования генетического
материала.
Спустя два месяца после первой публикации в Nature, здесь же появляется вторая статья, в которой Уотсон и Крик развили эту идею, предложив полуконсервативную модель репликации ДНК.
В этой статье были рассмотрены две новые концепции:
(1) хранение генетической информации в последовательности оснований
(2) мутации или другие генетические изменения могут быть следствием нарушения последовательности оснований.
Слайд 55
Альтернативные формы ДНК
При выделении ДНК в разных условиях
можно получить различные конформации молекул.
Во время Уотсона и Крика
были известны две таких формы ДНК: А и В.
Р. Франклин анализировала с помощью Х-хлучей В-форму ДНК
присутствует в водных растворах солей с низкой ионной силой и считается биологически важной конформацией.
В 50-е годы прошлого века использовали дифракцию Х-лучей, затем был разработан монокристалический рентгеновский анализ.
позволило увеличить разрешение.
Слайд 56
С помощью тонких методов исследовали структуру А-ДНК
преобладает в
концентрированных растворах с высокой ионной силой или в сухой
ДНК.
В отличие от В-формы, А-ДНК более компактная.
Виток А-спирали содержит 11 п.н., а диаметр спирали составляет 23А (2,3 нм).
Формы ДНК (слева направо): A, B.
Слайд 57
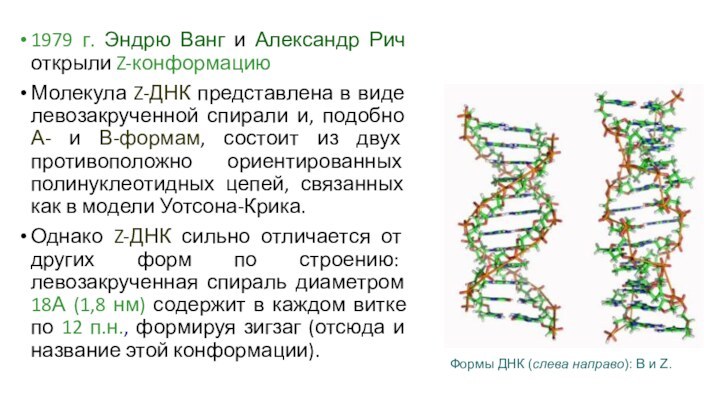
1979 г. Эндрю Ванг и Александр Рич открыли
Z-конформацию
Молекула Z-ДНК представлена в виде левозакрученной спирали и, подобно
А- и В-формам, состоит из двух противоположно ориентированных полинуклеотидных цепей, связанных как в модели Уотсона-Крика.
Однако Z-ДНК сильно отличается от других форм по строению: левозакрученная спираль диаметром 18А (1,8 нм) содержит в каждом витке по 12 п.н., формируя зигзаг (отсюда и название этой конформации).
Формы ДНК (слева направо): B и Z.
Слайд 58
присутствие Z-ДНК in vivo пока не доказано
Слайд 59
Структура РНК
Иногда РНК образует двуцепочечные структуры:
молекула складывается
по длине и между комплеиентарными основаниями двух соседних участков
цепи возникают водородные связи.
молекулы РНК некоторых вирусов, имеют двуцепочечную структуру.
Слайд 60
Известно три основных класса РНК, функционирующих в клетке:
рибосомная РНК (рРНК),
информационная, или матричная РНК (иРНК, мРНК)
транспортная РНК (тРНК).
Вторичная структура РНК большой рибосомальной субъединицы Escherichia coli.
Слайд 61
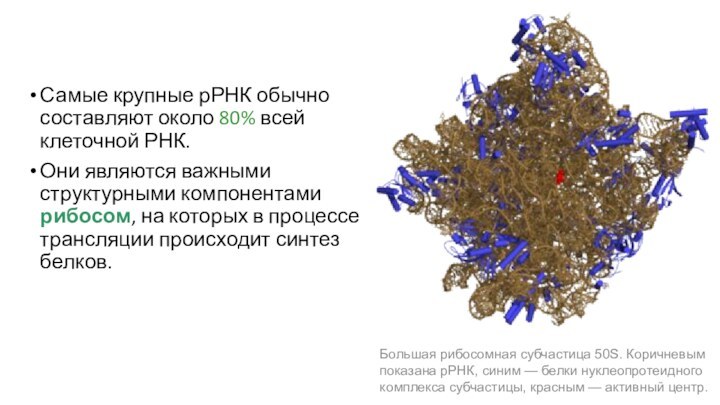
Самые крупные рРНК обычно составляют около 80% всей
клеточной РНК.
Они являются важными структурными компонентами рибосом, на которых
в процессе трансляции происходит синтез белков.
Большая рибосомная субчастица 50S. Коричневым показана рРНК, синим — белки нуклеопротеидного комплекса субчастицы, красным — активный центр.
Слайд 62
Молекулы мРНК переносят генетическую информацию на рибосомы, где
происходит трансляция, они также различны по длине в связи
с различиями между генами, которые транскрибируются с ДНК и кодируемыми ими белками.
Слайд 63
Небольшие молекулы тРНК во время трансляции переносят к
рибосомам аминокислоты – материал для синтеза белков.
Слайд 64
малые ядерные РНК (snRNA, или мяРНК) – участвуют
в процессинге иРНК.
РНК-теломераза – вовлечена в репликацию ДНК на
концах хромосом
Антисмысловая РНК – участвует в регуляции работы генов.
Слайд 65
РНК в качестве генетического материала некоторых вирусов
1956 г.
– вирус табачной мозаики (ВТМ) относится к РНК-содержащим вирусам.
Слайд 66
вирус иммунодефицита человека (ВИЧ), вызывающий СПИД,
некоторые РНК-содержащие
онгогенные (опухолеродные) вирусы.
Слайд 67
Картирование генов у бактерий и бактериофагов
Слайд 68
Бактерии и бактериофаги очень удобны для генетических исследований.
Короткий
репродуктивный цикл: за короткое время можно получить сотни поколений
и исследовать их в чистых культурах.
Слайд 69
Мутации у бактерий и рост популяции бактериальных клеток
Растущие
в культуре бактериальные клетки могут размножаться в разнообразных средах.
До
1943 г. причина такой изменчивости широко обсуждалась среди бактериологов.
-изменчивость индуцируют факторы среды, что приводит к быстрой адаптации бактерий в новой среде.
Слайд 70
1943 г. Сальвадор Луриа и Макс Дельбрюк представили
первые доказательства возможности спонтанных мутаций у бактерий по аналогии
с эукариотами.
Случайно возникающие мутантные клетки можно выделить из культуры и размножить с помощью селективных сред, а затем проанализировать новую мутацию.
Слайд 71
Бактерий выращивают в жидкой среде или в агаре
на чашках Петри.
Минимальная среда, необходимая для роста бактерий, содержит
глюкозу или лактозу – источник органического углерода, а также неорганические соли, содержащие ионы Na+, K+, Mg2+, Ca2+, NH4+.
Растущие на минимальной среде бактерии способны синтезировать все необходимые для этого вещества: аминокислоты, азотистые основания пурины и пиримидины, сахара, витамины, жирные кислоты, и называются прототрофами.
Если способность к синтезу одного или нескольких органических компонентов клетки в результате мутации утрачена, то такие бактерии называются ауксотрофами.
-бактерии не могут синтезировать гистидин.
-в минимальную среду для культивирования нужно добавить именно эту аминокислоту.
-ауксотрофные клетки обозначают his-, а прототрофные – his+.
Слайд 72
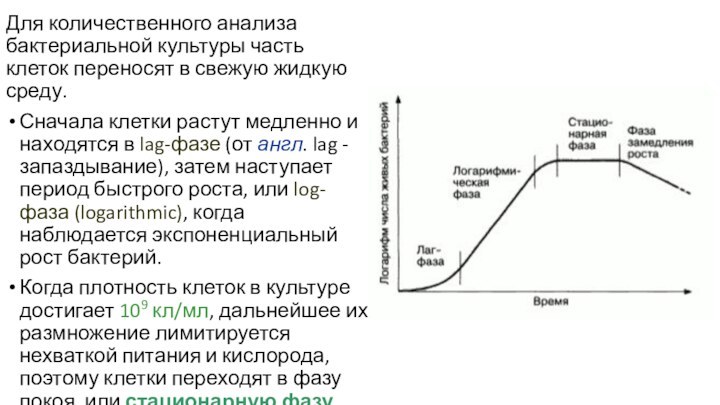
Для количественного анализа бактериальной культуры часть клеток переносят
в свежую жидкую среду.
Сначала клетки растут медленно и находятся
в lag-фазе (от англ. lag - запаздывание), затем наступает период быстрого роста, или log-фаза (logarithmic), когда наблюдается экспоненциальный рост бактерий.
Когда плотность клеток в культуре достигает 109 кл/мл, дальнейшее их размножение лимитируется нехваткой питания и кислорода, поэтому клетки переходят в фазу покоя, или стационарную фазу.
Слайд 73
Для подсчета клеток определенный объем бактериальной культуры высевают
из жидкой среды в чашки Петри, на плотную питательную
среду с агаром, где каждая из клеток вскоре дает отдельную колонию потомков.
Для удобства подсчета колоний жидкую культуру разводят и на агар переносят разные серии разведений, а затем выбирают оптимальную.
Слайд 74
С разведением культуры плотность клеток падает и соответственно
уменьшается число клеток, дающих начало отдельным колониям.
Число колоний, умноженное
на коэффициент разведения, говорит о численности клеток в культуре.
Слайд 75
Генетическая рекомбинация у бактерий: конъюгация
1946 г. Джошуа Ледерберг
и Эдвард Татум обнаружили конъюгацию – процесс передачи генов
от одной бактериальной клетки другой, сопровождающийся генной рекомбинацией.
Генетическая рекомбинация у бактерий и бактериофагов приводит к замещению одного или нескольких генов клеток одного штамма генами из клеток другого штамма.
Слайд 76
Ледерберг и Татум работали с различными ауксотрофными штаммами
E. coli K12.
штамм А: метионин и биотин
штамм В: треонин,
лейцин и тиамин.
Слайд 77
В эксперименте прототрофные клетки возникали с частотой 1/107
(10-7).
Слайд 78
Бактерии F+ И F--типа
Многочисленные эксперименты, проведенные вслед за
опытами Ледерберга и Татума, показали, что между разными бактериальными
клетками наблюдается перенос генетического материала в одном направлении.
Два половых типа, обнаруженные у E.coli были обозначены F+-клетки (fertility, доноры) и F--клетки (реципиенты).
Слайд 79
для передачи генов необходим тесный контакт двух клеток.
Бернард
Дэвис доказал это с помощью стеклянной трубки, изогнутой в
виде буквы U.
F+ и F--клетки росли в общей культуральной среде, но были разделены мелкопористым стеклянным фильтром, препятствующим смешиванию бактерий, но не мешающим циркуляции среды.
Затем Дэвис помещал клетки этих типов на минимальную среду по обе стороны от фильтра, но не обнаружил прототрофных бактерий.
Поэтому он сделал вывод о необходимости для генетической рекомбинации физического контакта клеток разных штаммов.
Сейчас известно, что контакт клеток происходит в самом начале конъюгации и заканчивается передачей F--фактора, или полового фактора.
Слайд 80
Джошуа и Эстер Ледерберги, Вильям Найес и Лукас
Кавалли-Сфорца
после конъюгации и генетической рекомбинации F-фактор несут все
клетки реципиенты, то есть реципиентам передается F-фактор в виде самореплицирующейся ДНК.
Клетки E.coli могут содержать несколько разных генетических элементов, способных к саморепликации и существующих отдельно от бактериальной хромосомы.
Они представлены кольцевыми молекулами ДНК размером от тысячи пар нуклеотидов до трети длины бактериальной хромосомы, равной 3,2 х106 п.н.
Слайд 81
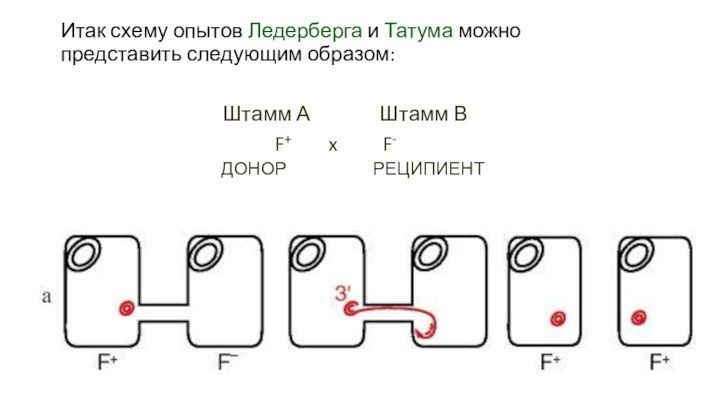
Итак схему опытов Ледерберга и Татума можно представить
следующим образом:
Штамм А Штамм В
F+ x F-
ДОНОР
РЕЦИПИЕНТ
Слайд 82
Анализ структуры выделенного из бактерий F-фага показал, что
он состоит из кольцевой двухцепочечной ДНК и занимает около
2% от длины бактериальной хромосомы.
F-фактор (эписома), кроме других генов, содержит 19 генов, продукты которых участвуют в переносе генетической информации в клетки-реципиенты.
Некоторые из этих генов кодируют белки пилей – структур, напоминающих трубочки, которые расположены на поверхности F+-клеток.
Слайд 83
Считается, что перенос F-фактора во время конъюгации бактерий
включает образование цитоплазматического мостика – конъюгационной трубки между клетками
и репликацию кольцевой ДНК F-фактора таким образом, что надрезанный эндонуклеазой одноцепочечный конец ДНК проникает в F--клетку и там синтезируется комплементарная цепь.
В результате, обе клетки несут F+-фактор.
Слайд 84
Бактериальные штаммы Hfr и хромосомное картирование
1950 г. Кавалли-Сфорца
воздействовал на F+-клетки азотистым соединением, полученным из горчицы, которое
индуцирует мутации.
Из этих клеток был получен штамм бактерий, при скрещивании которых с F-клетками рекомбинанты образуются с частотой 1/104 (10-4), то есть в 1000 раз чаще обычного.
1953 г. Хайес выделил другой штамм кишечной палочки с таким же свойством.
Оба штамма обозначили Hfr (от англ. high frequency recombination).
Слайд 85
Если бактерий-доноров из штамма Hfr скрещивать с бактериями-реципиентами,
то в результате генетической рекомбинации последние не превращаются в
клетки Hfr, а остаются F--клетками:
F+ x F- → F+
Hfr x F- → F-
Слайд 86
Оказалось, что такая неслучайная рекомбинация затрагивает в различных
штаммах Hfr различные гены.
Хайес объяснил эти различия в частоте
рекомбинаций тем, что F-фактор претерпел некоторые физиологические изменения, что привело к появлению разных Hfr-штаммов E.coli.
Слайд 87
В середине 50-х годов ХХ века Элли Вольман
и Франсуа Жакоб объяснили различия между F+- и Hfr-клетками
с помощью экспериментов по картированию хромосомы E.coli.
Слайд 88
метод прерывания скрещивания.
В первые 8 минут после смешивания
культур генетической рекомбинации между поступившими от донора генами и
генами F--клетки не происходит.
Через 10 минут наблюдали рекомбинацию генов, обуславливающих устойчивость к азиду (azi), но не перенос к устойчивости к фагу Т1 (tons), утилизации лактозы (lac+) и галактозы (gal+).
Через 15 минут 70% рекомбинантных клеток содержали ген azi+, 30% - ген tons, но переноса генов lac+ и gal+ еще не обнаруживали.
Примерно через 20 минут среди рекомбинантов появились клетки lac+ растущие на среде без лактозы, а через 25 минут – клетки gal+.
Вольман и Жакоб показали, что порядок передачи генов от донора к реципиенту коррелирует с продолжительностью конъюгации этих клеток.
Слайд 89
расстояние между линейно расположенными генами на хромосоме E.coli
можно измерить в минутах и определить экспериментально.
Слайд 90
Сходные результаты были получены Вольман и Жакобом и
на других штаммах Hfr, однако обнаружились важные различия.
Гены всегда
переходили из клетки в клетку в линейном порядке, но в зависимости от штамма, последовательность передачи генов менялась.
Слайд 91
Основное различие касается точки начала переноса (О) и
направления переноса генов из клетки в клетку.
Схема последовательности передачи
генетического материала при конъюгации E. coli, иллюстрирующая кольцевую структуру бактериальной хромосомы. Буквами обозначены различные гены. Правая стрелка — последовательность передачи генов (В,Г ,Д,Е,А,Б) реципиенту донорным штаммом 1; левая стрелка — последовательность передачи генов (Д,Г, В,Б,А,Е) реципиенту донорным штаммом 2
Слайд 92
Вольман и Жакоб предположили, что хромосома E.coli представляет
собой замкнутое кольцо, а точка начала переноса варьирует от
штамма к штамму.
Позиция F-фактора во время конъюгации клеток Hfr и F- и определяет начальную точку переноса генов.
Последним в реципиентную клетку попадает сам F-фактор.
Схема конъюгации у бактерий: а - передача F плазмиды из F+- в F--клетку; б - передача бактериальной хромосомы Hfr * F-
Слайд 93
После репликации гены донорской ДНК могут рекомбинировать с
гомологичными генами клетки-реципиента.
Слайд 94
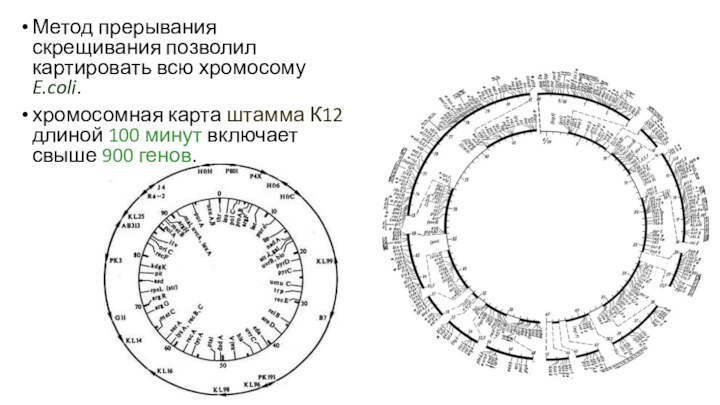
Метод прерывания скрещивания позволил картировать всю хромосому E.coli.
хромосомная
карта штамма К12 длиной 100 минут включает свыше 900
генов.
Слайд 95
F’-элемент и мерозиготы
1959 г. Эдвард Адельберг в экспериментах
с клетками Hfr E.coli обнаружил, что интегрированный в бактериальную
хромосому F-фактор может превращаться в эписому, при этом клетки приобретают свойства штамма F+.
Становясь эписомой, F-факторы часто «захватывают» соседние бактериальные гены.
Альдерберг обозначил клетки с F-фактором в виде эписомы как F’, в отличие от бактерий F+ и Hfr.
Слайд 96
Присутствие бактериальных генов в составе эписомы (F-фактора) приводит
к тому, что бактерии типа F’ ведут себя как
F+ и конъюгируют с клетками F-.
В процессе конъюгации F-фактор, несущий некоторые бактериальные гены, попадает в F--клетки.
В результате, часть бактериальных генов представлена дважды.
Такие частично диплоидные клетки называют мерозиготами.
Слайд 97
F-факторы и плазмиды
Когда экстрахромосомный F-фактор находится в цитоплазме
бактериальной клетки, он состоит из двуспиральной кольцевой молекулы ДНК.
Такие
хромосомные структуры называются плазмидами.
Плазмиды содержат один или несколько генов, репликация которых зависит от ферментов, участвующих в репликации клеточных генов.
Слайд 98
Классификация плазмид:
F-фактор – содержит гены, определяющие фертильность и
ответственные за формирование половых пилей, важных для генетической рекомбинации.
R-плазмиды
Col-плазмиды
Слайд 99
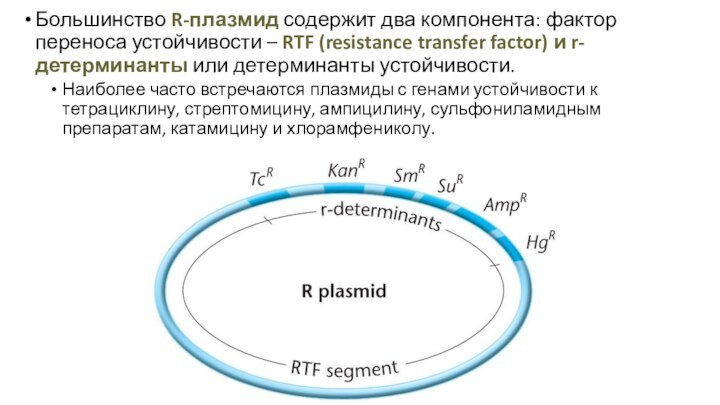
Большинство R-плазмид содержит два компонента: фактор переноса устойчивости
– RTF (resistance transfer factor) и r-детерминанты или детерминанты
устойчивости.
Наиболее часто встречаются плазмиды с генами устойчивости к тетрациклину, стрептомицину, ампицилину, сульфониламидным препаратам, катамицину и хлорамфениколу.
Слайд 100
Плазмиды типа Col, в частности, ColE1, кодируют от
одного до нескольких белков – колицинов, которые очень токсичны
для бактерий, не содержащих этой плазмиды.
Колицины могут убивать бактериальные клетки, соседствующие с колициногенной бактерией.
Плазмиды несут также 10 – 20 копий генов, кодирующих белок-протектор, защищающий клетку-хозяина от действия колицинов.
Слайд 101
Бактериальная трансформация
В результате трансформации происходит генетическая рекомбинация между
бактериальными клетками.
Слайд 102
включает несколько этапов
(1) попадание фрагментов ДНК в клетку-реципиента
(2) рекомбинация между этой ДНК и гомологичными генами реципиента.
Внехромосомная
ДНК может проникнуть только в компетентные клетки, несущие на своей поверхности несколько рецепторных сайтов.
Слайд 103
После поступления фрагмента ДНК в бактериальную клетку одна
из нитей двуспиральной молекулы разрушается нуклеазами, а другая участвует
в трансформации.
Оставшаяся нить ДНК образует синапс с гомологичным участком хромосомы и рекомбинирует с ним.
Слайд 104
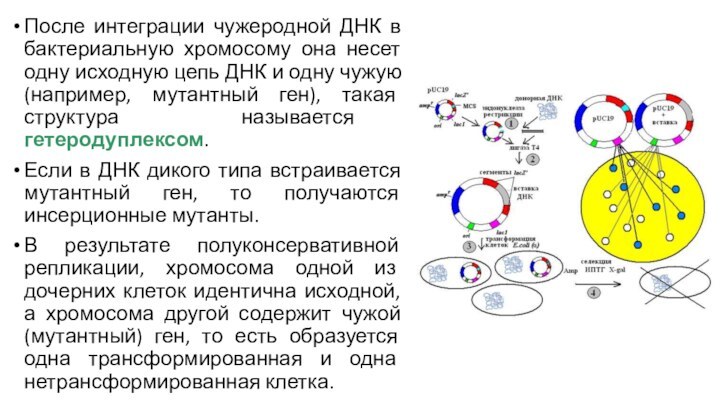
После интеграции чужеродной ДНК в бактериальную хромосому она
несет одну исходную цепь ДНК и одну чужую (например,
мутантный ген), такая структура называется гетеродуплексом.
Если в ДНК дикого типа встраивается мутантный ген, то получаются инсерционные мутанты.
В результате полуконсервативной репликации, хромосома одной из дочерних клеток идентична исходной, а хромосома другой содержит чужой (мутантный) ген, то есть образуется одна трансформированная и одна нетрансформированная клетка.
Слайд 105
Трансформация и сцепленные гены
Для эффективности трансформации фрагмент ДНК
должен содержать от 10 000 до 20 000 п.н.,
то есть около 1/200 длины хромосомы E.coli.
Слайд 106
трансформация характерна для многих бактерий, включая Diplococcus pneumoniae,
Hemophilus influenzae, Bacillus subtilis, Shigella paradysenteriae и E.coli.
Escherichia coli
Streptococcus pneumoniae
Haemophilus
influenzae
Sporulating B. subtilis.
Слайд 107
Генетические исследования бактериофагов
Бактериофаги, или фаги – это бактериальные
вирусы, которые могут участвовать в передаче генетической информации путем
трансдукции.
Слайд 108
Фаг Т4: структура и жизненный цикл
Бактериофаг Т4 –
представитель группы близких бактериальных вирусов – Т-четных фагов.
ДНК этого
крупного фага (182 000 п.н.) помещена в белковый двадцатигранник, формирующий головку, или капсид вируса.
Фаговой ДНК достаточно для кодирования более 150 генов.
Головка соединяется с хвостом, состоящим из воротника, полой трубки и сократительной оболочки, или чехла вокруг кора (центральной части).
К хвосту фага крепятся нити-фибриллы, на концах которых имеются сайты связывания с определенными участками на поверхности клеточной стенки бактерии-хозяина: E.coli.
Слайд 109
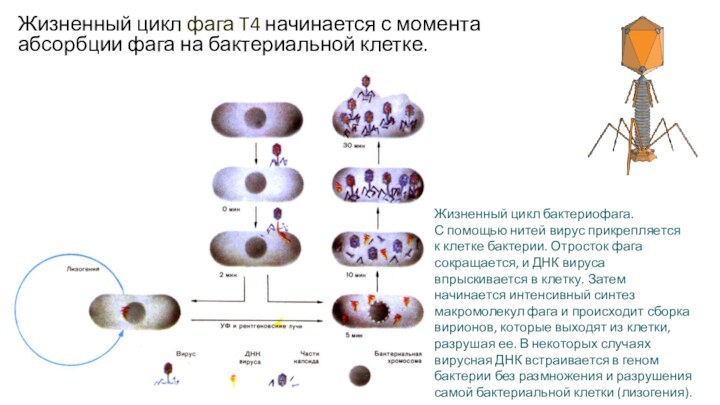
Жизненный цикл фага T4 начинается с момента абсорбции
фага на бактериальной клетке.
Жизненный цикл бактериофага. С помощью нитей вирус
прикрепляется к клетке бактерии. Отросток фага сокращается, и ДНК вируса впрыскивается в клетку. Затем начинается интенсивный синтез макромолекул фага и происходит сборка вирионов, которые выходят из клетки, разрушая ее. В некоторых случаях вирусная ДНК встраивается в геном бактерии без размножения и разрушения самой бактериальной клетки (лизогения).
Слайд 110
Сборку фаговых частиц подробно изучали Вильям Вуд, Роберт
Эдгар и другие исследователи, которые выделили три последовательных этапа:
упаковку ДНК в головки
(2) сборку хвостов
(3) сборку хвостовых фибрилл
Слайд 111
После того как закончится сборка около 200 вирусных
частиц, бактериальная клетка разрушается под действием лизоцима – фермента,
который кодируется фаговой ДНК.
Слайд 112
Метод бляшек
В одном мл инфицированной культуры, например, содержится
более 1010 вирусных частиц.
Количественный анализ фагов после инфекции определенных
бактериальных штаммов лежит в основе метода бляшек.
Слайд 113
проводят серийное разведение инфицированной бактериальной культуры.
по 0,1 мл
каждого из разведений наносят в жидкий агар (около 3
мл), содержащий несколько капель неинфицированной бактериальной культуры.
эту смесь распределяют на поверхности твердого агара в чашки Петри и инкубируют непродолжительное время.
на поверхности среды среди газона бактериальных клеток появляются пятна, или бляшки – результат гибели бактерий, инфицированных фагом – соответствующие клонам инфицированных клеток.
Если разведение культуры было небольшим, то образуется множество бляшек, которые затем сливаются и зона лизиса клеток захватывает весь бактериальный газон на поверхности среды.
Так получается, например, при разведении 10-3.
По мере роста коэффициента разведения можно подсчитать количество бляшек и плотность вирусных частиц в исходной инфицированной культуре:
Число бляшек/мл среды х коэффициент разведения.
Слайд 114
Лизогения
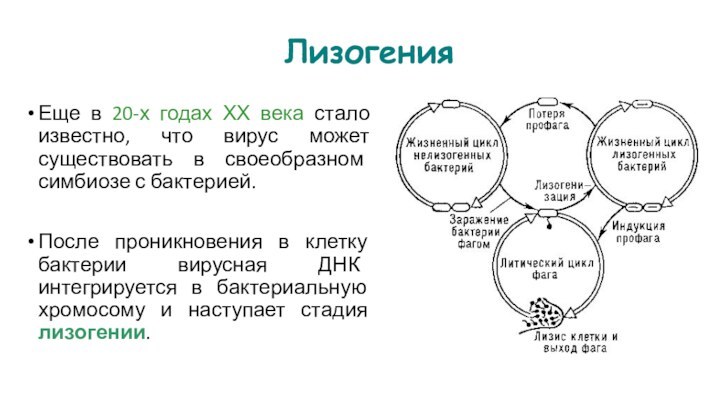
Еще в 20-х годах ХХ века стало известно,
что вирус может существовать в своеобразном симбиозе с бактерией.
После
проникновения в клетку бактерии вирусная ДНК интегрируется в бактериальную хромосому и наступает стадия лизогении.
Слайд 115
Вирусная ДНК интегрирует в хромосому в виде профага.
Вирусы,
которые могут лизировать бактерии, а также встраиваться в их
хромосомы называются умеренными, а вирусы, которые всегда лизируют бактериальные клетки – вирулентными.
Бактерии, содержащие профаги, называются лизогенными, они могут лизироваться в результате индукции профага.
Вирусная ДНК, реплицирующаяся либо в составе бактериальной хромосомы, либо автономно, в цитоплазме клетки относится к эписомам.
Слайд 116
Трансдукция:
перенос бактериальной ДНК вирусом
1952 г. Нортон Зиндер
и Джошуа Ледерберг исследовали рекомбинацию у бактерии Salmonella typhimurium.
После
смешения двух различных ауксотрофных штаммов бактерий они обнаружили прототрофные клетки, но оказалось, что рекомбинация между бактериями по своему механизму отличается от переноса F-фактора у E.coli.
Открытая таким образом рекомбинация у бактерий была обусловлена бактериофагами и получила название трансдукции.
Слайд 117
Эксперимент Зиндера-Ледерберга
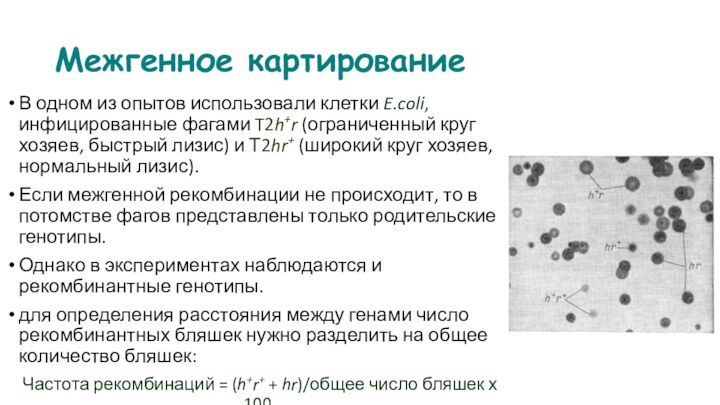
Ледерберг и Зиндер смешали между собой два
ауксотрофных штамма Salmonella LA-22 и LA-2 и поместили смесь
на минимальную питательную среду для выявления прототрофных клеток.
LA-22 не способны синтезировать фенилаланин и триптофан (phe- trp-)
LA-2 не синтезируют метионин и гистидин (met- his-).
Прототрофы (phe+ trp+ met+ his+) появлялись в смешанной культуре с частотой 1/105 (или 10-5).
Слайд 118
После совместной инкубации в трубке Дэвиса штаммы поместили
на разные чашки с минимальной средой и обнаружили, что
прототрофы появились только в половине трубки с бактериями штамма LA-22.
неизвестную причину назвали фильтрующим агентом (FA), который удалось идентифицировать благодаря следующим наблюдениям:
1. Клетки штамма LA-2 продуцировали FA только в том случае, если они росли в одной среде с бактериями штамма LA-22.
2. Наличие расщепляющей ДНК эндонуклеазы не влияет на активность FA, поэтому в трансформации участвуют не отдельные молекулы ДНК.
3. FA не проходит через фильтр трубки Дэвиса, если диаметр пор меньше размеров бактериофагов.
Слайд 119
С учетом этих наблюдений, а также возможности инфекции
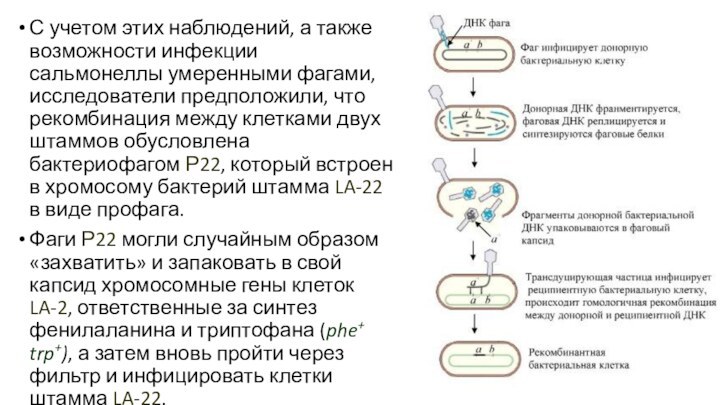
сальмонеллы умеренными фагами, исследователи предположили, что рекомбинация между клетками
двух штаммов обусловлена бактериофагом Р22, который встроен в хромосому бактерий штамма LA-22 в виде профага.
Фаги Р22 могли случайным образом «захватить» и запаковать в свой капсид хромосомные гены клеток LA-2, ответственные за синтез фенилаланина и триптофана (phe+ trp+), а затем вновь пройти через фильтр и инфицировать клетки штамма LA-22.
Слайд 120
Природа трансдукции
трансдукция у E.coli связана с инфекцией фагами
P1 и λ, а Bacillus subtilis и Pseudomonas aeruginosa
– фагами SPO1 и F116 соответственно.
Слайд 121
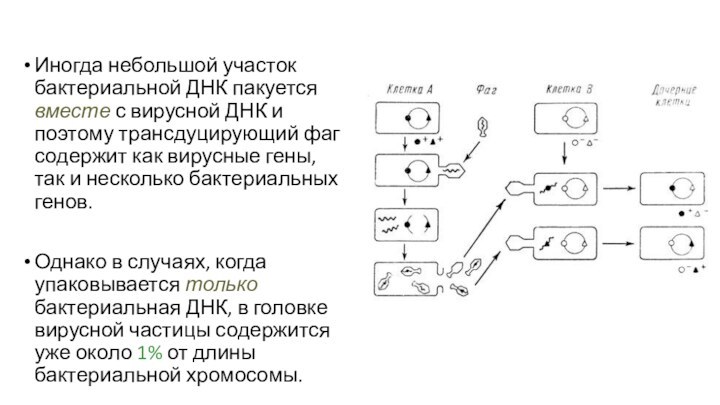
Иногда небольшой участок бактериальной ДНК пакуется вместе с
вирусной ДНК и поэтому трансдуцирующий фаг содержит как вирусные
гены, так и несколько бактериальных генов.
Однако в случаях, когда упаковывается только бактериальная ДНК, в головке вирусной частицы содержится уже около 1% от длины бактериальной хромосомы.
Слайд 122
Когда фаг инъецирует в бактерию не вирусную, а
бактериальную ДНК, она
остается в цитоплазме
рекомбинирует с гомологичным
участком хромосомы.
В первом случае эта ДНК не реплицируется , а попадает при делении бактерии в одну из дочерних бактериальных клеток.
В таком случае частично диплоидной становится только одна клетка, то есть происходит абортивная трансдукция.
Если бактериальная ДНК рекомбинирует с гомологичным участком бактериальной хромосомы, то трансдуцированные гены реплицируются в составе этой хромосомы и в процессе деления передаются во все дочерние клетки.
полная трансдукция
наблюдается в 10 – 20 раз реже
Слайд 123
Трансдукционное картирование
Фрагменты бактериальной ДНК, вовлеченные в трансдукцию, достаточно
велики и содержат целый ряд генов.
В результате, два тесно
сцепленных на бактериальной хромосоме гена в процессе котрансдукции (совместной трансдукции) могут переноситься в бактериальную клетку одновременно.
Слайд 124
Межгенная рекомбинация и картирование у бактериофагов
К 1947 г.
сразу несколько исследовательских групп обнаружили у бактериофагов межгенную рекомбинацию.
Слайд 125
Мутации у бактериофагов
1946 г. Альфред Херши наблюдал необычные
по морфологии бляшки на агаре с клетками E.coli штамма
В, инфицированных штаммом Т2.
Нормальные бляшки небольшие по размеру с хорошо видным центром и окружены едва заметным диффузным кольцом.
У необычных по морфологии бляшек диффузная область шире.
Херши назвал такую мутацию быстрый лизис (r – rapid lysis), поскольку наблюдаемые им бляшки были больше обычных, что связано с более активным лизисом клеток.
размножение немутантных фагов ингибируется при достижении определенных размеров бляшек.
Фаги Т2, несущие мутацию r, преодолевают это ограничение и формируют более крупные бляшки.
Слайд 126
Мутации у бактериофагов
Другую мутацию фага Т2, известную как
круг хозяев (h – host range), описал Лурия.
Эта мутация
обуславливает круг бактериальных хозяев, которых может инфицировать фаг.
Нормальные вирусы инфицируют клетки штамма В, но не клетки штамма В-2.
Фаги с мутацией h могут абсорбироваться и инфицировать клетки штамма В-2.
Если смешать оба штамма E.coli и высеять смесь на агар, то бляшки, возникшие в результате лизиса бактерий, инфицированных мутантным фагом h, в центре более темные, чем в случае лизиса фагом дикого типа h+.
Слайд 127
Межгенное картирование
Генетическую рекомбинацию у бактериофагов открыли во время
экспериментов по одновременной смешанной инфекции бактерий двумя мутантными штаммами
вирусов.
Поскольку в рекомбинацию вовлекаются два разных локуса, она называется межгенной.