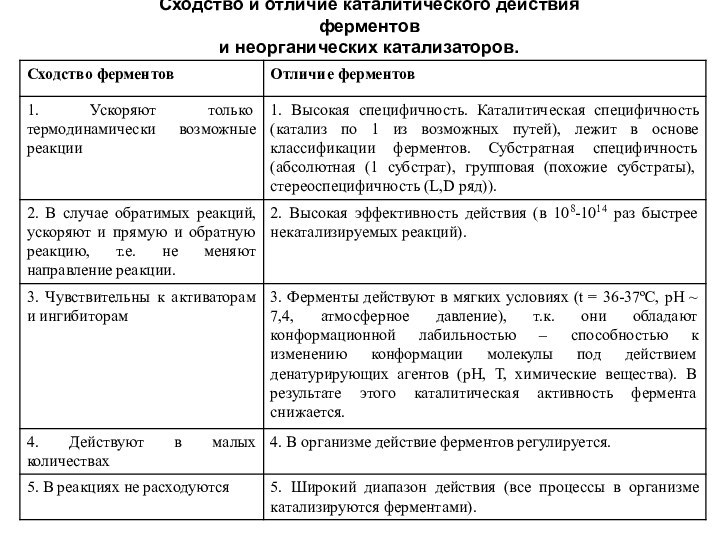
Слайд 2
ФЕРМЕНТЫ (энзимы) - это высокоспецифичные белки, выполняющие функции
биологических катализаторов.
Катализатор - это вещество, которое ускоряет химическую
реакцию, но само в ходе этой реакции не расходуется.
Субстратом (S) называют вещество, химические превращения которого в продукт (Р) катализирует фермент (Е).
Слайд 3
Ферменты могут быть простыми или сложными белками. Если
фермент - сложный белок, то его небелковую часть называют
коферментом, а белковую - апоферментом. Апофермент с коферментом образует активную форму катализатора – холофермент.
Очень часто кофермент синтезируется из витаминов, которые не синтезируются в организме и должны поступать с пищей.
Слайд 4
Роль ионов металлов: Zn2+, Mg2+, Fe2+, Cu2+ и
т.д.
Механизмы участия ионов металлов в ферментативных реакциях различны.
Металл может являться частью активного центра фермента и участвовать в катализе. Он может быть связующим звеном между ферментом и субстратом, может проявлять координирующее свойство, благодаря которому субстрат оказывается в активном центре фермента.
Слайд 5
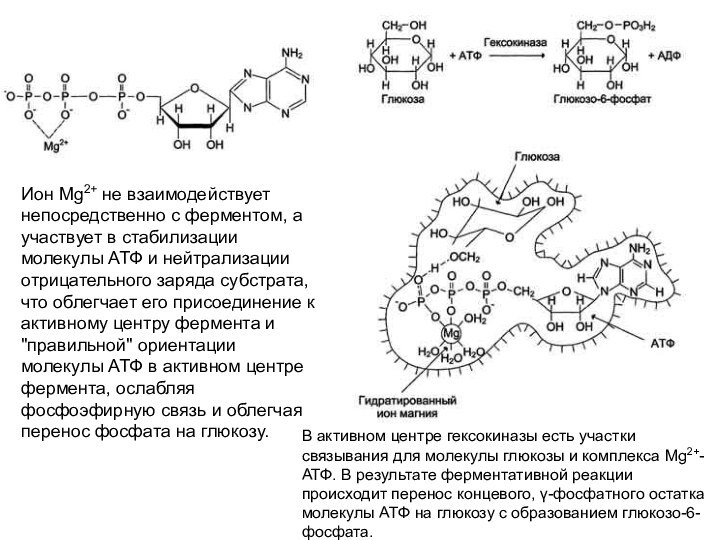
Ион Mg2+ не взаимодействует непосредственно с ферментом, а
участвует в стабилизации молекулы АТФ и нейтрализации отрицательного заряда
субстрата, что облегчает его присоединение к активному центру фермента и "правильной" ориентации молекулы АТФ в активном центре фермента, ослабляя фосфоэфирную связь и облегчая перенос фосфата на глюкозу.
В активном центре гексокиназы есть участки связывания для молекулы глюкозы и комплекса Мg2+-АТФ. В результате ферментативной реакции происходит перенос концевого, γ-фосфатного остатка молекулы АТФ на глюкозу с образованием глюкозо-6-фосфата.
Слайд 6
Поскольку ферменты - белковые молекулы, следовательно, они обладают
всеми свойствами, характерными для белков. В то же время
они имеют особенности строения, характеризующие их как катализаторы.
Основные свойства ферментов как биологических катализаторов
Слайд 7
Активный центр ферментов - это определенный участок белковой
молекулы, способный комплементарно связываться с субстратом и обеспечивающий его
каталитическое превращение. Структура активного центра сформирована радикалами аминокислот, так же как и в случае активного центра любого белка. В активном центре фермента имеются аминокислотные остатки, функциональные группы которых обеспечивают комплементарное связывание субстрата (участок связывания), и аминокислотные остатки, функциональные группы которых осуществляют химическое превращение субстрата (каталитический участок), однако следует помнить, что не всегда эти участки имеют чёткое пространственное разделение и иногда могут "перекрываться".
Слайд 8
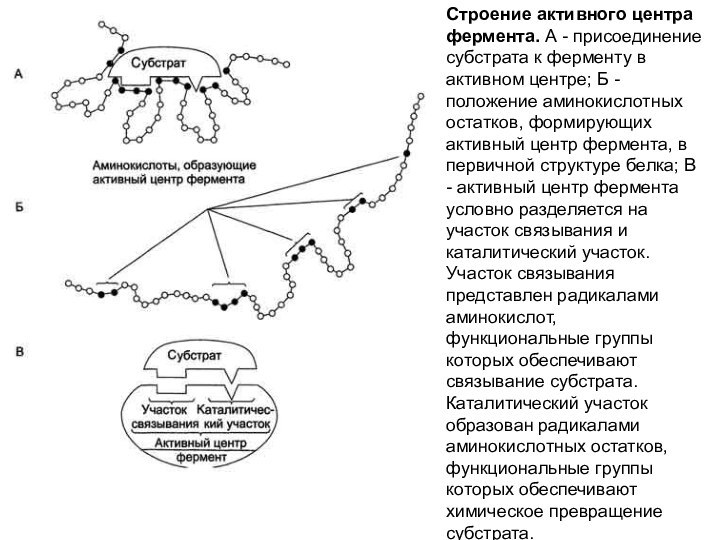
Строение активного центра фермента. А - присоединение субстрата
к ферменту в активном центре; Б - положение аминокислотных
остатков, формирующих активный центр фермента, в первичной структуре белка; В - активный центр фермента условно разделяется на участок связывания и каталитический участок. Участок связывания представлен радикалами аминокислот, функциональные группы которых обеспечивают связывание субстрата. Каталитический участок образован радикалами аминокислотных остатков, функциональные группы которых обеспечивают химическое превращение субстрата.
Слайд 9
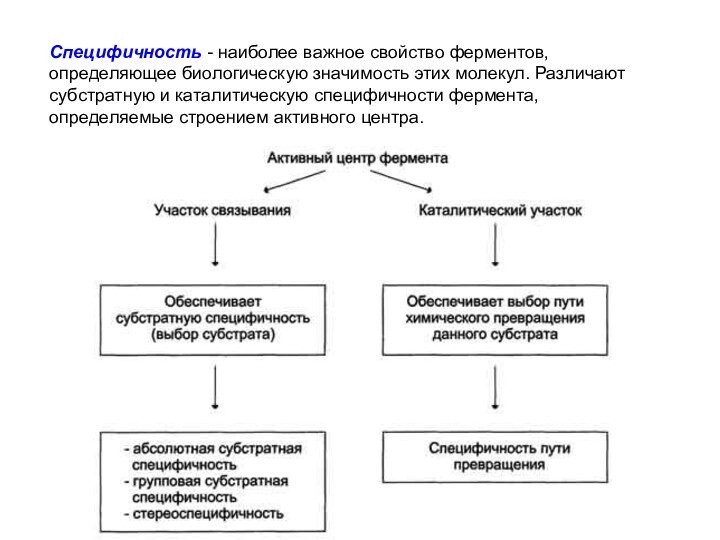
Специфичность - наиболее важное свойство ферментов, определяющее биологическую
значимость этих молекул. Различают субстратную и каталитическую специфичности фермента,
определяемые строением активного центра.
Слайд 10
Субстратная специфичность
Под субстратной специфичностью понимают способность каждого
фермента взаимодействовать лишь с одним или несколькими определёнными субстратами.
Различают:
● абсолютную субстратную специфичность;
● групповую субстратную специфичность;
● стереоспецифичность.
Слайд 11
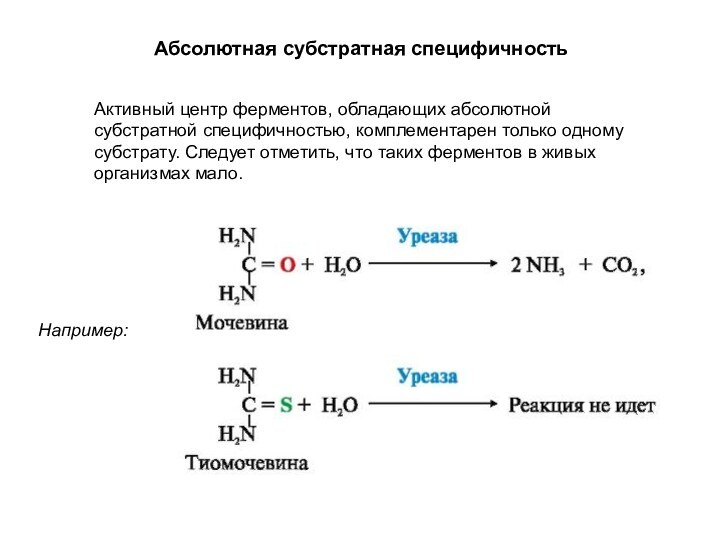
Активный центр ферментов, обладающих абсолютной субстратной специфичностью, комплементарен
только одному субстрату. Следует отметить, что таких ферментов в
живых организмах мало.
Абсолютная субстратная специфичность
Например:
Слайд 12
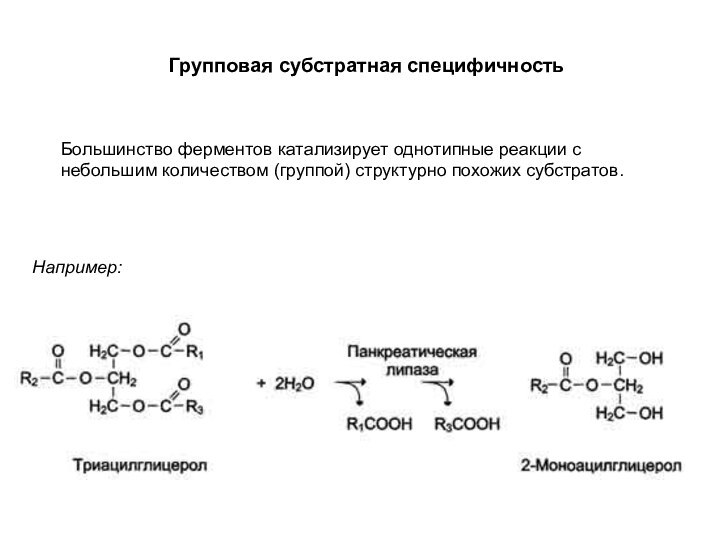
Групповая субстратная специфичность
Большинство ферментов катализирует однотипные реакции
с небольшим количеством (группой) структурно похожих субстратов.
Например:
Слайд 13
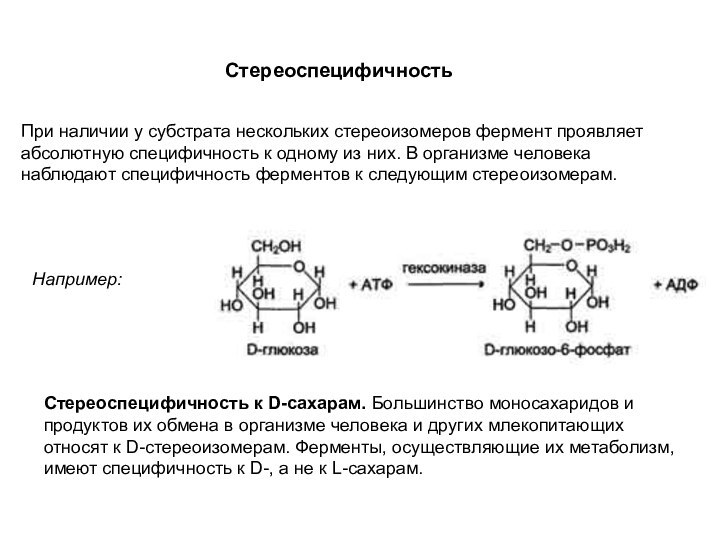
Стереоспецифичность
При наличии у субстрата нескольких стереоизомеров фермент
проявляет абсолютную специфичность к одному из них. В организме
человека наблюдают специфичность ферментов к следующим стереоизомерам.
Стереоспецифичность к D-сахарам. Большинство моносахаридов и продуктов их обмена в организме человека и других млекопитающих относят к D-стереоизомерам. Ферменты, осуществляющие их метаболизм, имеют специфичность к D-, а не к L-сахарам.
Например:
Слайд 14
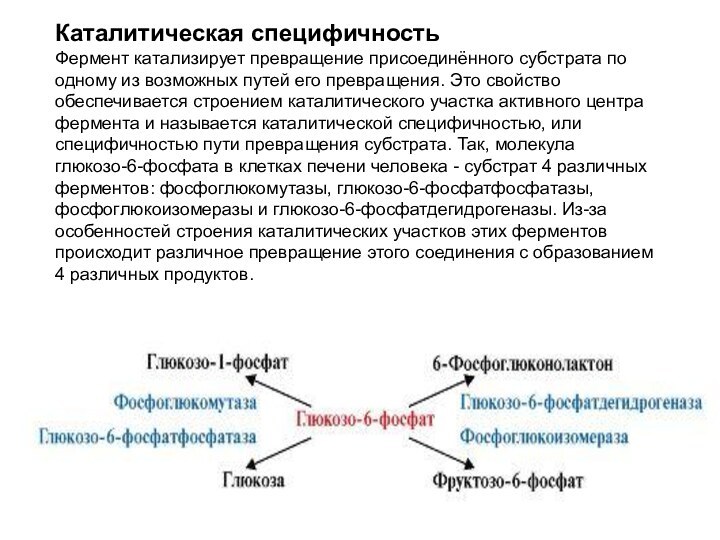
Каталитическая специфичность
Фермент катализирует превращение присоединённого субстрата по
одному из возможных путей его превращения. Это свойство обеспечивается
строением каталитического участка активного центра фермента и называется каталитической специфичностью, или специфичностью пути превращения субстрата. Так, молекула глюкозо-6-фосфата в клетках печени человека - субстрат 4 различных ферментов: фосфоглюкомутазы, глюкозо-6-фосфатфосфатазы, фосфоглюкоизомеразы и глюкозо-6-фосфатдегидрогеназы. Из-за особенностей строения каталитических участков этих ферментов происходит различное превращение этого соединения с образованием 4 различных продуктов.
Слайд 15
Для ферментов характерны:
• специфичность.
• каталитическая эффективность. Большинство катализируемых
ферментами реакций высокоэффективны, они протекают в 108-1014 раз быстрее,
чем некатализируемые реакции.
• конформационная лабильность. Каталитическая эффективность фермента, как и любой белковой молекулы, зависит от его конформации и, в частности, от конформации активного центра. В клетках имеются вещества, которые могут вызывать незначительные изменения конформации молекулы фермента за счет разрыва одних и образования других слабых связей; это может вызывать как повышение, так и снижение активности фермента.
Слайд 16
• Активность ферментов может регулироваться. Действие ферментов в
клетке, как правило, строго упорядочено: продукт одной ферментативной реакции
является субстратом другой; таким образом образуются метаболические пути. Среди множества ферментов практически каждого метаболического пути имеются ключевые, или регуляторные, ферменты, активность которых может изменяться в зависимости от потребности клетки в конечном продукте метаболического пути.
• Оптимальные условия протекания ферментативных реакций: температура 37-38 °С, нормальное атмосферное давление, рН 6,9-7,7, характерное для большинства тканей. В отличие от этого для эффективного химического катализа часто требуются высокие температура и давление, а также экстремальные значения рН.
Слайд 17
ОСОБЕННОСТИ ФЕРМЕНТАТИВНОГО КАТАЛИЗА
Слайд 18
Условия, необходимы для химического взаимодействия молекул, чтобы произошла
химическая реакция:
1) Молекулы должны сблизиться (столкнуться). Но не
всякое столкновение приводит к взаимодействию.
2) Необходимо, чтобы это столкновение стало эффективным - завершилось бы химическим превращением. Обязательное условие для эффективности столкновения: запас энергии молекул в момент столкновения должен быть не ниже энергетического барьера реакции (или энергии активации Еа).
Слайд 19
При достижении этого энергетического барьера в молекуле происходят
изменения, вызывающие перераспределение химических связей и образование новых соединений.
Говорят, что молекулы, обладающие Еа, находятся в переходном состоянии. Разницу энергий между исходным реагентом (реагентами) и конечным соединением (соединениями) называют изменением свободной энергии реакции ∆G.
Слайд 20
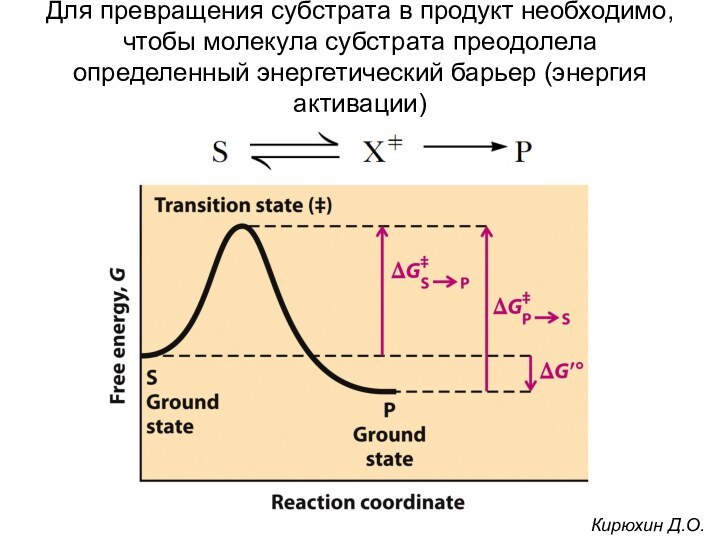
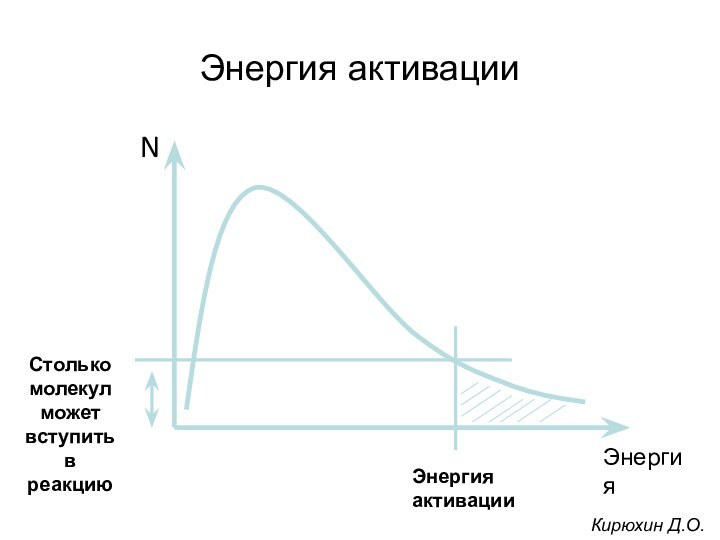
Для превращения субстрата в продукт необходимо, чтобы молекула
субстрата преодолела определенный энергетический барьер (энергия активации)
Кирюхин Д.О.
Слайд 21
Чем больше молекул обладает энергией, превышающей уровень Еа,
тем выше скорость химической реакции. Повысить скорость химической реакции
можно нагреванием. При этом увеличивается энергия реагирующих молекул. Однако для живых организмов высокие температуры губительны, поэтому в клетке для ускорения химических реакций используются ферменты. Ферменты обеспечивают высокую скорость реакций при оптимальных условиях, существующих в клетке, путём понижения уровня Еа. Таким образом, ферменты снижают высоту энергетического барьера, в результате возрастает количество реакционно-способных молекул, следовательно, увеличивается скорость реакции.
Слайд 23
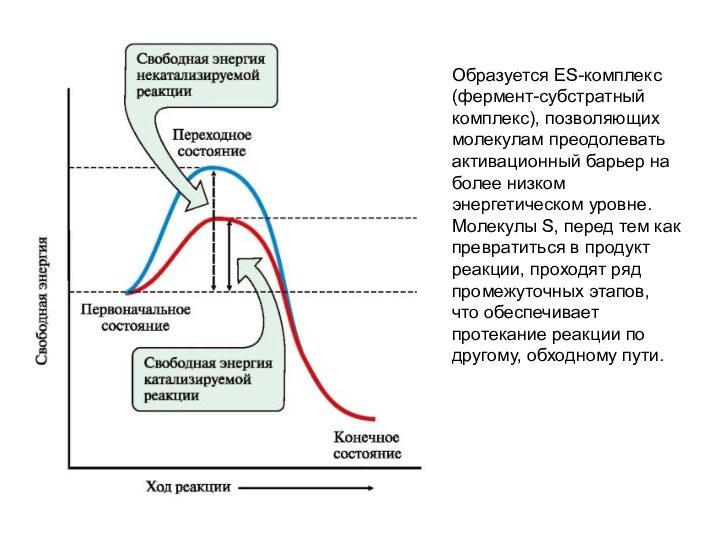
Образуется ES-комплекс (фермент-субстратный комплекс), позволяющих молекулам преодолевать активационный
барьер на более низком энергетическом уровне. Молекулы S, перед
тем как превратиться в продукт реакции, проходят ряд промежуточных этапов, что обеспечивает протекание реакции по другому, обходному пути.
Слайд 24
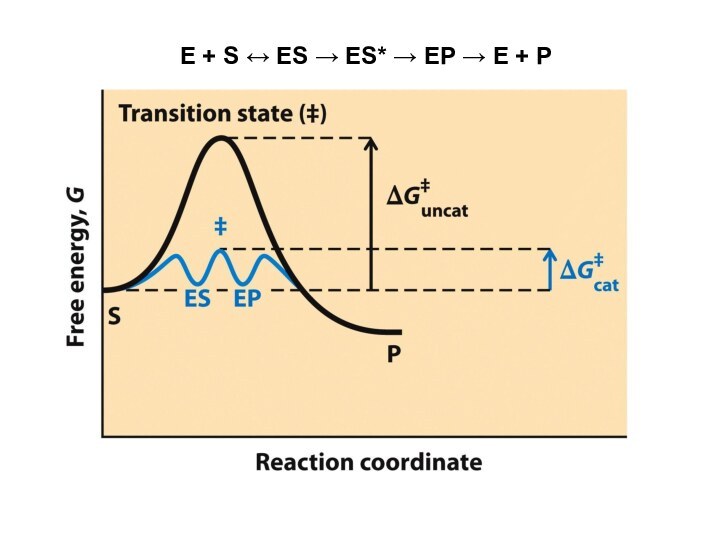
• На первом этапе фермент взаимодействует с субстратом

с образованием нового соединения - ES
E + S →
ES.
В ходе этого этапа ферментативного катализа происходит установление комплементарного соответствия между Е и S, которое сопровождается небольшими изменениями конформации фермента. Переходному состоянию вещества ES соответствует более низкая энергия активации по сравнению с переходным состоянием вещества S в реакции, идущей без катализатора. Таким образом, ферменты как катализаторы повышают скорость реакций путем снижения активационного барьера. При взаимодействии фермента (Е) с субстратом (S) реакция протекает по новому механизму, характеризующемуся более низким уровнем энергии переходного состояния, чем реакции, протекающие в отсутствие фермента.
• Второй этап катализа характеризуется дестабилизацией связей в субстрате (S*):
ES → ES*; чаще всего процесс идет через образование нескольких новых промежуточных состояний
ES → ES*1 → ES*2 →…. → ES*n.
• В ходе третьего этапа происходит превращение S* в продукт P:
ES* → EP → E + P
и высвобождение продукта из комплекса с ферментом.
Часто, опуская второй этап, уравнение ферментативного катализа записывают так:
E + S → ES → E + P.
Слайд 25
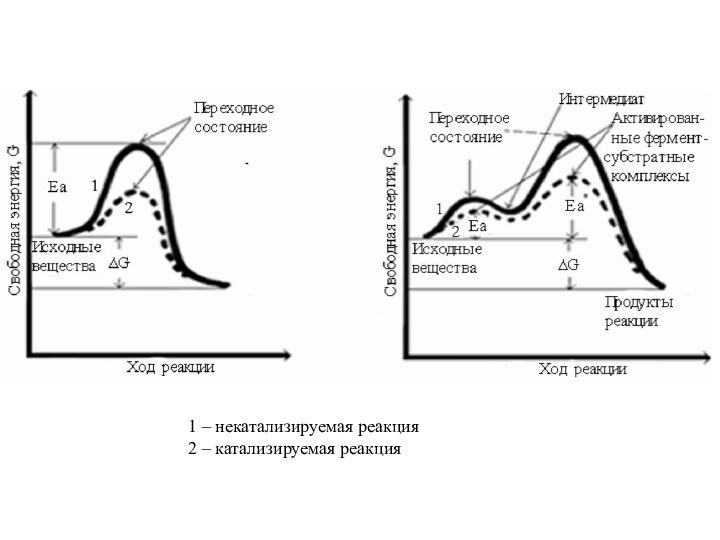
Иначе говоря, катализатор открывает новый, дополнительный путь превращения
исходных веществ в продукты реакции через такие состояния, когда
энергия активации ниже, и тем самым увеличивается скорость образования продукта. В реакциях, катализируемых ферментами, в промежуточных продуктах возникают как ковалентные, так и нековалентные слабые связи (водородные, ионные, гидрофобные) с ферментом. Но главное, что открывается новый путь превращения вещества через новые промежуточные состояния в те же продукты, которые могут образовываться и без катализатора.
Слайд 27
1 – некатализируемая реакция
2 – катализируемая реакция
Слайд 28
ЭНЕРГЕТИЧЕСКИЙ ИТОГ РЕАКЦИИ - разность между энергетическим уровнем
исходных веществ (субстратов) и энергетическим уровнем продуктов реакции, не
зависит от пути, по которому идет реакция (он одинаков и для реакции с участием катализатора, и для реакции без его участия). Он не зависит и от величины энергии активации - от нее зависит только скорость протекания каждого из путей этой реакции. Чем меньше энергия активации реакции, тем выше ее скорость. Эта зависимость выражается уравнением Аррениуса, которое связывает константу скорости реакции k с Еа:
Вывод из уравнения Аррениуса: так как энергия активации в этом уравнении входит в показатель степени, то даже маленькое изменение энергии активации приводит к большим изменениям скорости реакции.
Слайд 29
Теории узнавания ферментом субстрата
Слайд 30
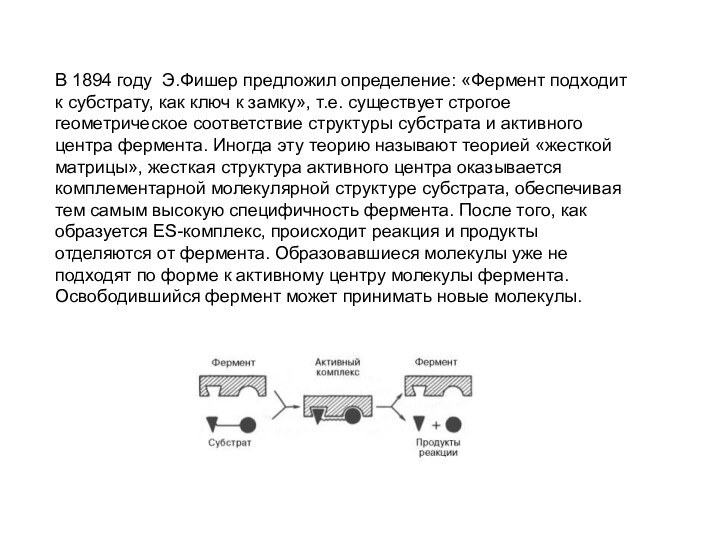
В 1894 году Э.Фишер предложил определение: «Фермент подходит
к субстрату, как ключ к замку», т.е. существует строгое
геометрическое соответствие структуры субстрата и активного центра фермента. Иногда эту теорию называют теорией «жесткой матрицы», жесткая структура активного центра оказывается комплементарной молекулярной структуре субстрата, обеспечивая тем самым высокую специфичность фермента. После того, как образуется ES-комплекс, происходит реакция и продукты отделяются от фермента. Образовавшиеся молекулы уже не подходят по форме к активному центру молекулы фермента. Освободившийся фермент может принимать новые молекулы.
Слайд 31
В противоположность модели Э. Фишера Д. Кошлендом в
50-е годы 20 века была разработана теория «индуцированного соответствия»,
допускающая высокую конформационную лабильность молекулы белка-фермента и гибкость и подвижность активного центра. Эта теория была основана на весьма убедительных экспериментах, свидетельствующих о том, что субстрат индуцирует конформационные изменения молекулы фермента таким образом, что активный центр принимает необходимую для связывания субстрата пространственную ориентацию. Иными словами, фермент только в присутствии (точнее, в момент присоединения) субстрата будет находиться в активной форме. Аминокислотные остатки, составляющие активный центр фермента, располагаются в пространстве так, что это расположение дает возможность ферменту наиболее эффективным образом выполнять свою функцию. Подходящей аналогией в данном случае может служить перчатка, которая при надевании на руку соответствующим образом изменяет свою форму.
Слайд 32
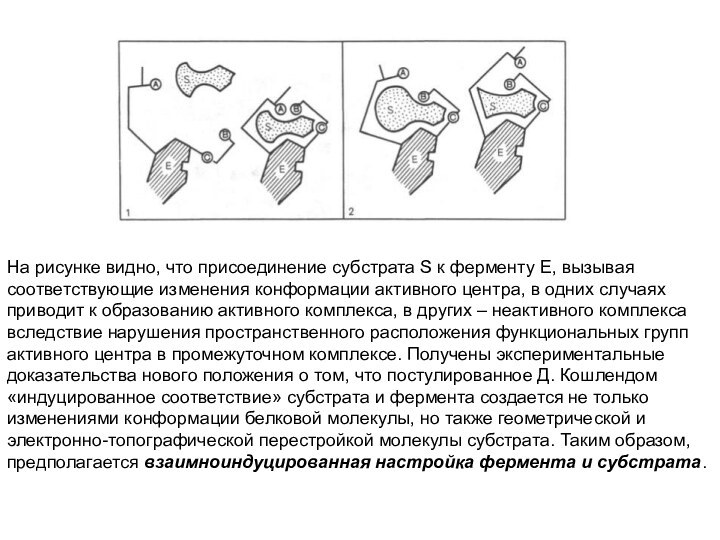
На рисунке видно, что присоединение субстрата S к
ферменту Е, вызывая соответствующие изменения конформации активного центра, в
одних случаях приводит к образованию активного комплекса, в других – неактивного комплекса вследствие нарушения пространственного расположения функциональных групп активного центра в промежуточном комплексе. Получены экспериментальные доказательства нового положения о том, что постулированное Д. Кошлендом «индуцированное соответствие» субстрата и фермента создается не только изменениями конформации белковой молекулы, но также геометрической и электронно-топографической перестройкой молекулы субстрата. Таким образом, предполагается взаимноиндуцированная настройка фермента и субстрата.
Слайд 33
КИНЕТИКА ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
Слайд 34
Кинетика ферментативных реакций - это раздел энзимологии, изучающий
зависимость скорости химических реакций, катализируемых ферментами, от химической природы
реагирующих веществ и факторов окружающей среды.
Скорость ферментативной реакции определяется уменьшением количества молекул субстрата или увеличением количества молекул продукта за единицу времени.
ИЗМЕРЯЯ СКОРОСТЬ РЕАКЦИИ, ВСЕГДА НАДО ИЗМЕРЯТЬ НАЧАЛЬНУЮ СКОРОСТЬ ПРОЦЕССА, то есть скорость ферментативной реакции, в достаточно короткий промежуток времени, когда концентрация субстрата меняется, не настолько значительно, чтобы это отразилось на скорости процесса.
Слайд 35
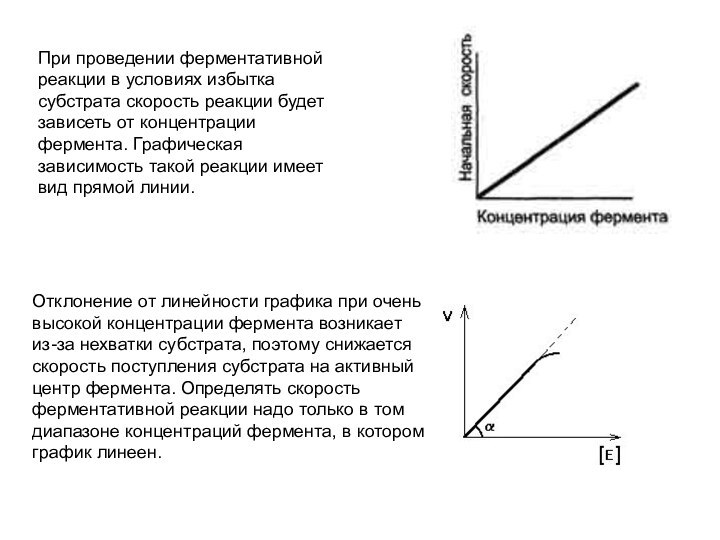
При проведении ферментативной реакции в условиях избытка субстрата
скорость реакции будет зависеть от концентрации фермента. Графическая зависимость
такой реакции имеет вид прямой линии.
Отклонение от линейности графика при очень высокой концентрации фермента возникает из-за нехватки субстрата, поэтому снижается скорость поступления субстрата на активный центр фермента. Определять скорость ферментативной реакции надо только в том диапазоне концентраций фермента, в котором график линеен.
Слайд 36
Количество фермента часто невозможно определить в абсолютных величинах,
поэтому о количестве ферментов судят по скорости катализируемой реакции
в определенных, согласованных условиях измерения.
При оптимальных условиях температуры, рН среды и полном насыщении фермента субстратом скорость катализируемой реакции пропорциональна концентрации фермента.
О скорости ферментативной реакции судят или по скорости убыли субстрата, или по скорости образования продукта реакции.
Слайд 37
Для выражения концентрации фермента и количественной оценки его
активности в условных единицах Комиссией по ферментам Международного биохимического
союза была рекомендована стандартная международная единица (Е или U): за единицу активности любого фермента принимается то количество его, которое в оптимальных условиях катализирует превращение 1 микромоля субстрата или образование 1 микромоля продукта в минуту (мкмоль/мин).
1Е = 1мкмоль превращенного субстрата / 1 мин
В 1972 г. Комиссия по ферментам Международного биохимического союза предложила выражать активность ферментов в к а т а л а х. Катал (символ - кат - это такое количество фермента, которое способно превращать один моль субстрата за одну секунду (при оптимальных условиях).
Международная единица ферментативной активности E связана с каталом следующими равенствами:
1 кат = 1 моль S / c = 60 моль S / мин = 60х106 мкмоль / мин = 6х107 E,
1 E = 1 мкмоль / мин = 1 / 60 мкмоль/с = 1/60 мккат = 16,67 нкат.
Слайд 38
В медицине активность ферментов выражают чаще всего в
единицах активности на 1 л биологической жидкости либо на 1 мг
(или 1 г) белка или 1 мг (1 г) препарата фермента. Такая активность носит название «удельная активность».
По удельной активности судят об очистке фермента: чем меньше посторонних белков, тем выше удельная активность. В процессе очистки фермента удельная активность увеличивается, становится максимальной и постоянной для очень хорошо очищенного (гомогенного) фермента.
Количество молекул субстрата, подвергающихся превращению одной молекулой фермента в продукт в процессе реакции в единицу времени при полном насыщении фермента субстратом, принято называть числом оборотов фермента, или молярной активностью (молярная каталитическая активность выражается в каталах на 1 г-моль фермента).
Одна молекула каталазы эритроцитов способна, например, расщепить в 1 с 44000 молекул перекиси водорода.
Слайд 39
В простейшем случае ферментативную реакцию можно представить как
двухстадийный процесс.
Зависимость скорости реакции v от концентрации субстрата
Сs описывается уравнением Михаэлиса-Ментен, где Км (константа Михаэлиса), а Vмакс (max) - максимальная скорость ферментативной реакции при полном насыщении фермента субстратом:
Слайд 40
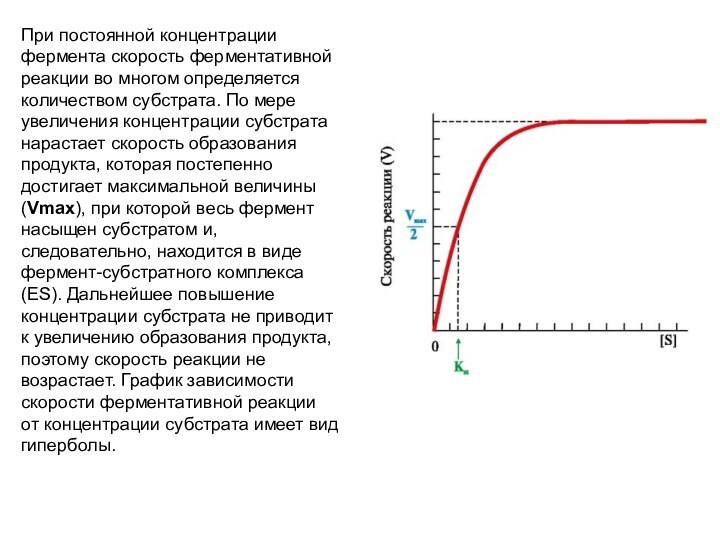
При постоянной концентрации фермента скорость ферментативной реакции во
многом определяется количеством субстрата. По мере увеличения концентрации субстрата
нарастает скорость образования продукта, которая постепенно достигает максимальной величины (Vmax), при которой весь фермент насыщен субстратом и, следовательно, находится в виде фермент-субстратного комплекса (ES). Дальнейшее повышение концентрации субстрата не приводит к увеличению образования продукта, поэтому скорость реакции не возрастает. График зависимости скорости ферментативной реакции от концентрации субстрата имеет вид гиперболы.
Слайд 41
Когда половина молекул фермента находится в комплексе с
молекулами субстрата, скорость реакции равна 1/2 Vmax. Концентрация субстрата,
при которой скорость реакции составляет половину максимальной (Vmax), называется константой Михаэлиса-Ментен (Кm). Величина Кm характеризует сродство фермента к субстрату: чем ниже значение Кm фермента, тем выше его сродство к субстрату, и наоборот.
Vmах и Km - кинетические характеристики эффективности фермента.
Слайд 42
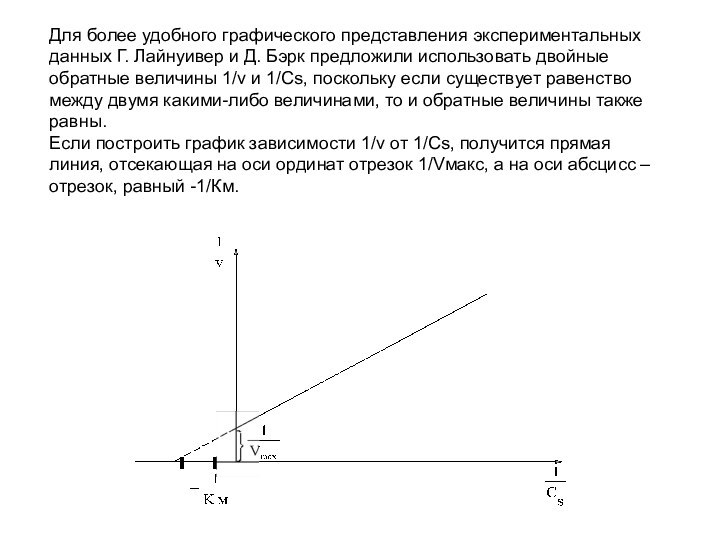
Для более удобного графического представления экспериментальных данных Г.
Лайнуивер и Д. Бэрк предложили использовать двойные обратные величины
1/v и 1/Cs, поскольку если существует равенство между двумя какими-либо величинами, то и обратные величины также равны.
Если построить график зависимости 1/v от 1/Сs, получится прямая линия, отсекающая на оси ординат отрезок 1/Vмакс, а на оси абсцисс – отрезок, равный -1/Км.
Слайд 43
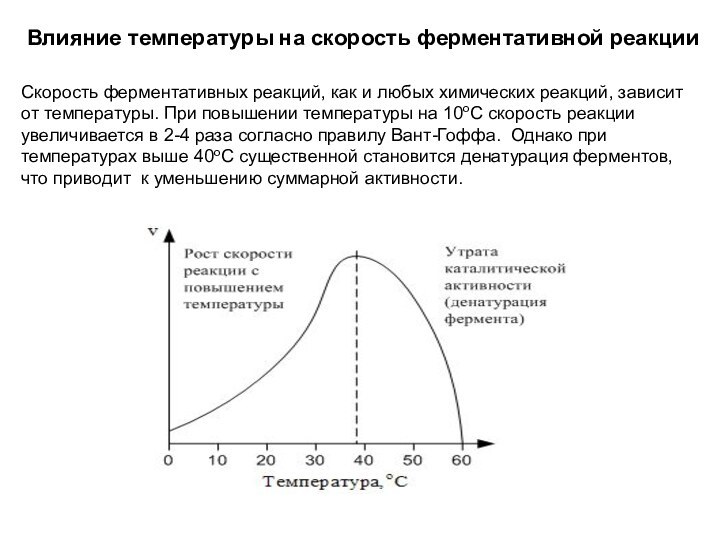
Влияние температуры на скорость ферментативной реакции
Скорость ферментативных реакций,
как и любых химических реакций, зависит от температуры. При
повышении температуры на 10оС скорость реакции увеличивается в 2-4 раза согласно правилу Вант-Гоффа. Однако при температурах выше 40оС существенной становится денатурация ферментов, что приводит к уменьшению суммарной активности.
Слайд 44
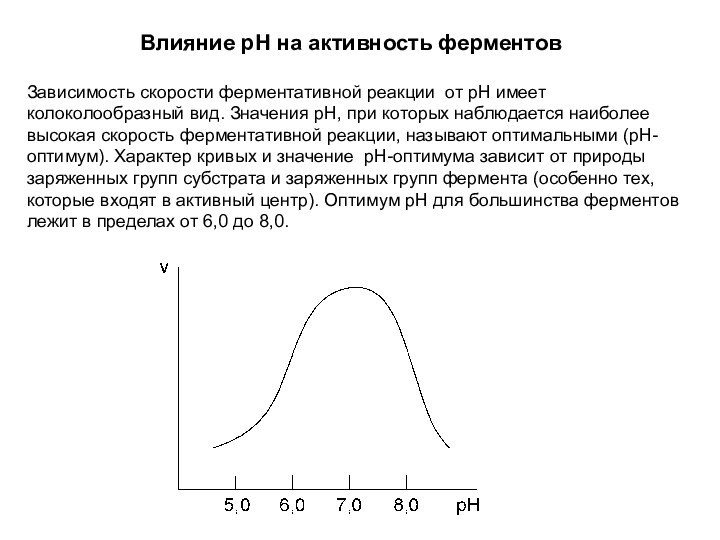
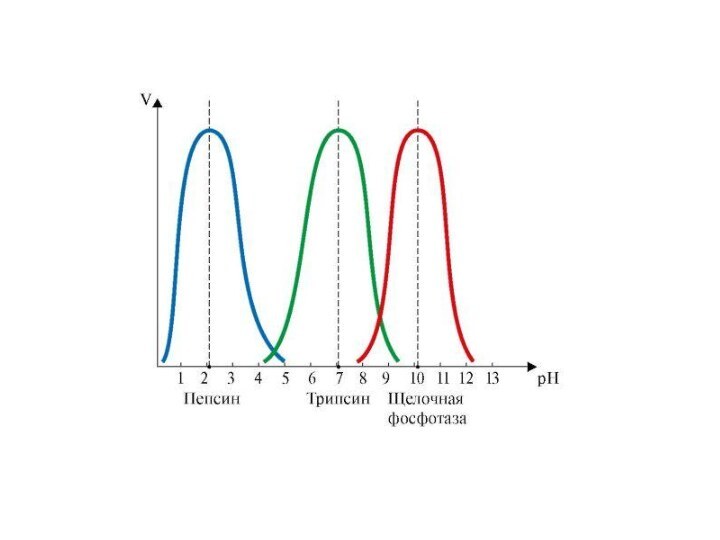
Влияние pH на активность ферментов
Зависимость скорости ферментативной реакции
от рН имеет колоколообразный вид. Значения рН, при которых
наблюдается наиболее высокая скорость ферментативной реакции, называют оптимальными (рН-оптимум). Характер кривых и значение рН-оптимума зависит от природы заряженных групп субстрата и заряженных групп фермента (особенно тех, которые входят в активный центр). Оптимум рН для большинства ферментов лежит в пределах от 6,0 до 8,0.
Слайд 46
Отклонение рН среды от оптимального вызывает изменение:
-
ионизации функциональных групп фермента, а иногда и субстрата;
-
заряда фермента и его конформации;
- конформации активного центра фермента;
- сродства фермента к субстрату.
То есть нарушается комплементарность активного центра фермента субстрату и снижается скорость ферментативной реакции.