- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Белки II. Уровни организации белков
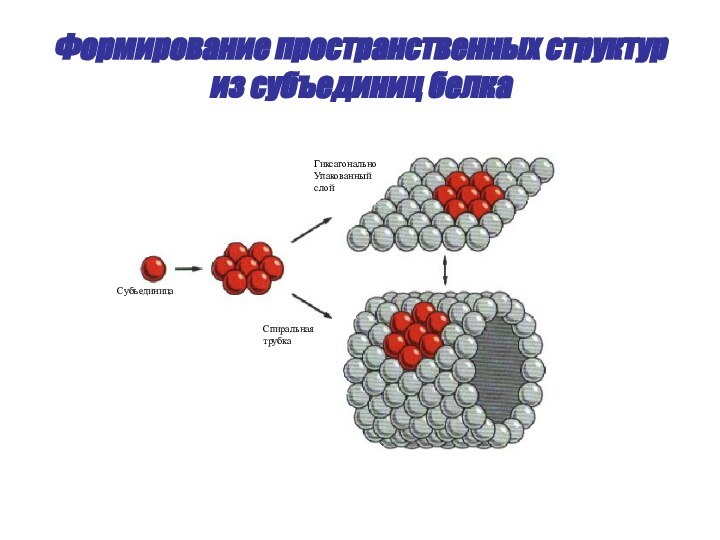
Содержание
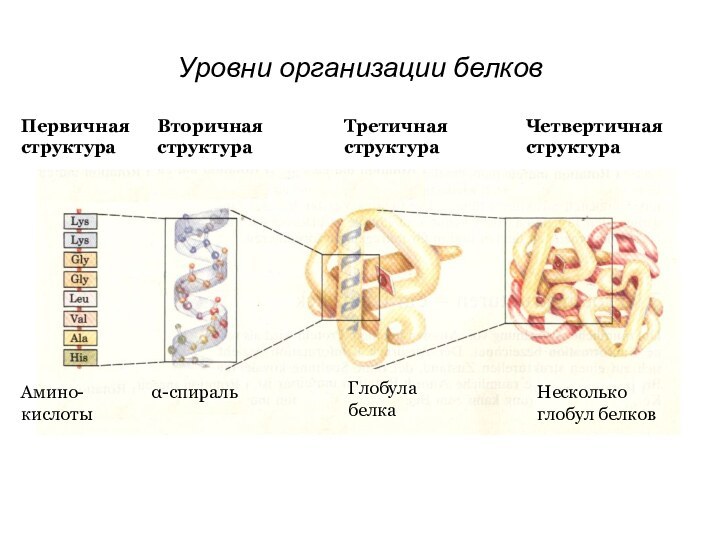
- 2. Первичная структураВторичная структураАмино-кислотыα-спиральТретичная структураЧетвертичная структураГлобула белкаНесколько глобул белковУровни организации белков
- 3. Простые белки – протеины.Состоят только из аминокислота) альбуминыб) глобулиныв) гистоныг) протаминыд) глютелиные) проламиныж) протеиноиды (склеропротеины).
- 4. Наиболее распространенныеАльбумины Молекулярная масса – 15-70 тыс. ИЭТ –
- 5. Глобулины. Масса – 100 тыс. и выше ИЭТ -
- 6. Гистоны. Белки ядра. Масса – 12 – 24 тыс.
- 7. Белки растительного происхожденияГлютелины. Белки зерен. ИЭТ - 6 -8 Пролина
- 8. Протеиноиды (склеропротеины). Белки опорных тканей (кости, хрящи, сухожилия,
- 9. КлеткиПоперечный разрез волосаМакрофибрилаМикрофибрилаПротофибрилаα-спиральСтруктура волоса
- 10. ИсчерченностьГоловки тропоколлагеновых молекулСхема объединения 3-х х-цепей тропоколлагеновых молекулСтруктура коллагеновых волоконИсчерченностьГоловки тропоколлагеновых молекул
- 11. Строение коллагеновой фибриллы
- 12. Один из типов поперечных связей между параллельными цепями коллагена
- 13. Молекулы тропоэластина, из которых формируется сеть связанных между собой полипептидных цепей эластина
- 15. ВосстановлениеОкислениеИскривлениеСхема завивки волос
- 16. Миозин и актин - два нитевидных белка сократительной системы
- 17. Сложные протеины.нуклеопротеиныхромопротеиныфосфоропротеиныгликопротеинылипопротеиныметаллопротеины
- 18. Нуклеопротеины. ↓ состоят из
- 19. Хромопротеины.ГемоглобинМиоглобинЦитохромыГемоцианинРодопсинКаталазаПероксидаза, другие
- 20. Хромопротеины. ↓
- 21. Миоглобин.Содержится в красных мышцах.Масса 17 тыс., 153
- 22. Третичная структура миоглобина кашалота, установленная методом рентгеноструктурного анализа
- 23. Строение гемоглобина
- 24. Гемоглобин.Масса – 67 - 70 тыс.96 %
- 25. Трехмерная структура окси- и дезоксигемоглобина, установленная методом рентгеноструктурного анализа
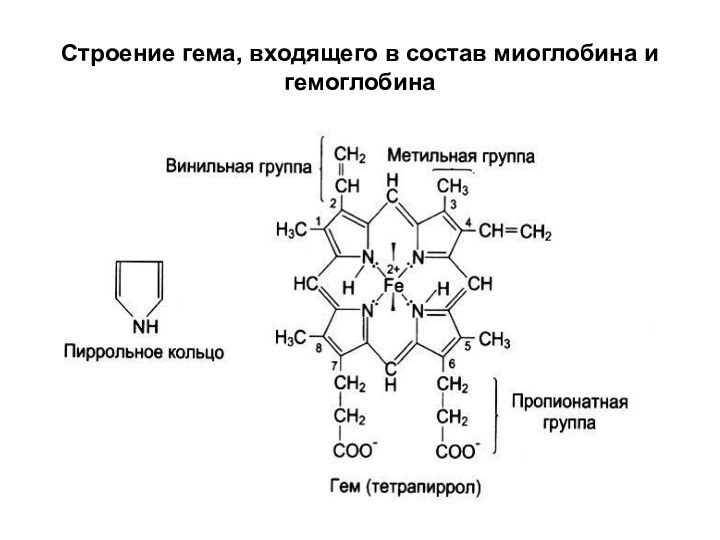
- 26. Строение гема, входящего в состав миоглобина и гемоглобина
- 28. Транспорт газов. Гемоглобин связывает 4 молекулы кислорода. Оксигенирование гемоглобина
- 29. Соединения НbHb(Fe2+)О2 - оксигемоглобин;Hb (Fe2+) СО2
- 30. Схематическое изображение изменений в четвертичной структуре гемоглобина,
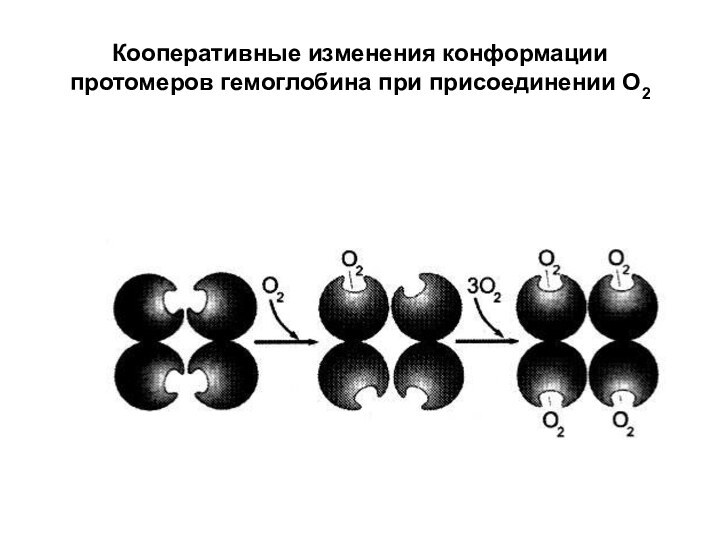
- 31. Кооперативные изменения конформации протомеров гемоглобина при присоединении О2
- 32. Перенос Н+ и СО2 с кровью. Эффект Бора
- 33. Фосфоропротеины. Белок + остаток фосфорной кислоты.КазеиногенОвовиттелин желткаФосвитинПепсин и др. белки-ферментыИхтуллин икры
- 34. Гликопротеины. Представители: Фибриноген, муцины, мукоиды, церулоплазмин, иммуноглобулины.Белковая часть
- 35. Белок + гетерополисахарид, присоединен ковалентно.Нейтральные – глобулины,
- 36. Образование гликопротеинов
- 37. ПротеогликаныПротеогликаны (мукополисахариды, гликозаминогликаны) – высокомолекулярные углеводно-белковые соединения.
- 38. Протеогликан
- 39. Строение экстрацеллюлярного матрикса
- 40. Металлопротеины (металлосвязывающие белки).Белок + металлСпособ удержания и
- 41. Липопротеины плазмы крови
- 42. Общая характеристика липопротеиновЛипиды в водной среде (а
- 43. АпопротеиныАпопротеины выполняют несколько функций:• формируют структуру липопротеинов;•
- 44. ЛипопротеиныВ организме синтезируются следующие типы липопротеинов: 1.
- 45. Свойства липопротеиновЛП хорошо растворимы в крови, не
- 46. Гиперхиломикронемия, гипертриглицеронемияПосле приёма пищи, содержащей жиры, развивается
- 47. Липопротеины — транспортные формы липидовПримечания: ФЛ —
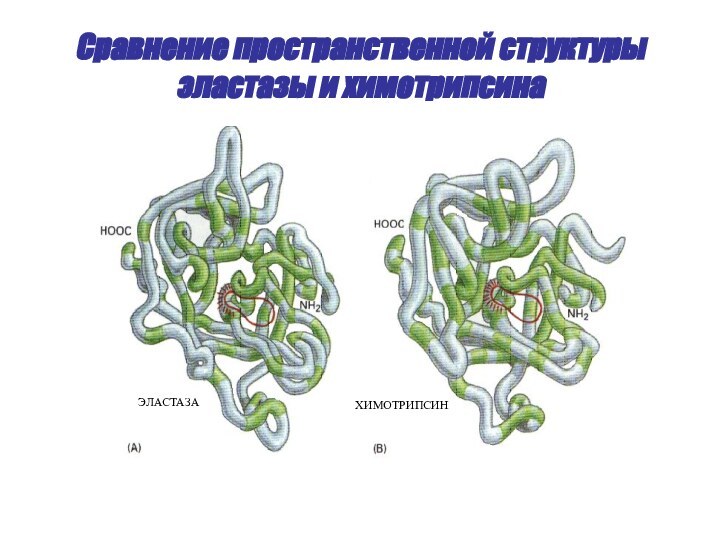
- 48. Сравнение пространственной структуры эластазы и химотрипсинаЭЛАСТАЗАХИМОТРИПСИН
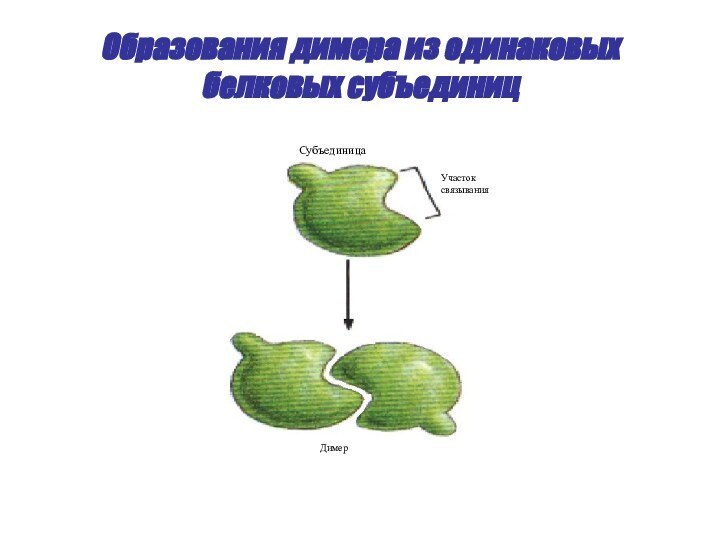
- 49. Образования димера из одинаковых белковых субъединицСубъединицаУчастоксвязыванияДимер
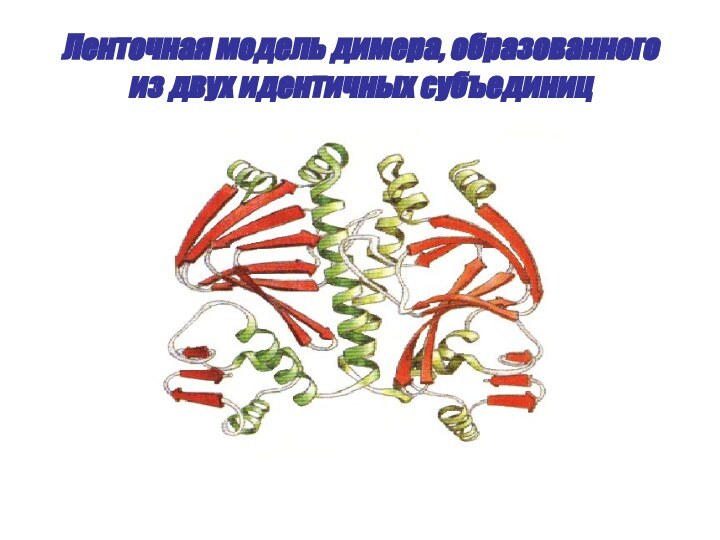
- 50. Ленточная модель димера, образованного из двух идентичных субъединиц
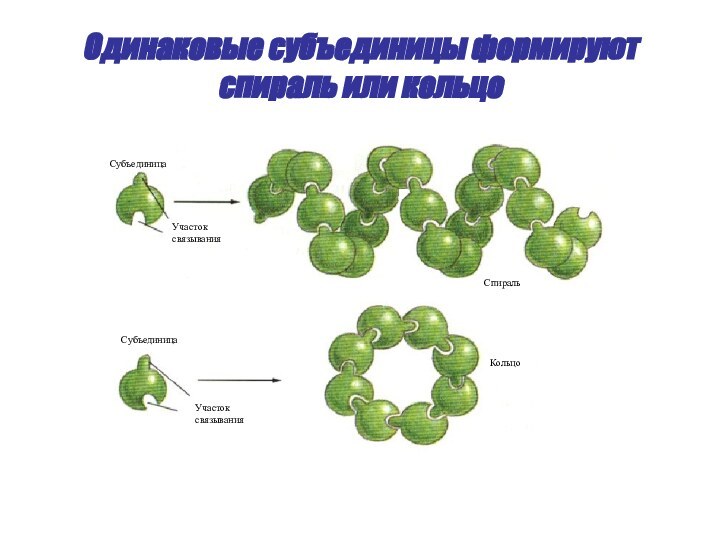
- 51. Одинаковые субъединицы формируют спираль или кольцоКольцоСпиральУчастоксвязыванияУчастоксвязыванияСубъединицаСубъединица
- 52. Формирование спирали актина из субъединицСпираль актина
- 53. Формирование пространственных структур из субъединиц белкаСубъединицаСпиральная трубкаГиксагональноУпакованныйслой
- 54. Скачать презентацию
- 55. Похожие презентации
Первичная структураВторичная структураАмино-кислотыα-спиральТретичная структураЧетвертичная структураГлобула белкаНесколько глобул белковУровни организации белков









































Слайд 2
Первичная структура
Вторичная структура
Амино-
кислоты
α-спираль
Третичная структура
Четвертичная структура
Глобула белка
Несколько глобул белков
Уровни
организации белков
Слайд 3
Простые белки – протеины.
Состоят только из аминокислот
а) альбумины
б)
глобулины
в) гистоны
г) протамины
д) глютелины
е) проламины
ж) протеиноиды (склеропротеины).
Слайд 4
Наиболее распространенные
Альбумины
Молекулярная масса – 15-70 тыс.
ИЭТ – 4,7
(кислые)
Мало аминокислоты глицина, но много лейцина (12 – 15%).
Хорошо
растворимы в воде (гидрофильны).Осаждаются – при 100% насыщении раствора (NH4)2SO4
При электрофорезе перемещаются первыми.
Разновидности: сывороточный, молочный, яичный, зерен пшеницы и др.
Высокая стойкость коллоидных растворов.
Среди белков крови имеет самую высокую концентрацию, но наименьшую молярную массу. Вносит основной вклад во внутрисосудистое коллоидно-осмотическое давление.
Образуется в клетках печени. Состоит из 610 аминокислот.
Транспортируют жирные кислоты, билирубин, лекарственные вещества.
Слайд 5
Глобулины.
Масса – 100 тыс. и выше
ИЭТ - 5,5
– 7,3
Глицина в 3 раза больше, чем у альбумина.
Нерастворимы
в воде, но растворимы в слабых солевых растворах.Осаждаются при полунасыщении раствора (NH4)2SO4
Разновидности: сывороточный, яичный, молочный и др.
При электрофорезе – идут вслед за альбуминами.
Три основные фракции: α,β и γ (антитела).
Наиболее разнообразная группа (только в крови до 20).
Менее гидрофильны, образуют менее стойкие коллоиды.
Взаимодействуют с липидами, углеводами,витаминами.
Соотношение альбуминов/глобулинов в крови - постоянно.
Слайд 6
Гистоны.
Белки ядра.
Масса – 12 – 24 тыс.
ИЭТ
– 8 – 9 (основные)
В природе соединены с ДНК
Участвуют
в «упаковке» ДНК, регуляции генов.Соотношение в хроматине ДНК : гистоны
1 : 1
Проламины.
Группа белков ядра.
Масса – 5000 – 10000
ИЭТ – около 12
Аргинина – до 75%
Нет триптофана и цестеина.
В природе соединены с ДНК.
Участвуют в регуляции активности генов.
Слайд 7
Белки растительного происхождения
Глютелины.
Белки зерен.
ИЭТ - 6 -8
Пролина –
10 -15%
Глютаминовой кислоты ~30%
Растворим в 0,2 н щелочи.
Глютелин пшеници,
оризеин риса.Проламины.
Белки зерен злаков.
Масса – 28 -50 тыс.
ИЭТ – 4 -5
Глютаминовой кислоты -25 – 45%
Растворимы в спирте.
Образуют клейковину зерна.
Слайд 8
Протеиноиды (склеропротеины).
Белки опорных тканей (кости, хрящи, сухожилия, шерсть,
копыта).
Растворимость – нерастворимы.
Много серосодержащих аминокислот.
Форма – фибриллярные.
Представители: коллаген, эластин,
фиброин, кератин. Высокая прочность и эластичность.
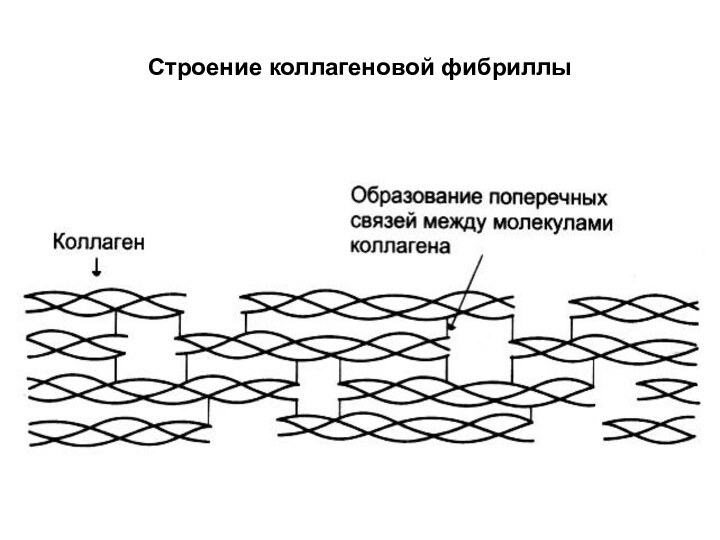
Слайд 10
Исчерченность
Головки тропоколлагеновых молекул
Схема объединения 3-х х-цепей тропоколлагеновых молекул
Структура
коллагеновых волокон
Исчерченность
Головки тропоколлагеновых молекул
Слайд 13 Молекулы тропоэластина, из которых формируется сеть связанных между
собой полипептидных цепей эластина
Слайд 17
Сложные протеины.
нуклеопротеины
хромопротеины
фосфоропротеины
гликопротеины
липопротеины
металлопротеины
Слайд 18
Нуклеопротеины.
↓ состоят из ↓
Протеины Нуклеиновые кислоты
гистоны
не гистоновые белки ДНК
протамины РНК
Слайд 20
Хромопротеины.
↓
↓
Протеин Небелковое
вещество, обуславливающее окраскугемоглобин
миоглобин цитохромы
каталаза
флавопротеины
ретинопротеины
Слайд 21
Миоглобин.
Содержится в красных мышцах.
Масса 17 тыс., 153 аминокислотных
остатка + ГЕМ
75% образуют 8 правых α – спиралей.
Первичная
структура определяет вторичную и третичную.Цитохромоксидаза (цитохром а3).
Конечный компонент дыхательной цепи.
Переносит электроны на кислород.
Масса – 12 -14 тыс.
Содержит Fe и Cu.
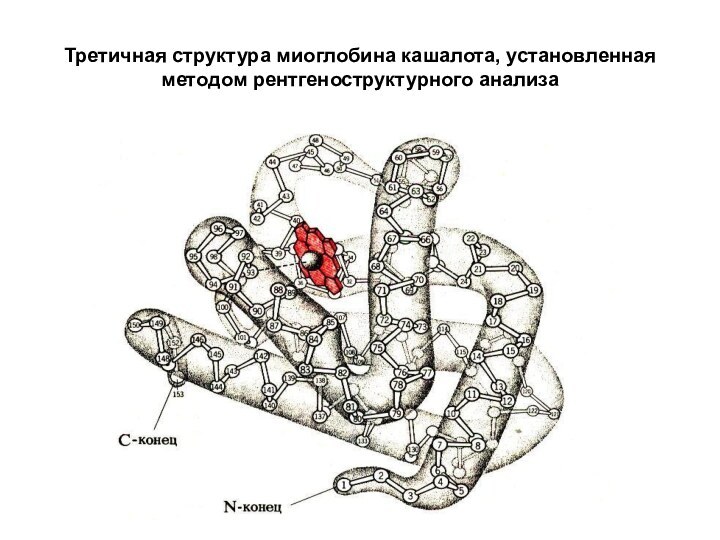
Слайд 22
Третичная структура миоглобина кашалота, установленная методом рентгеноструктурного анализа
Слайд 24
Гемоглобин.
Масса – 67 - 70 тыс.
96 % белка
и 4 % ГЕМа от молекулярной массы.
Состоит из 4
молекул глобина.ГЕМ – метоллопорфириновый комплекс
2 α цепи из 141 аминокислотного остатка
2 β цепи из 146 аминокислотных остатков
HbО2 - оксигемоглобин;
HbСО2 - карбгемоглобин;
HbСО - карбоксигемоглобин;
HbF3+ - метгемоглобин;
HbА – нормальный гемоглобин взрослого человека α2β 2
HbF – фетальный гемоглобин α2γ 2
HbS – при серповидно – клеточной анемии α2S2
СО2 присоединяется не к ГЕМу, а к NH2 группе глобина.
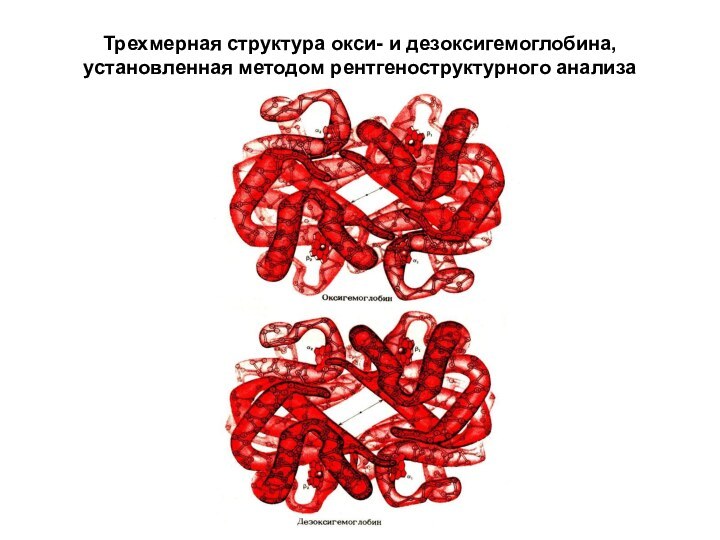
Слайд 25 Трехмерная структура окси- и дезоксигемоглобина, установленная методом рентгеноструктурного
анализа
Слайд 28
Транспорт газов.
Гемоглобин связывает 4 молекулы кислорода.
Оксигенирование гемоглобина сопровождается
значительными конформационными изменениями: α/β пара поворачиваются вокруг другой, что
повышает сродство к О2Hb связывает ~ 15% СО2 . Остальной СО2 в эритроцитах соединяется с Н2О.
карбоангидразы
СО2 + Н2О → Н2СО3 ⇔ НСО-3 + Н+
Сродство Hb к СО в 300 раз выше, чем к О2, поэтому при концентрации СО в воздухе 0,1 % наблюдается отравление.
Слайд 29
Соединения Нb
Hb(Fe2+)О2 - оксигемоглобин;
Hb (Fe2+) СО2
- карбогемоглобин;
Hb (Fe2+) СО - карбоксигемоглобин;
Hb (Fe3+) OH -
метгемоглобин;Hb (Fe3+) CN – циангемоглабин.
Слайд 30 Схематическое изображение изменений в четвертичной структуре гемоглобина, обусловленных
перемещением пары субъединиц α1β1 относительно неподвижной пары α2β2 в
процессе освобождения кислорода из оксигемоглобина, переходящего в форму дезоксигемоглобина
Слайд 33
Фосфоропротеины.
Белок + остаток фосфорной кислоты.
Казеиноген
Ововиттелин желтка
Фосвитин
Пепсин и др.
белки-ферменты
Ихтуллин икры
Слайд 34
Гликопротеины.
Представители: Фибриноген, муцины, мукоиды, церулоплазмин, иммуноглобулины.
Белковая часть составляет
80 - 90% от м.м. молекул.
Олигосахаридная часть оказывает следующее влияние: 1) Изменяет физико-химические свойства
2) Защита от протеолиза
3) Определяет активность
4) Определяет транспортные свойства.
Функции гликопротеинов:
Свертываемость – протромбин, фибриноген.
Смазочные и защитные вещества – муцины, слизистые секреты.
Транспорт витаминов, липидов, минералов.
Иммунитет – иммуноглобулины.
Ферменты – холинэстераза, рибонуклеаза В.
Клеточные контакты.
Рецепторы.
Гормоны – гонадотропин, кортикотропин.
Повышает термостабильность.
Слайд 35
Белок + гетерополисахарид, присоединен ковалентно.
Нейтральные – глобулины, фибриноген.
Образуют нестойкие агрегаты.
Кислые – муцин, мукоид.
Муцины – основа слизей
(слюна, желудочный и кишечный сок).Мукоиды – белки синовиальной жидкости суставов, хрящей, сухожилий. Смазывающий и склеивающий эффект.
Распространены от бактерий до человека.
Слайд 37
Протеогликаны
Протеогликаны (мукополисахариды, гликозаминогликаны) – высокомолекулярные углеводно-белковые соединения. Образуют
основную массу межклеточного матрикса соединительной ткани. Составляют до 30%
сухой массы.Линейные полимеры, построенные из повторяющихся дисахаридных единиц. Всегда связаны с белками.
Состоят из остатков глюкозамина (либо галактозамина) и остатков D-глюкуроновай (либо L-идуроновой) кислот. Например, гиалуроновая кислота (образование геля), хондроитинсульфат, дерматансульфат, кератинсульфат, гепарин и др.
Слайд 40
Металлопротеины (металлосвязывающие белки).
Белок + металл
Способ удержания и защиты
от осадка.
Теряют токсичность. Обеспечивают ферментативную активность.
Церулоплазмин – белок +Cu
Карбоангидраза
– белок + ZnЛактатдегидрогеназа – белок + Zn
Ферритин – белок + Fe (23% - депо железа), масса 445000. 24 субъединицы. Связывает до 2000 остатков Fe на 1 молекулу.
Трансферин – белок + Fe3+ - резервный белок.
Слайд 42
Общая характеристика липопротеинов
Липиды в водной среде (а значит,
и в крови) нерастворимы, поэтому для транспорта липидов кровью
в организме образуются комплексы липидов с белками — липопротеины.Все типы липопротеинов имеют сходное строение — гидрофобное ядро и гидрофильный слой на поверхности. Гидрофильный слой образован белками, которые называют апопротеинами, и амфифильными молекулами липидов — фосфолипидами и холестеролом. Гидрофильные группы этих молекул обращены к водной фазе, а гидрофобные части — к гидрофобному ядру липопротеина, в котором находятся транспортируемые липиды.
Слайд 43
Апопротеины
Апопротеины выполняют несколько функций:
• формируют структуру липопротеинов;
• взаимодействуют
с рецепторами на поверхности клеток и таким образом определяют,
какими тканями будет захватываться данный тип липопротеинов;• служат ферментами или активаторами ферментов, действующих на липопротеины.
Слайд 44
Липопротеины
В организме синтезируются следующие типы липопротеинов: 1. хиломикроны
(ХМ), 2. липопротеины очень низкой плотности (ЛПОНП), 3. липопротеины
промежуточной плотности (ЛППП), 4. липопротеины низкой плотности (ЛПНП) и 5. липопротеины высокой плотности (ЛПВП).Каждый из типов ЛП образуется в разных тканях и транспортирует определённые липиды. Например, ХМ транспортируют экзогенные (пищевые жиры) из кишечника в ткани, поэтому триацилглицеролы составляют до 85% массы этих частиц.
Слайд 45
Свойства липопротеинов
ЛП хорошо растворимы в крови, не опалесцируют,
так как имеют небольшой размер и отрицательный заряд на
поверхности. Некоторые ЛП легко проходят через стенки капилляров кровеносных сосудов и доставляют липиды к клеткам.Большой размер ХМ не позволяет им проникать через стенки капилляров, поэтому из клеток кишечника они сначала попадают в лимфатическую систему и потом через главный грудной проток вливаются в кровь вместе с лимфой.
Слайд 46
Гиперхиломикронемия, гипертриглицеронемия
После приёма пищи, содержащей жиры, развивается физиологическая
гипертриглицеронемия и, соответственно, гиперхиломикронемия, которая может продолжаться до нескольких
часов.Скорость удаления ХМ из кровотока зависит от:
• активности ЛП-липазы;
• присутствия ЛПВП, поставляющих апопротеины С-II и Е для ХМ;
• активности переноса апоС-II и апоЕ на ХМ.
Генетические дефекты любого из белков, участвующих в метаболизме ХМ, приводят к развитию семейной гиперхиломикронемии — гиперлипопротеинемии типаI.
Слайд 47
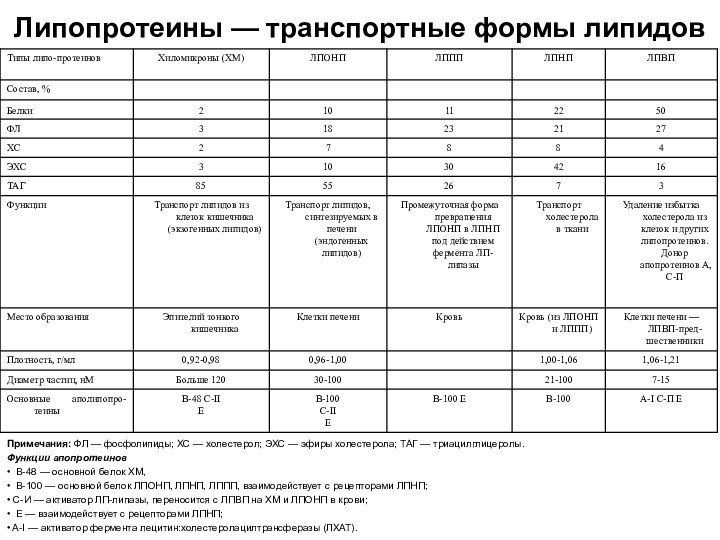
Липопротеины — транспортные формы липидов
Примечания: ФЛ — фосфолипиды;
ХС — холестерол; ЭХС — эфиры холестерола; ТАГ —
триацилглицеролы.Функции апопротеинов
• В-48 — основной белок ХМ,
• В-100 — основной белок ЛПОНП, ЛПНП, ЛППП, взаимодействует с рецепторами ЛПНП;
• С-И — активатор ЛП-липазы, переносится с ЛПВП на ХМ и ЛПОНП в крови;
• Е — взаимодействует с рецепторами ЛПНП;
• A-I — активатор фермента лецитин:холестеролацилтрансферазы (ЛХАТ).