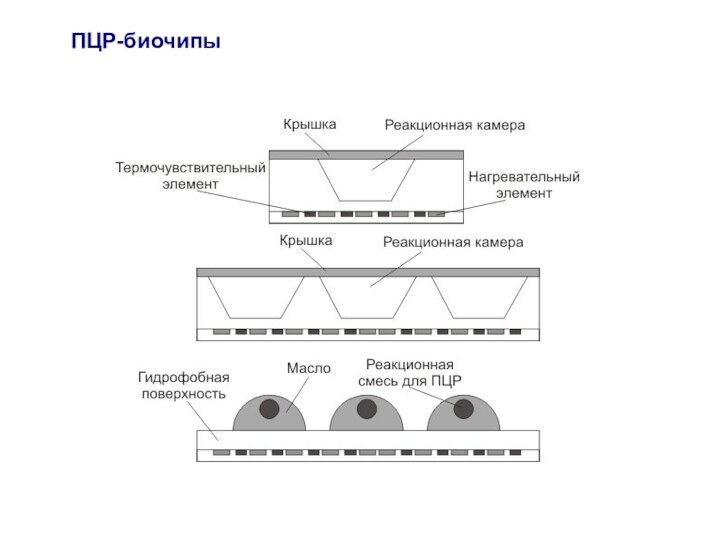
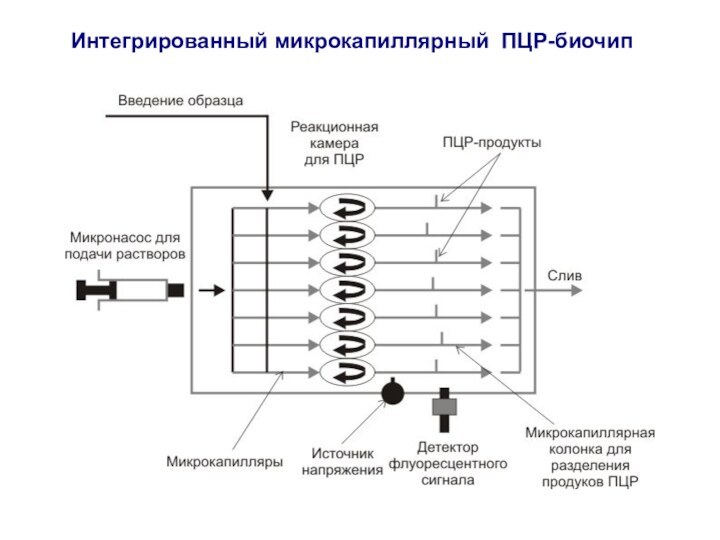
Слайд 2
Полимеразная цепная реакция
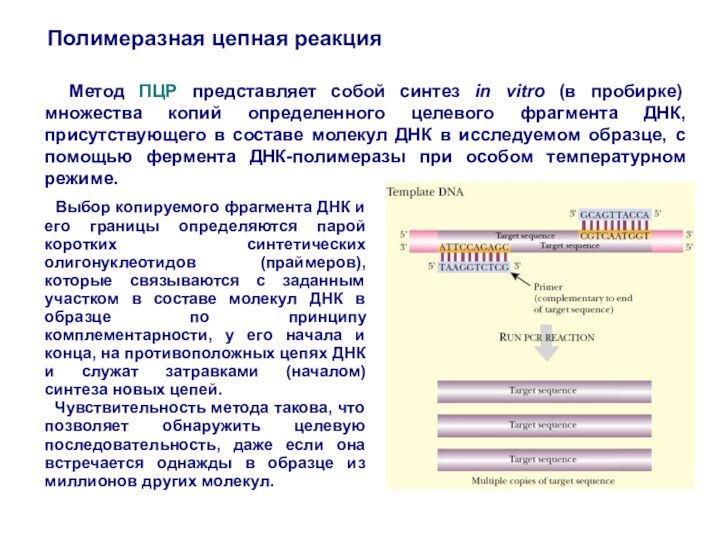
Метод ПЦР представляет собой синтез
in vitro (в пробирке) множества копий определенного целевого фрагмента
ДНК, присутствующего в составе молекул ДНК в исследуемом образце, с помощью фермента ДНК-полимеразы при особом температурном режиме.
Выбор копируемого фрагмента ДНК и его границы определяются парой коротких синтетических олигонуклеотидов (праймеров), которые связываются с заданным участком в составе молекул ДНК в образце по принципу комплементарности, у его начала и конца, на противоположных цепях ДНК и служат затравками (началом) синтеза новых цепей.
Чувствительность метода такова, что позволяет обнаружить целевую последовательность, даже если она встречается однажды в образце из миллионов других молекул.
Слайд 3
Полимеразная цепная реакция
Открытие метода ПЦР
Основные принципы использования праймеров
и состав реакционной смеси для получения копий ДНК впервые
были описаны K. Kleppe с соавторами в 1971 г.
В 1983 г. сотрудник фирмы «Cetus» Kary Mullis предложил метод копирования (амплификации) определенных участков ДНК (метод ПЦР) в процессе повторяющихся температурных циклов.
1993 г. - Нобелевская премия по химии.
1985 г. - Saiki R.K. с соавторами опубликовали статью, в которой была описана амплификация участка гена β−глобина.
Kary Mullis
Слайд 4
Полимеразная цепная реакция
Применение метода ПЦР
1. Диагностика (выявление, обнаружение)
- диагностика инфекционных заболеваний;
- диагностика онкологических заболеваний;
-
диагностика генетических заболеваний;
- обнаружение микроорганизмов (в природных образцах, продуктах питания);
- обнаружение генномодифицированных организмов и их компонентов в
составе продуктов питания;
- обнаружение целевых генов.
2. Идентификация
- идентификация микроорганизмов;
- идентификация личности;
- установление родства.
3. Клонирование (сборка) генов, модификация генов
4. Исследование структуры генов и геномов
5. Мутагенез и изменение свойств природных белков
Слайд 5
Полимеразная цепная реакция
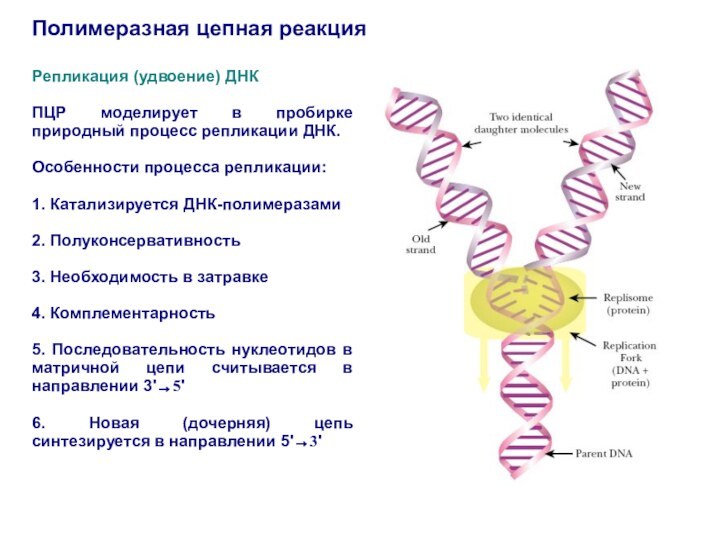
Репликация (удвоение) ДНК
ПЦР моделирует в пробирке
природный процесс репликации ДНК.
Особенности процесса репликации:
1. Катализируется ДНК-полимеразами
2. Полуконсервативность
3.
Необходимость в затравке
4. Комплементарность
5. Последовательность нуклеотидов в матричной цепи считывается в направлении 3'→5'
6. Новая (дочерняя) цепь синтезируется в направлении 5'→3'
Слайд 6
Полимеразная цепная реакция
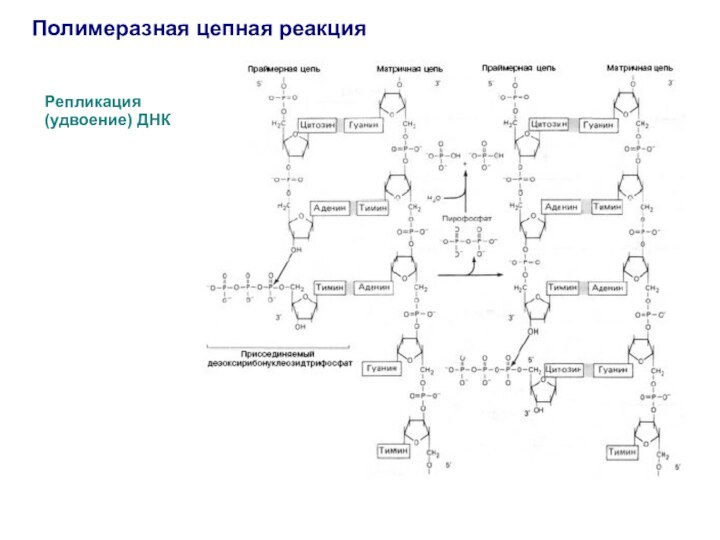
Репликация (удвоение) ДНК
Слайд 7
Полимеразная цепная реакция
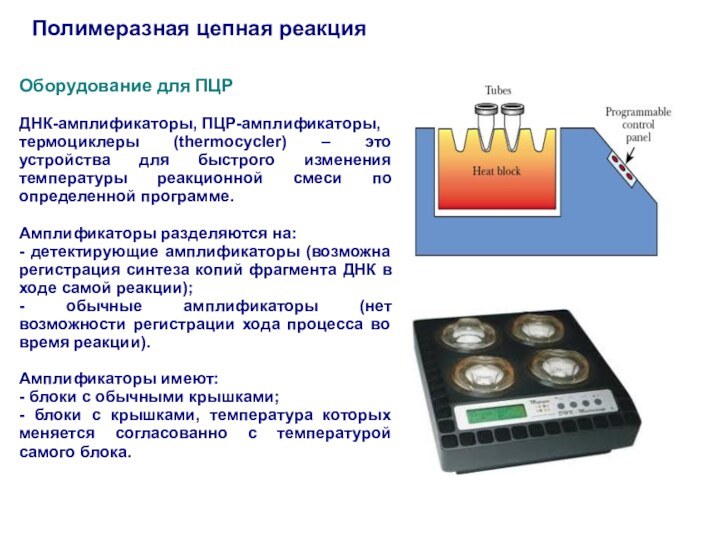
Оборудование для ПЦР
ДНК-амплификаторы, ПЦР-амплификаторы,
термоциклеры (thermocycler) –
это устройства для быстрого изменения температуры реакционной смеси по
определенной программе.
Амплификаторы разделяются на:
- детектирующие амплификаторы (возможна регистрация синтеза копий фрагмента ДНК в ходе самой реакции);
- обычные амплификаторы (нет возможности регистрации хода процесса во время реакции).
Амплификаторы имеют:
- блоки с обычными крышками;
- блоки с крышками, температура которых меняется согласованно с температурой самого блока.
Слайд 8
Полимеразная цепная реакция
Компоненты реакционной смеси
1. Деионизованная вода
2. Буфер
для ДНК-полимеразы
3. Смесь дезоксинуклеотидтрифосфатов
(дНТФ, dNTP)
4. Праймер 1 f
(forward)
5. Праймер 2 r (reverse)
6. Образец ДНК
7. ДНК-полимераза
Слайд 9
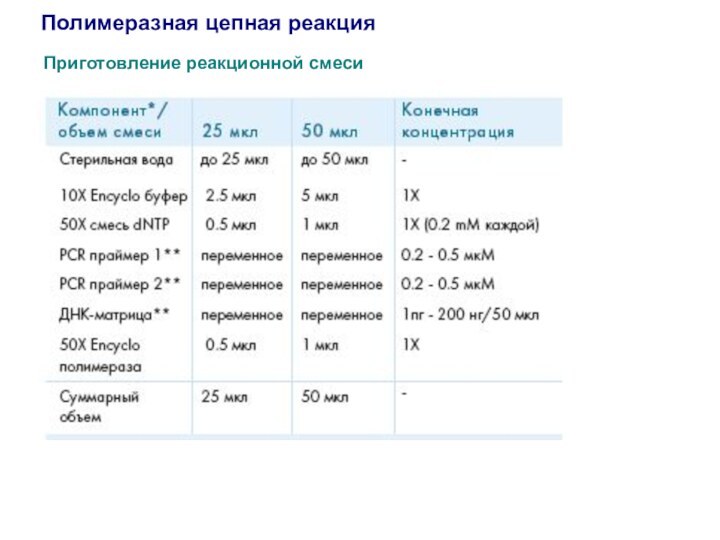
Полимеразная цепная реакция
Приготовление реакционной смеси
Слайд 10
Полимеразная цепная реакция
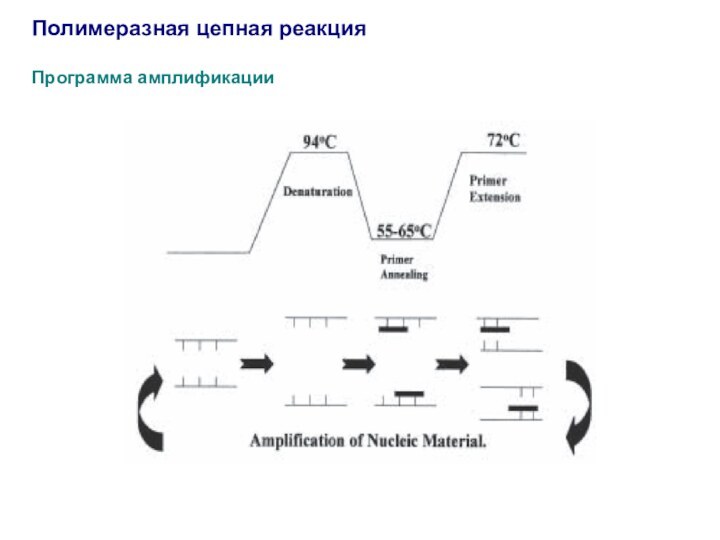
Циклический температурный режим (программа амплификации)
1 цикл
– денатурация
(первоначальный прогрев
реакционной смеси) 91-950С 1-5 мин 1 раз
2 цикл – 25-30 раз
1) денатурация 91-950С 15-60 сек
2) отжиг
(связывание праймеров) Та 15-60 сек
(annealing)
3) элонгация (удлинение цепей) 720С t
30 сек на
500 нуклеотидов
3 цикл – окончательное достраивание
цепей 720С 5 мин 1 раз
4 цикл – охлаждение 4-100С до выключения
прибора
Слайд 11
Полимеразная цепная реакция
Программа амплификации
Слайд 12
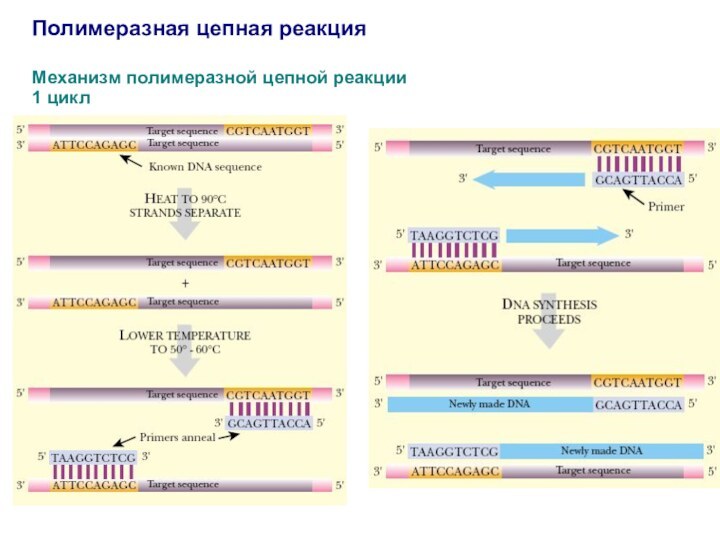
Полимеразная цепная реакция
Механизм полимеразной цепной реакции
1 цикл
Слайд 13
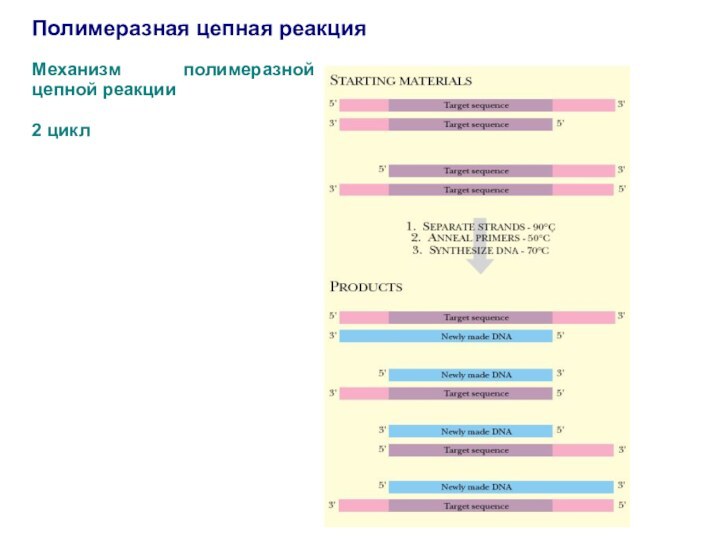
Полимеразная цепная реакция
Механизм полимеразной цепной реакции
2 цикл
Слайд 14
Полимеразная цепная реакция
Механизм полимеразной цепной реакции
3 цикл
Слайд 15
Полимеразная цепная реакция
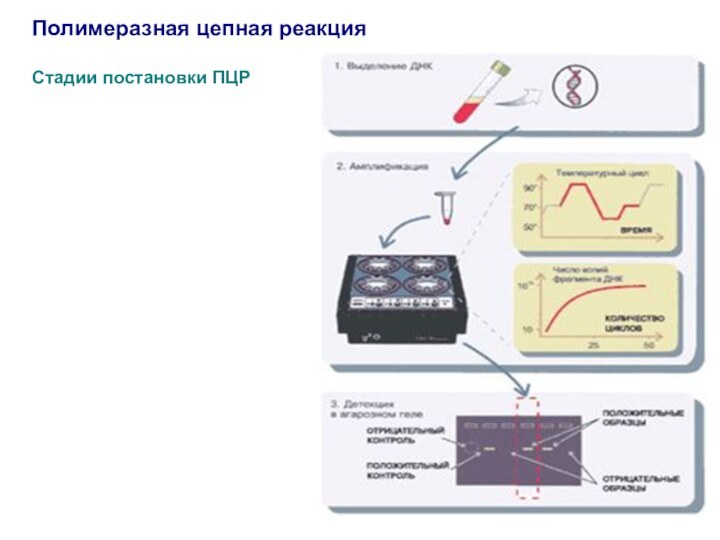
Стадии постановки ПЦР
Слайд 16
Полимеразная цепная реакция
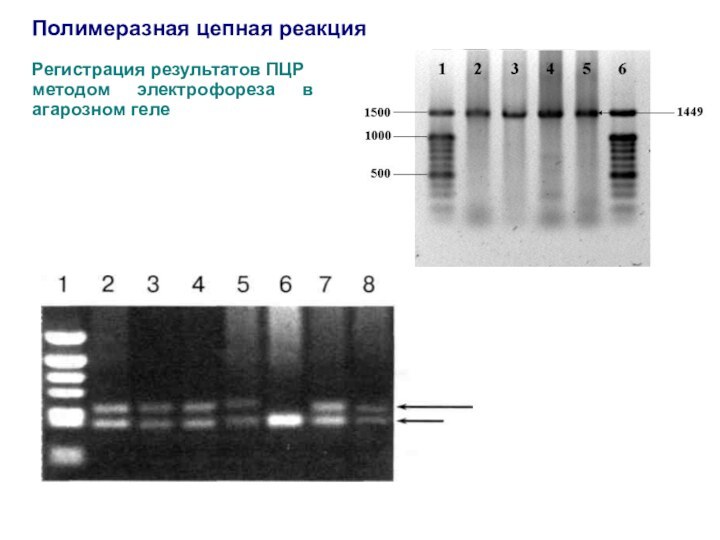
Регистрация результатов ПЦР
методом электрофореза в агарозном
геле
Слайд 17
Полимеразная цепная реакция
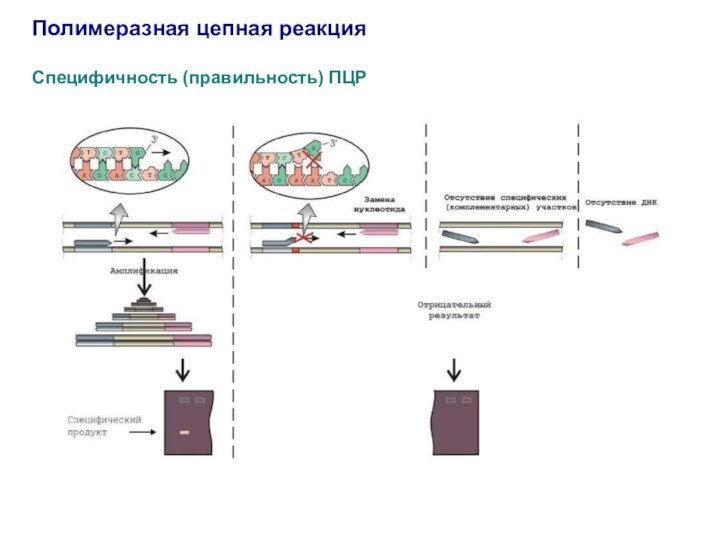
Специфичность (правильность) ПЦР
Слайд 18
Полимеразная цепная реакция
Требования к подбору праймеров
1. Длина праймера
– 17-28 нуклеотидов.
2. Состав нуклеотидов в праймере должен быть
таков, что
Tm = 4 (G+C) + 2 (A+T) должна лежать в диапазоне 55-75 0С.
3. На 3’- конце праймера должны быть нуклеотиды G, C, GC или CG.
4. Tm праймеров, работающих в паре, должна быть сходной.
5. На 3’- конце праймера не должно быть последовательностей из ССС или
GGG.
6. Четыре и более нуклеотидов на 3’- конце праймера не должны быть
комплементарны самому праймеру либо праймеру в паре.
7. С 5’-конца праймера может быть добавлена любая не комплементарная
матрице последовательность нуклеотидов любой длины.
Слайд 19
Полимеразная цепная реакция
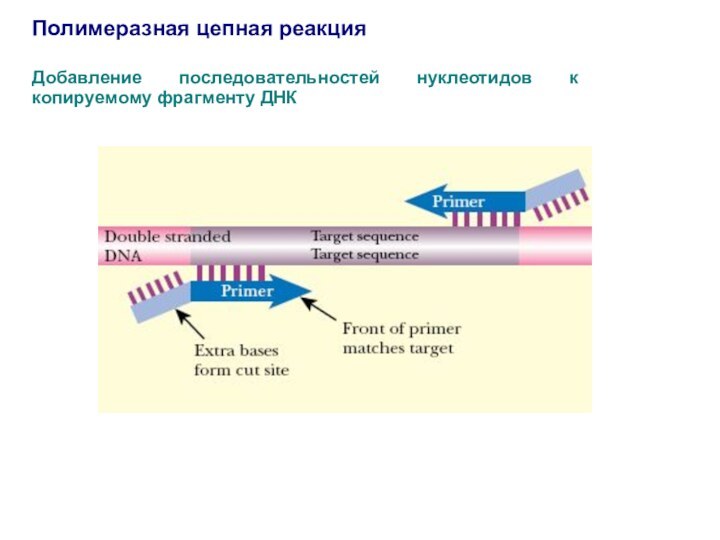
Добавление последовательностей нуклеотидов к копируемому фрагменту
ДНК
Слайд 20
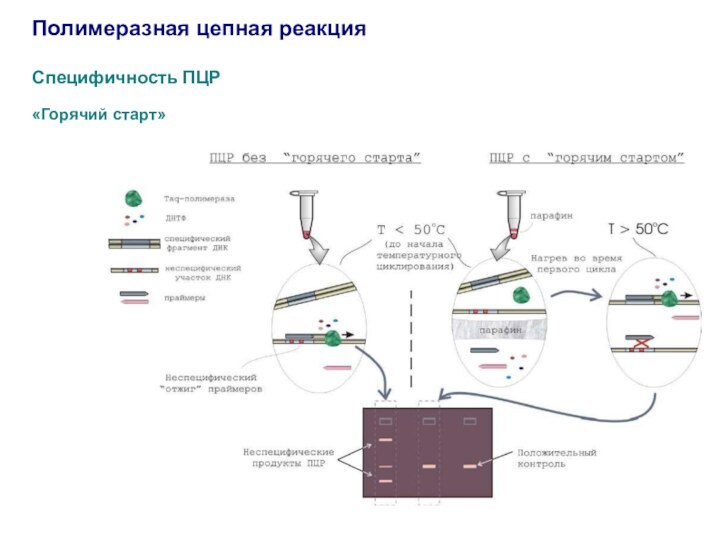
Полимеразная цепная реакция
Специфичность ПЦР
«Горячий старт»
Слайд 21
Полимеразная цепная реакция
Специфичность ПЦР
«Горячий старт»
1. Разделение компонентов реакционной
смеси барьером (прослойкой парафина).
2. Внесение в реакционную смесь одного
из компонентов реакции (ДНК-полимеразы) во время первого цикла после прогрева пробирки до температуры денатурации.
3. Ингибирование полимеразы антителами.
4. Использование химически модифицированной ДНК-полимеразы.
Слайд 22
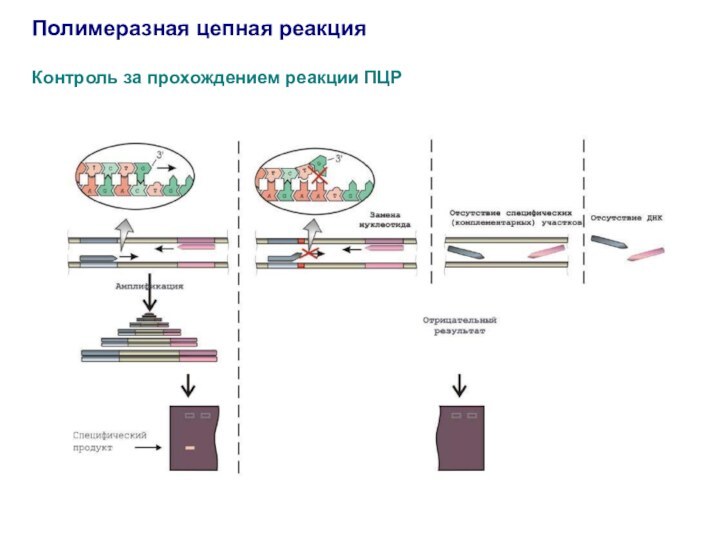
Полимеразная цепная реакция
Контроль за прохождением реакции ПЦР
Слайд 23
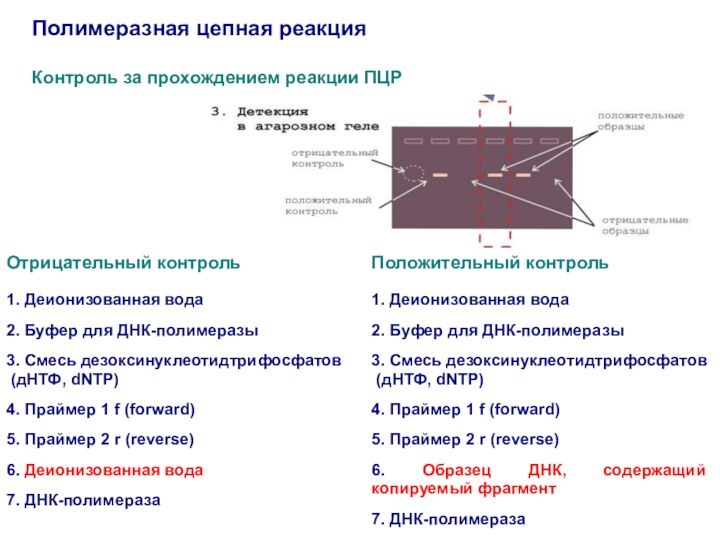
Полимеразная цепная реакция
Контроль за прохождением реакции ПЦР
Положительный контроль
1.
Деионизованная вода
2. Буфер для ДНК-полимеразы
3. Смесь дезоксинуклеотидтрифосфатов
(дНТФ, dNTP)
4.
Праймер 1 f (forward)
5. Праймер 2 r (reverse)
6. Образец ДНК, содержащий копируемый фрагмент
7. ДНК-полимераза
Отрицательный контроль
1. Деионизованная вода
2. Буфер для ДНК-полимеразы
3. Смесь дезоксинуклеотидтрифосфатов
(дНТФ, dNTP)
4. Праймер 1 f (forward)
5. Праймер 2 r (reverse)
6. Деионизованная вода
7. ДНК-полимераза
Слайд 24
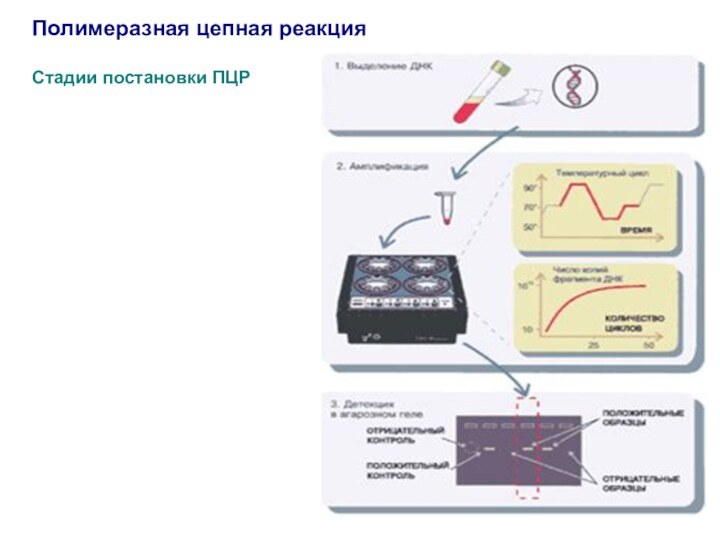
Полимеразная цепная реакция
Стадии постановки ПЦР
Слайд 25
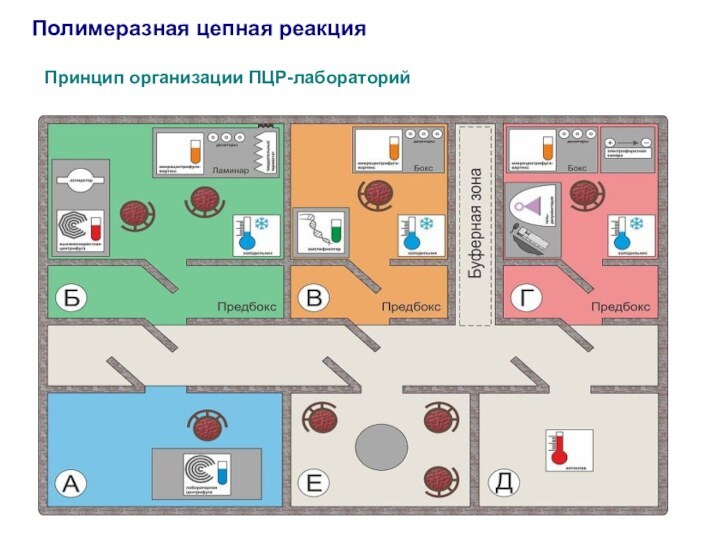
Полимеразная цепная реакция
Принцип организации ПЦР-лабораторий
Слайд 26
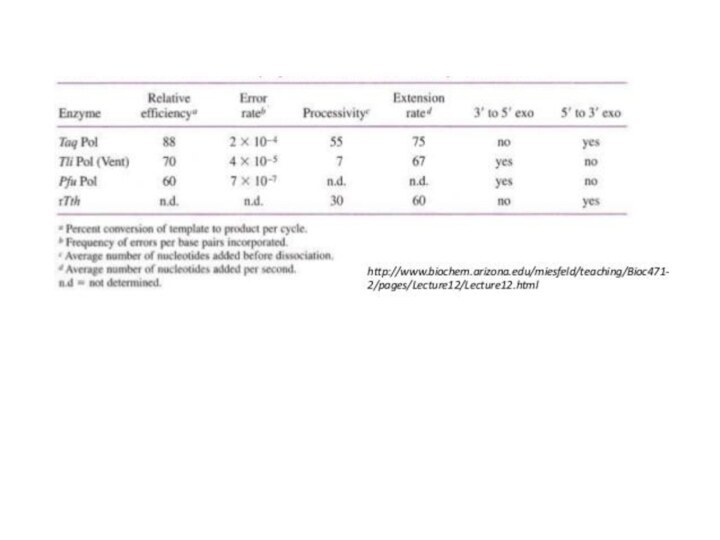
Полимеразная цепная реакция
Ферменты, используемые в ПЦР
Taq-ДНК-полимераза Thermus aquaticus не точный
Tth-ДНК-полимераза Thermus
thermophilus не точный
Pwo-ДНК-полимераза Pyrococcus woesei точный
Pfu-ДНК-полимераза Pyrococcus furiosus точный
AMV-обратная транскриптаза Аvian myeloblastosis virus
MMLV-обратная транскриптаза Moloney murine
leukemia virus точный
Слайд 27
Полимеразная цепная реакция
Ферменты, используемые в ПЦР
Taq-полимераза была выделена
из термофильной эубактерии Thermus aquaticus. Фермент представляет собой одну
полипептидную цепь с молекулярной массой около 95 к Да. Это высокопроцессивный фермент (как правило, эффективно амилифицирующий фрагменты длиной до 3-5 т. п. н.) с хорошо выраженной 5'-3' экзонуклеазной активностью и без 3'-5' (корректирующей) экзонуклеазной активности. Получаемые при использовании Taq-полимеразы фрагменты ДНК, как правило, содержат выступающий 3'-концевой нуклеотид (чаще всего — аденозин), нематрично присоединяемый ферментом. Это свойство Taq-полимеразы используют для эффективного клонирования продуктов ПЦР в специально подготовленные линеаризованные вектора с 3'-выступающим тимидином.
Слайд 28
Полимеразная цепная реакция
Ферменты, используемые в ПЦР
Tth -полимераза была
выделена из термофильной эубактерии Thermus thermophilics. Это также высокопроцессивный
фермент (дает фрагменты длиной до 3 т. п. н.) массой около 94 кДа с хорошо выраженной 5'-3' экзонуклеазной активностью и без З'-5' экзонуклеазной активности. Особенностью этой полимеразы является наличие ревертазной активности (способности использовать в качестве матрицы молекулы РНК). Данный фермент пытаются использовать для проведения обратной транскрипции и ПЦР в одной пробирке.
Слайд 29
Полимеразная цепная реакция
Ферменты, используемые в ПЦР
Pwo -полимераза была
выделена из гипертермофильной архебактерии Pyrococcus woesei. Масса фермента около
90 кДа. Это процессивный фермент (дает фрагменты до 3 т. п. н.) без 5' -3' экзонуклеазной активности и с хорошо выраженной З'-5' экзонуклеазной активностью.
Pfu -полимераза получена из Pyrococcus furiosus. Масса фермента около 92 кДа. Pwo -полимераза отличается сравнительнонизкой процессивностью (эффективно амплифицирует фрагменты до 1 т. п. н.) и обладает 3'-5' экзонуклеазной активностью (proofreading activity). Наличие 3'-5' экзонуклеазной активности делает фермент пригодным для ПЦР, где необходимо получение продукта с высокой точностью синтеза (для последующего клонирования и определения последовательности нуклеотидов).
Слайд 31
Полимеразная цепная реакция
Методы ПЦР
Long-PCR протяженная ПЦР
Hot-start PCR ПЦР с горячим
стартом
Multiplex-PCR множественная ПЦР
«Nested»-PCR гнездная ПЦР
RAPD-PCR Случайная амплификация полиморфной ДНК
RT-PCR ПЦР, совмещенная с реакцией
обратной
транскрипции (ОТ-ПЦР)
Real time PCR ПЦР в режиме реального времени
Слайд 32
Полимеразная цепная реакция
Hot-start PCR (ПЦР c горячим стартом)
Слайд 33
Полимеразная цепная реакция
End-point PCR (ПЦР c анализом
результатов по конечной точке)
Слайд 34
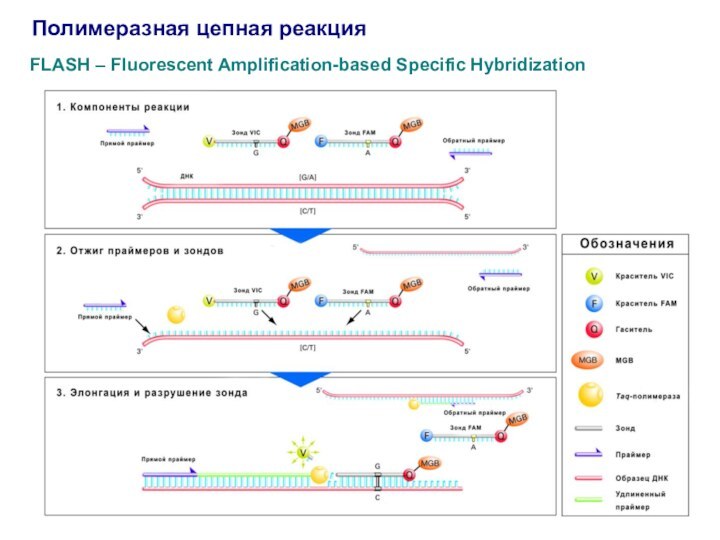
Полимеразная цепная реакция
FLASH – Fluorescent Amplification-based Specific Hybridization
Слайд 35
Полимеразная цепная реакция
Multiplex-PCR (множественная ПЦР)
45
19
17
44
Прямая ДНК-диагностика мышечной дистрофии
Дюшенна с помощью мультиплексной ПЦР (электрофорез в агарозном геле).
У каждого из обследуемых лиц одновременно амплифицированы четыре экзона гена дистрофина (экзоны 17, 19, 44 и 45; стрелки указывают на соответствующие продукты амплификации).
Слайд 36
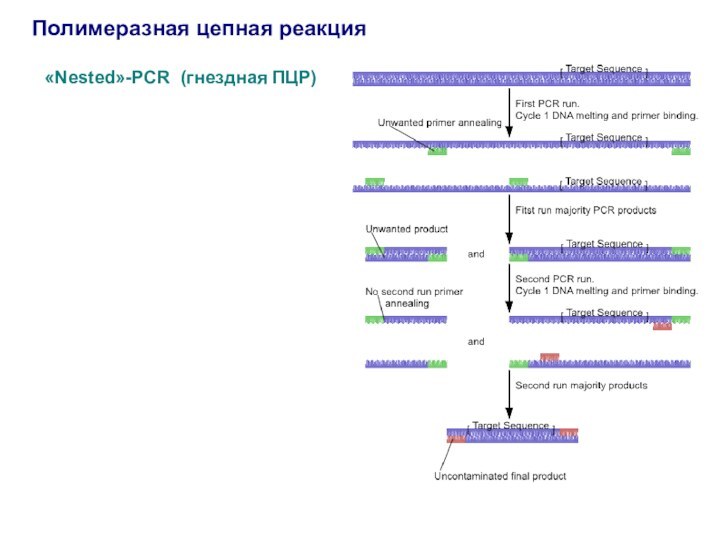
Полимеразная цепная реакция
«Nested»-PCR (гнездная ПЦР)
Слайд 37
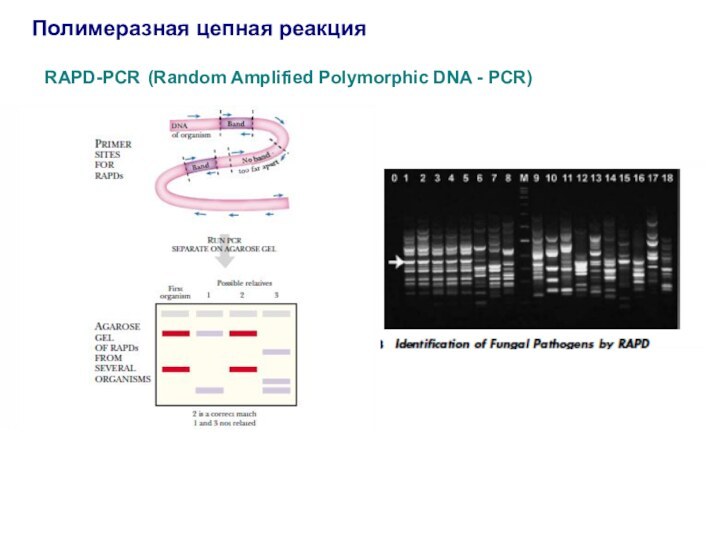
Полимеразная цепная реакция
RAPD-PCR (Random Amplified Polymorphic DNA -
PCR)
Слайд 38
Полимеразная цепная реакция
RT-PCR (ОТ-ПЦР)
ПЦР, совмещенная с реакцией обратной
транскрипции
Слайд 39
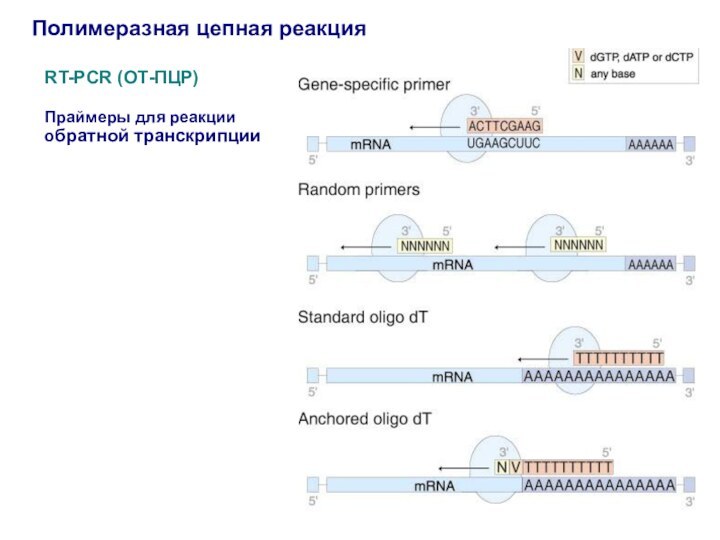
Полимеразная цепная реакция
RT-PCR (ОТ-ПЦР)
Праймеры для реакции обратной транскрипции
Слайд 40
Полимеразная цепная реакция
RT-PCR (ОТ-ПЦР)
Слайд 41
Полимеразная цепная реакция
RT-PCR (ОТ-ПЦР)
http://eu.idtdna.com/pages/decoded/decoded-articles/core-concepts/decoded/2011/09/12/
one-step-two-step
Слайд 42
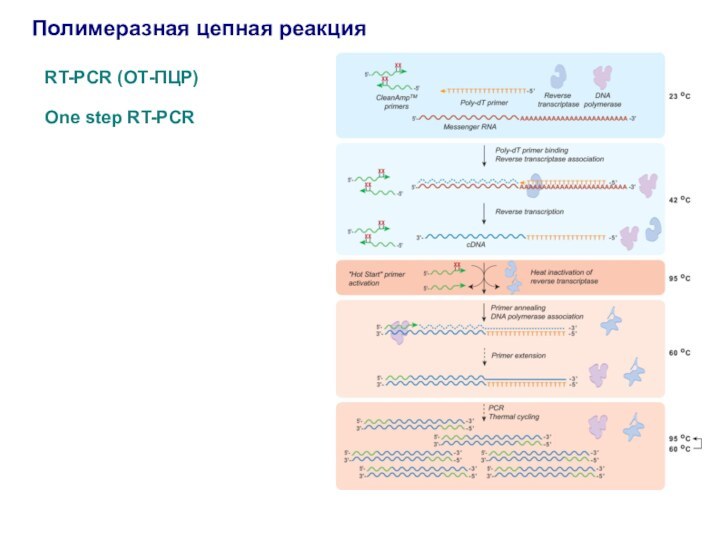
Полимеразная цепная реакция
RT-PCR (ОТ-ПЦР)
One step RT-PCR
Слайд 43
Полимеразная цепная реакция
RT-PCR (ОТ-ПЦР)
http://eu.idtdna.com/pages/decoded/decoded-articles/core-concepts/decoded/2011/09/12/one-step-two-step
Слайд 44
Полимеразная цепная реакция
RT-PCR (ОТ-ПЦР)
Слайд 45
Полимеразная цепная реакция
RT-PCR (ОТ-ПЦР)
Детекция РНК-содержащих вирусов
Слайд 46
Полимеразная цепная реакция
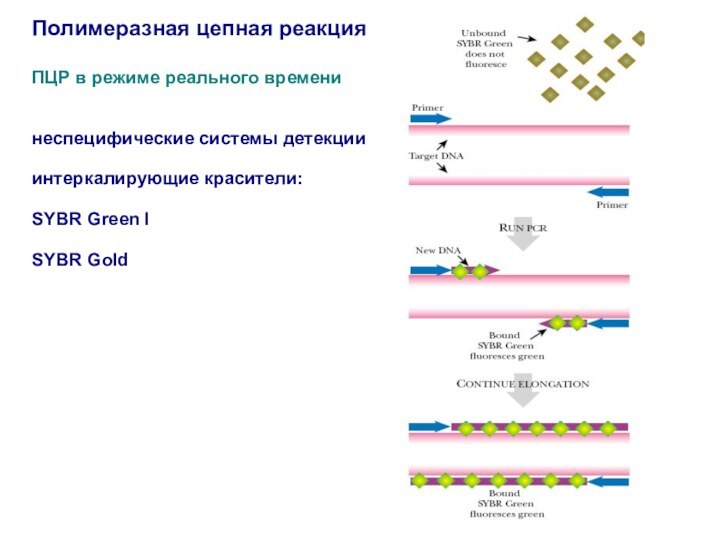
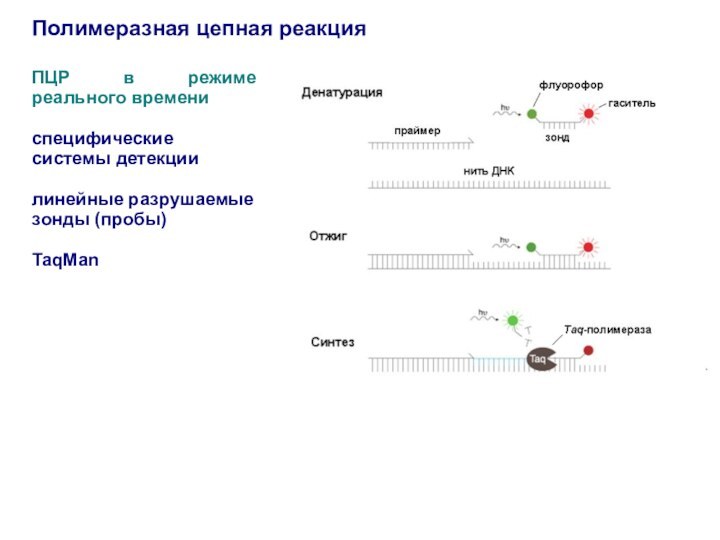
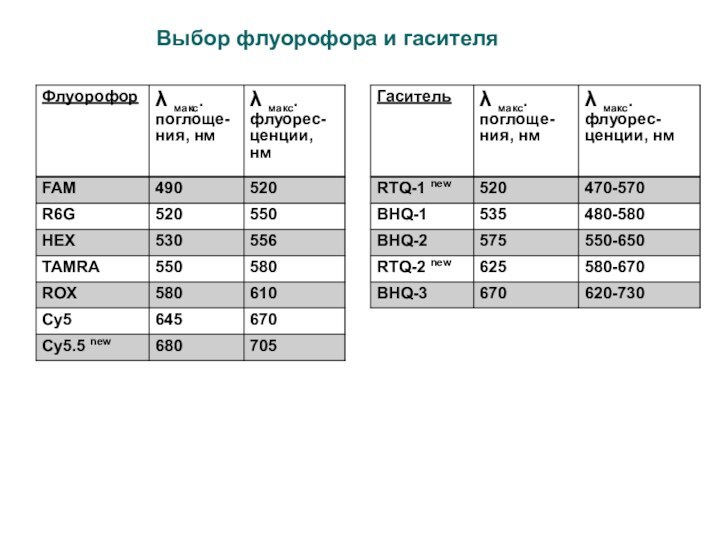
ПЦР в режиме реального времени
неспецифические системы
детекции
интеркалирующие красители:
SYBR Green I
SYBR Gold
Слайд 47
Полимеразная цепная реакция
ПЦР в режиме реального времени
специфические системы
детекции
линейные разрушаемые
зонды (пробы)
TaqMan
Слайд 48
Праймеры и линейные разрушаемые зонды (пробы) TaqMan
Слайд 50
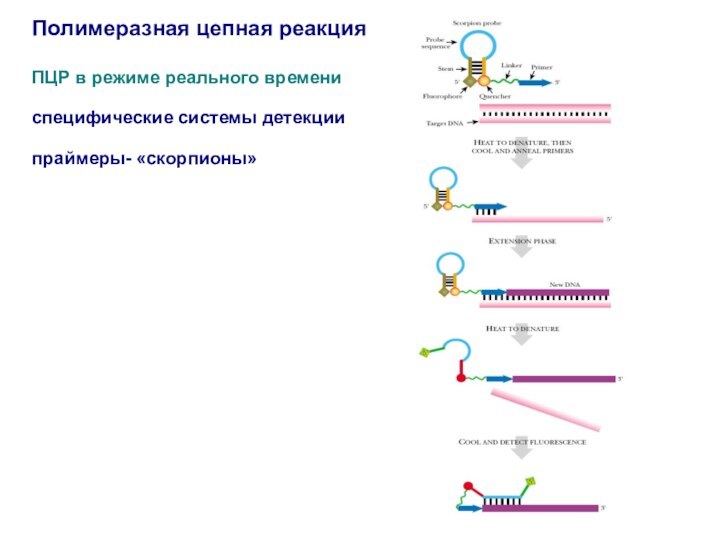
Полимеразная цепная реакция
ПЦР в режиме реального времени
специфические системы
детекции
праймеры- «скорпионы»
Слайд 51
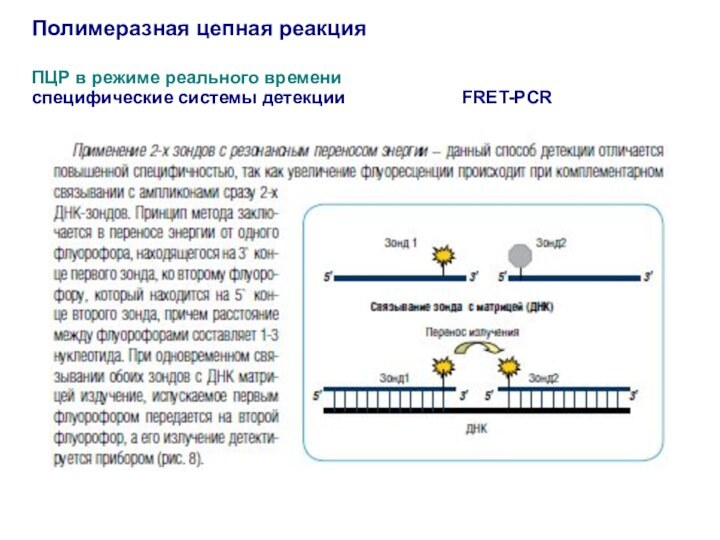
Полимеразная цепная реакция
ПЦР в режиме реального времени
специфические системы
детекции
FRET-PCR
Слайд 52
Полимеразная цепная реакция
ПЦР в режиме реального времени
системы детекции
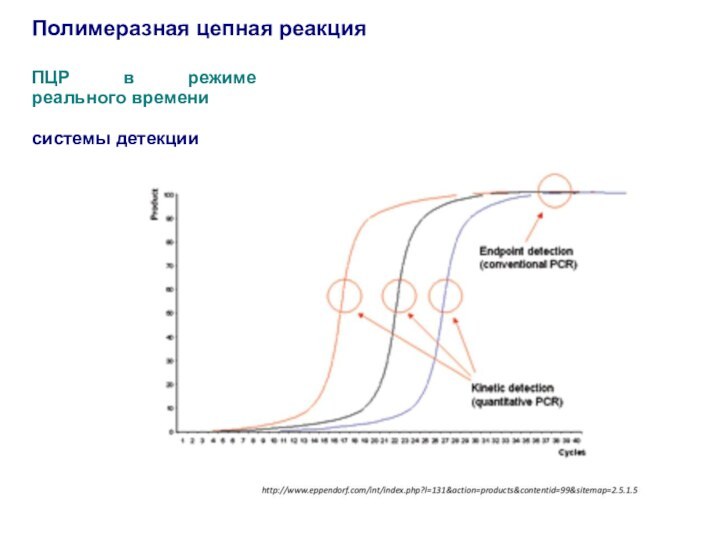
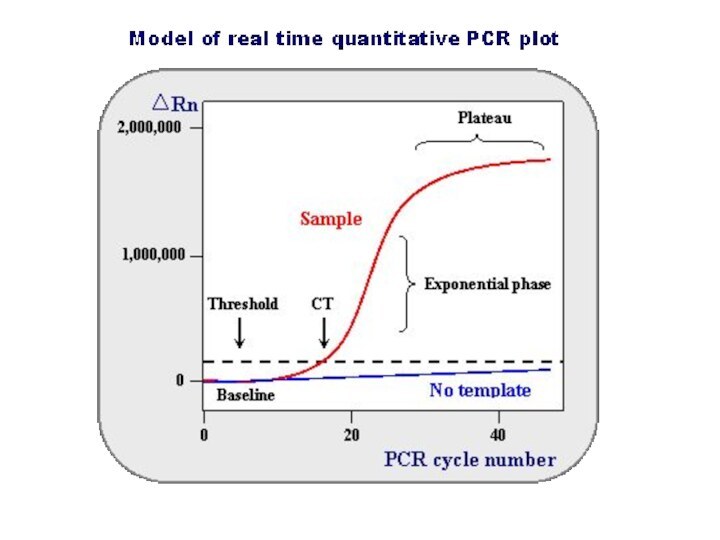
Слайд 54
Полимеразная цепная реакция
ПЦР в режиме реального времени
Количественное определение
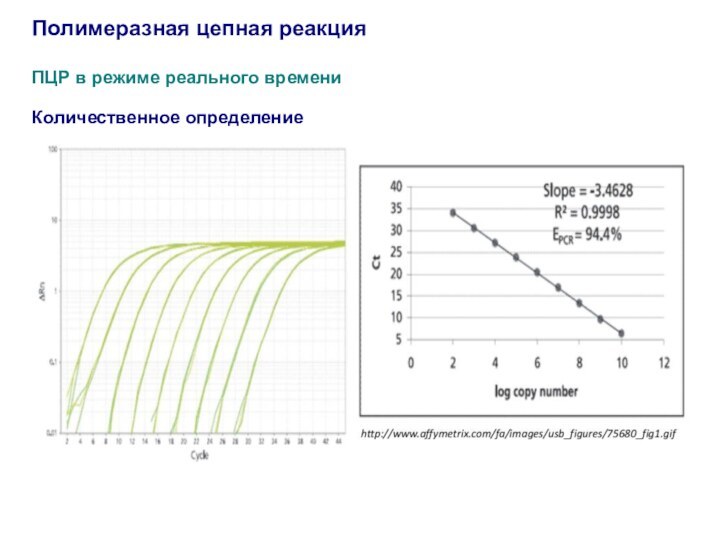
Слайд 55
Полимеразная цепная реакция
ПЦР в режиме реального времени
Количественное определение
Слайд 56
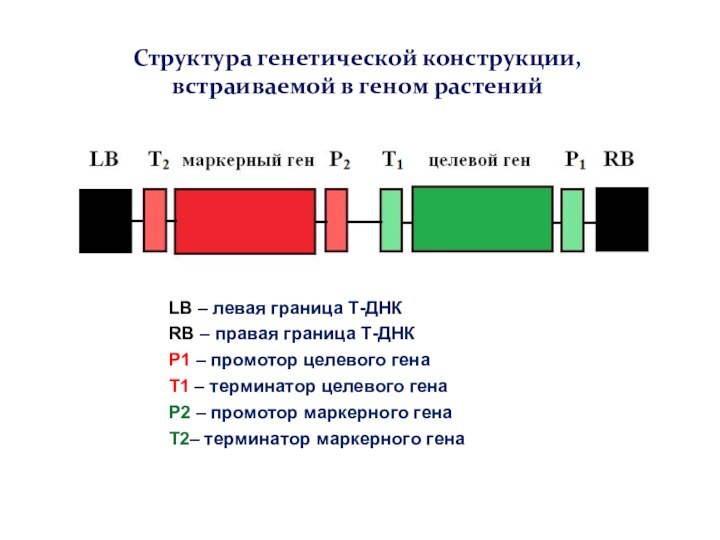
LB – левая граница Т-ДНК
RB – правая граница
Т-ДНК
P1 – промотор целевого гена
T1 – терминатор целевого гена
P2
– промотор маркерного гена
T2– терминатор маркерного гена
Структура генетической конструкции, встраиваемой в геном растений
Слайд 57
Структура праймеров и зонда для выявления фрагмента промотора
35S CaMV
22
Структуру и термодинамические свойства олигонуклеотидов оценивали с помощью
программы Real Time Design на сайте http://www.biosearchtech.com/.
Праймер 35Sf - CCACTGACGTAAGGGATGAC, длина 20 н., Tm – 64,2 °С
Праймер 53Sr – CTCTCCAAATGAAATGAACTTCC, длина 23 н. Tm – 63,1 °С
Зонд – FAM- CAATCCCACTATCCTTCGCAAGACCC-BHQ1, длина – 26 н.,Tm – 70,5 °С
Слайд 58
Режим ПЦР
* - регистрация результатов
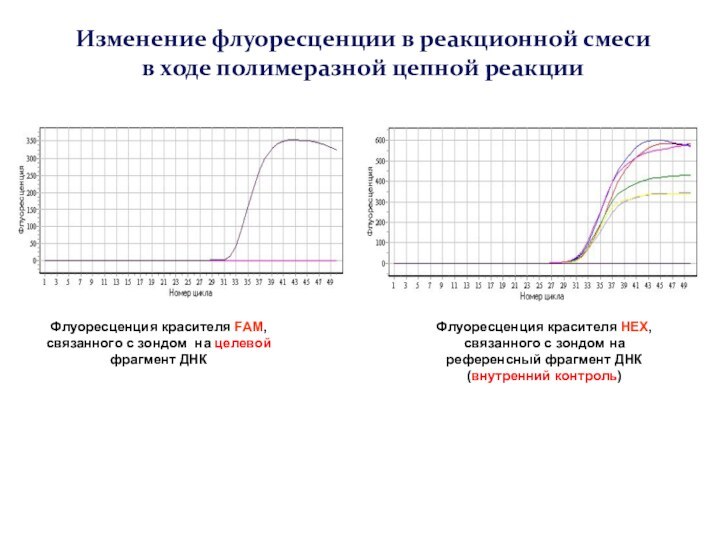
Слайд 59
Изменение флуоресценции в реакционной смеси в ходе полимеразной
цепной реакции
Флуоресценция красителя FAM, связанного с зондом на целевой
фрагмент ДНК
Флуоресценция красителя HEX, связанного с зондом на референсный фрагмент ДНК (внутренний контроль)
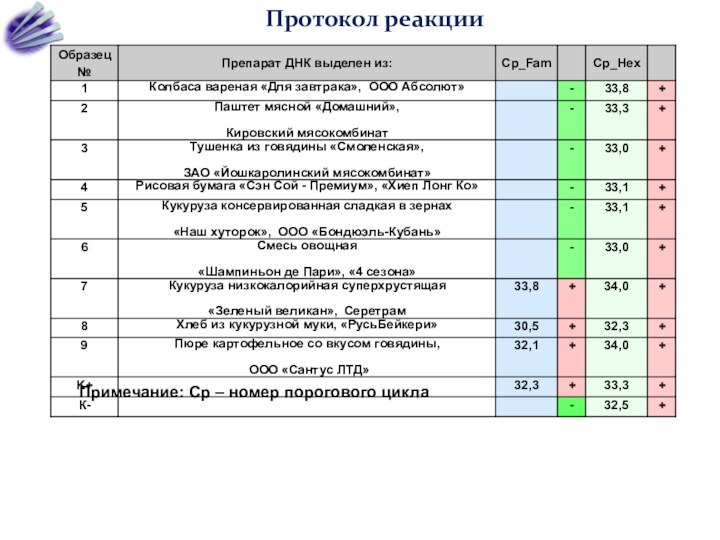
Слайд 60
Протокол реакции
Примечание: Cp – номер порогового цикла
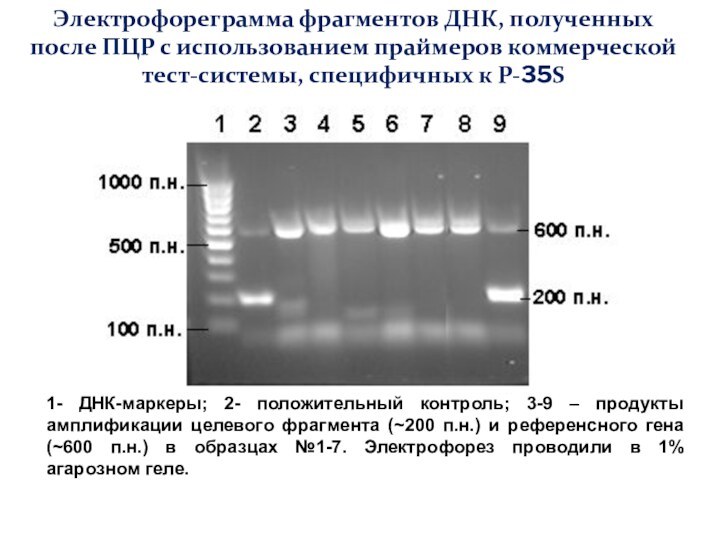
Слайд 61
Электрофореграмма фрагментов ДНК, полученных
после ПЦР с использованием
праймеров коммерческой тест-системы, специфичных к Р-35S
1- ДНК-маркеры; 2- положительный
контроль; 3-9 – продукты амплификации целевого фрагмента (~200 п.н.) и референсного гена (~600 п.н.) в образцах №1-7. Электрофорез проводили в 1% агарозном геле.
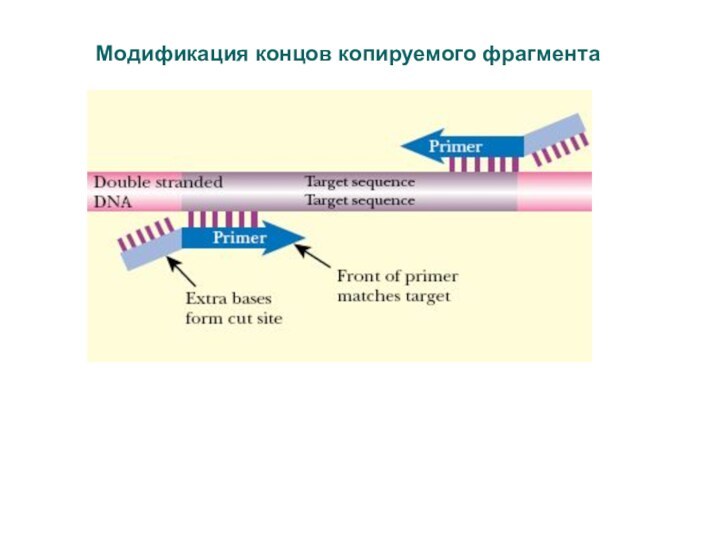
Слайд 62
Модификация концов копируемого фрагмента