- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Генетика бактерий
Содержание
- 2. ПЛАЗМИДЫРазмеры плазмид от 1 до 200 kilobase
- 3. Типы плазмидТрансмиссивныеНетрансмиссивныеИнтегративныеНеинтегративныеСовместимыеНесовместимые
- 4. Типы плазмидТрасмиссивные плазмиды обладают tra-опероном, который обеспечивает
- 5. Типы плазмид.Fertility-F-плазмида содержит tra-оперон. Обеспечивает процесс конъюгацииResistance-(R) фактор,содержит гены, обеспечивающие резистентность к антибиотикам.
- 6. Типы плазмидCol-плазмида, кодирующие синтез бактерицинов, которые убивают
- 7. Определение плазмидного профиля бактерий.Плазмидный профиль позволяет произвести
- 8. Использование плазмид
- 9. Подвижные генетические элементы обнаружены в составе бактериального
- 10. подвижные генетические элементыПеремещение подвижных генетических элементов принято
- 11. IS-элементыIS-элементы имеют размеры - 1000 н.п. и
- 12. IS-элементыЭти гены по флангам окружены инвертированными повторами,
- 13. IS-элементыИнвертированные повторы узнает транспозаза, она делает одноцепочечные
- 14. Подвижные генетические элементыТранспозоны — это сегменты ДНК,
- 15. Перемещение подвижных генетических элементов по репликону или
- 16. Защита бактерий от антибиотиков осуществляется при помощи:Плазмид ТранспозоновИнтегронов
- 17. attC1attIattIattC2attC1attIattC1attC25‘консервативный сегменткассета 1кассета 2Интегроны-система захвата и экспрессии
- 18. Интеграза через посредство сайт-специфической рекомбинации включает в
- 19. Кассеты могут существовать в виде свободных циркулярных
- 20. G TTRRRY генRYYYAAC---------G TTRRRY«Инвертированный Core
- 21. Кассеты состоят из одного гена и короткой
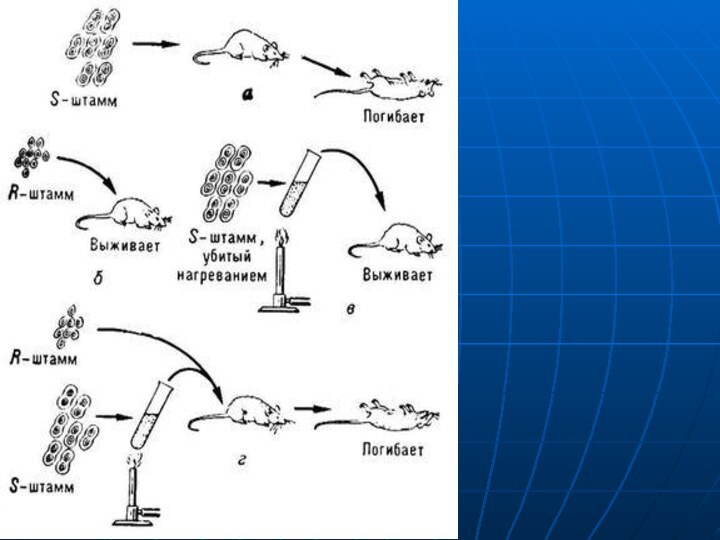
- 22. Изменения генома1. Мутации2. Рекомбинации
- 24. Передача генетической информации
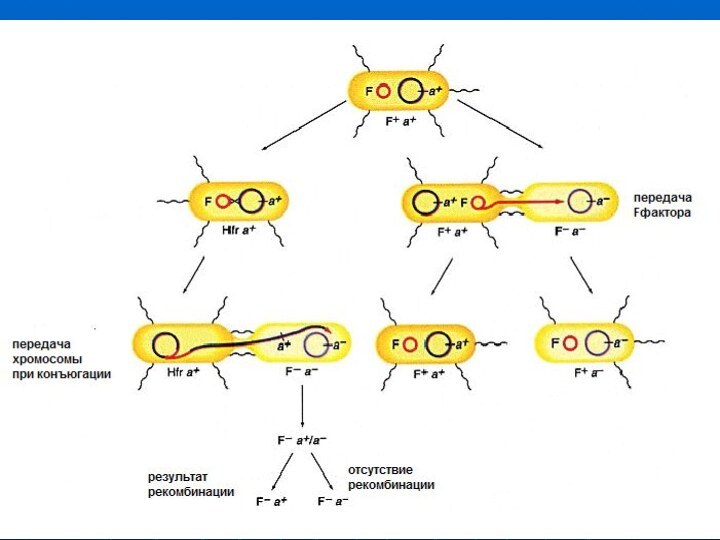
- 25. Конъюгация
- 26. F+ x F-
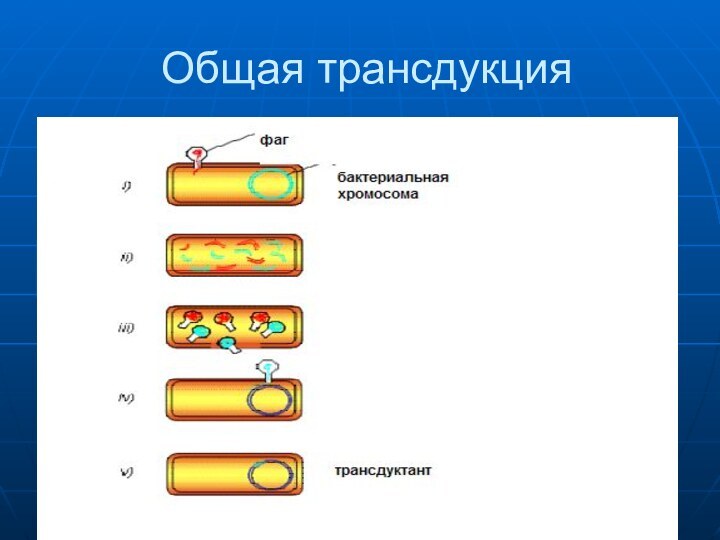
- 28. Общая трансдукция
- 31. Схема трансфoрмации
- 32. Молекулярные методы используемые в микробиологии1. ПЦР2. Микрочип3.Риботипирование4.Отпечатки
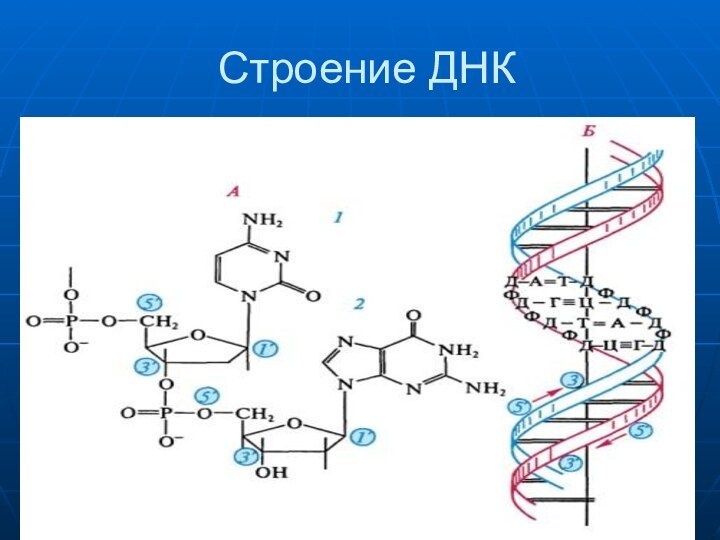
- 33. Строение ДНК
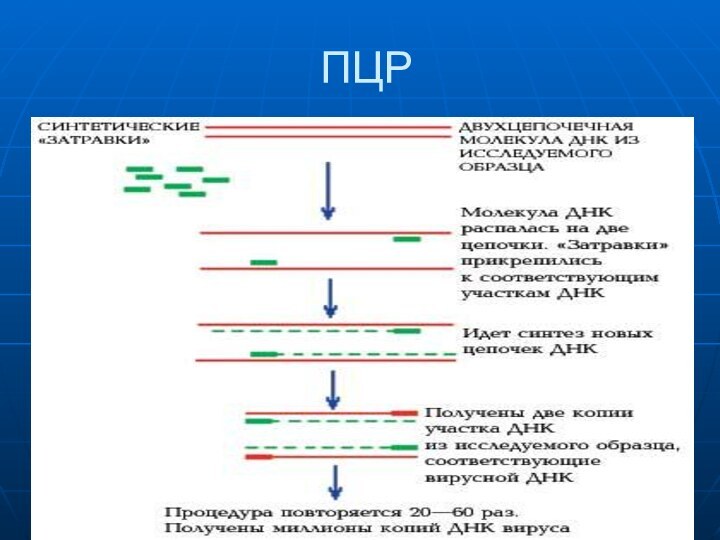
- 34. ПЦР
- 35. амплификатор
- 36. РиботипированиеПрименяется для для выявления у изучаемых штаммов
- 37. Риботипирование1. Исследуемую ДНК подвергают рестрикции2. Продукты рестрикции
- 38. РиботипированиеВ результате гибридизации зонда с фрагментами ДНК,
- 39. 100-200 μmДНК микрочип:Стеклянная пластика, к которой прикреплены молекулярные зонды
- 40. Общая ДНКСпецифический ПЦР продукт(i.e., 16S рРНК ген
- 41. Много молекул мишенийСильный сигналlСлабый сигналМало мишениНет сигналаНет
- 42. ПЦР в реальном времениПЦР в реальном времени
- 43. ПЦР в реальном времени. ПЦР в реальном
- 44. ПЦР в реальном времениВо время процесса амплификации
- 45. ПЦР в реальном времени
- 46. Метод branched-DNA (bDNA) амплификацииВ основе этого метода
- 47. Метод branched-DNA (bDNA) амплификацииПервичные олигонуклеотидные зонды, специфичные
- 48. Метод branched-DNA (bDNA) амплификацииВнесенные молекулы РНК(ДНК) гибридизируются
- 49. Метод branched-DNA (bDNA) амплификацииКоличественное определение вирусной РНК проводят с использованием специальных референс-стандартов.
- 50. Метод branched-DNA (bDNA) амплификации
- 52. Мультилокусное секвенирование-типированиеЧаще анализируют «гены домашнего хозяйства», которые
- 53. Мультилокусное секвенирование-типированиеСравнение нуклеотидных последовательностей таких генов позволяет
- 54. Мультилокусное секвенирование-типирование этапы исследования1. выделения ДНК из
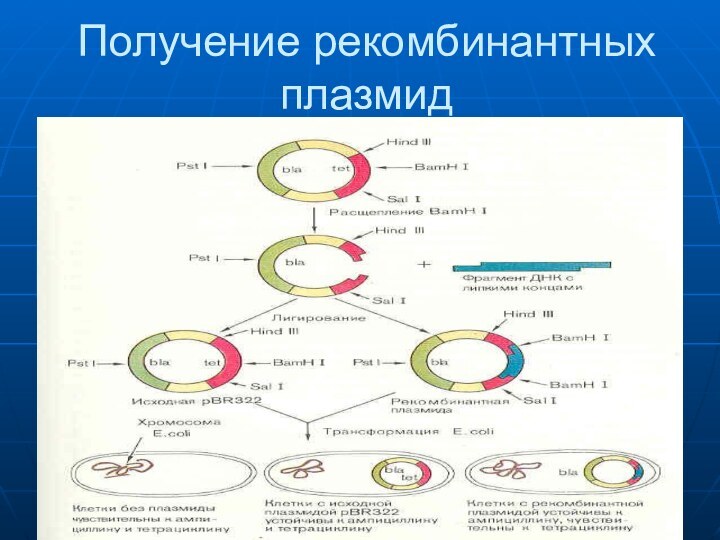
- 55. Плазмида рBR322
- 56. Скачать презентацию
- 57. Похожие презентации
ПЛАЗМИДЫРазмеры плазмид от 1 до 200 kilobase (kbp). Количество плазмид в одной клетке от 1 до 1000 в зависимости от групп совместимости












































Слайд 3
Типы плазмид
Трансмиссивные
Нетрансмиссивные
Интегративные
Неинтегративные
Совместимые
Несовместимые
Слайд 4
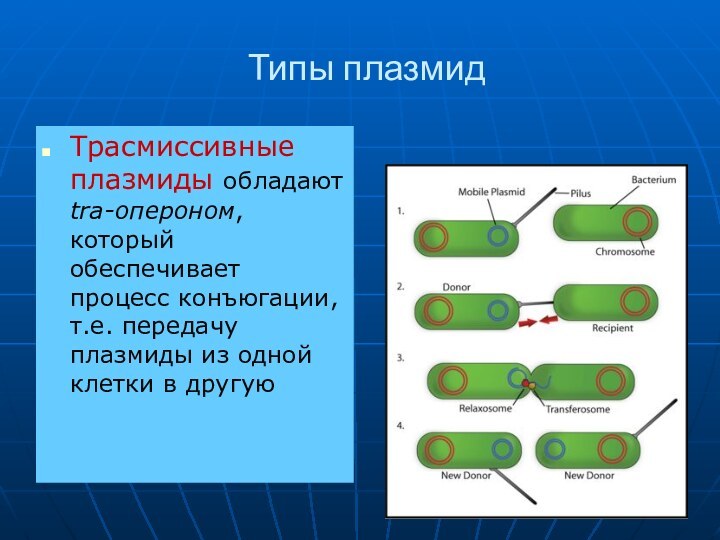
Типы плазмид
Трасмиссивные плазмиды обладают tra-опероном, который обеспечивает процесс
конъюгации, т.е. передачу плазмиды из одной клетки в другую
Слайд 5
Типы плазмид
.
Fertility-F-плазмида содержит tra-оперон. Обеспечивает процесс конъюгации
Resistance-(R) фактор,содержит
гены, обеспечивающие резистентность к антибиотикам.
Слайд 6
Типы плазмид
Col-плазмида, кодирующие синтез бактерицинов, которые убивают другие
бактерии.
Плазмиды вирулентности – кодируют факторы агрессии у патогенных
микробов
Слайд 7
Определение плазмидного профиля бактерий.
Плазмидный профиль позволяет произвести внутривидовую
идентификацию бактерий. Для этого из бактериальной клетки выделяют плазмидную
ДНК, которую разделяют электрофорезом в агарозном геле, для определения количества и размеров плазмид.Слайд 9 Подвижные генетические элементы обнаружены в составе бактериального генома,
как в бактериальной хромосоме, так и в плазмидах. К
подвижным генетическим элементам относятся вставочные последовательности и транспозоны.
Слайд 10
подвижные генетические элементы
Перемещение подвижных генетических элементов принято называть
репликативной или незаконной рекомбинацией.
В отличие от бактериальной хромосомы и
плазмид подвижные генетические элементы не являются самостоятельными репликонами, так как их репликация — составной элемент репликации ДНК репликона, в составе которого они находятся.
Слайд 11
IS-элементы
IS-элементы имеют размеры - 1000 н.п. и содержат
лишь те гены, которые необходимы для их собственного перемещения
— транспозиции: ген, кодирующий фермент транспозазу, обеспечивающую процесс исключения IS-элемента из ДНК и его интеграцию в новый локус, и ген, детерминирующий синтез репрессора, который регулирует весь процесс перемещения.
Слайд 12
IS-элементы
Эти гены по флангам окружены инвертированными повторами, которые
служат сайтами рекомбинации, сопровождающей перемещения вставочной последовательности при участии
транспозиционных ферментов, в частности транспозаз.
Слайд 13
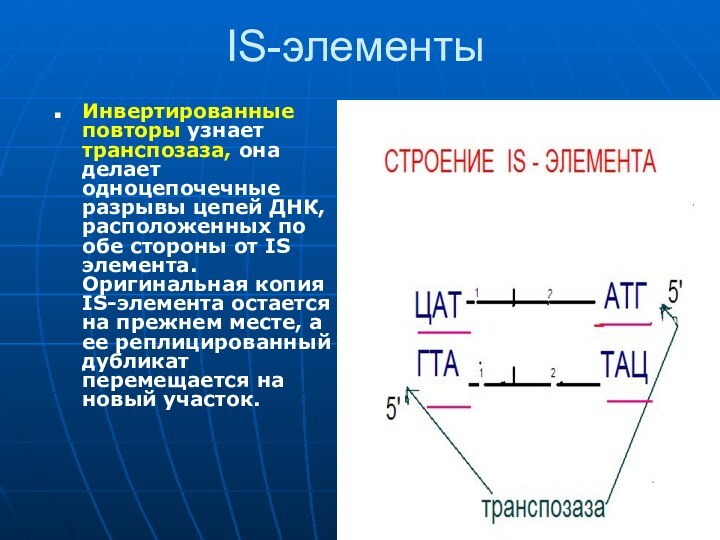
IS-элементы
Инвертированные повторы узнает транспозаза, она делает одноцепочечные разрывы
цепей ДНК, расположенных по обе стороны от IS элемента.
Оригинальная копия IS-элемента остается на прежнем месте, а ее реплицированный дубликат перемещается на новый участок.
Слайд 14
Подвижные генетические элементы
Транспозоны — это сегменты ДНК, обладающие
теми же свойствами, что и IS-элементы, но имеющие в
своем составе структурные гены, например ген токсина, гены,обеспечивающие устойчивость к антибиотикам.Слайд 15 Перемещение подвижных генетических элементов по репликону или между
репликонами, вызывает:
1. Инактивацию генов тех участков ДНК, куда они,
переместившись, встраиваются.2. Образование повреждений генетического материала.
3. Слияние репликонов, т. е. встраивание плазмиды в хромосому.
4. Распространение генов в популяции бактерий, что может приводить к изменению биологических свойств популяции, смене возбудителей инфекционных заболеваний, а
также способствует эволюционным процессам среди микробов.
Слайд 17
attC1
attI
attI
attC2
attC1
attI
attC1
attC2
5‘консервативный сегмент
кассета 1
кассета 2
Интегроны-система захвата и экспрессии генов
которая состоит из гена intI , кодирующего интегразу, рекомбинационного
сайта attI и промотера.intI
P
Слайд 18 Интеграза через посредство сайт-специфической рекомбинации включает в интегрон
или вырезает из него генные кассеты.
Мобильность генной кассеты
составляет эффективную систему распространения генов резистентности к антибиотикам. Слайд 19 Кассеты могут существовать в виде свободных циркулярных молекул
ДНК, но обычно они интегрированы в линейной форме в
интегронГенная кассета экспрессируется в интегроне с общего промотера, локализованного на 5’консервативном участке интегнора.
Слайд 20
G TTRRRY ген
RYYYAAC---------G TTRRRY
«Инвертированный Core сайт »
attC
сайт
« Core сайт »
Кассеты состоят из одного гена и короткой
последовательности, представляющей сайт специфической рекомбинации, который называется attC site, состоящий из 59 пар оснований « элемент 59-пар оснований »Кассета
Слайд 21
Кассеты состоят из одного гена и короткой последовательности,
представляющей сайт специфической рекомбинации, который называется attC site, состоящий
из 59 пар оснований « элемент 59-пар оснований »
Слайд 32
Молекулярные методы используемые в микробиологии
1. ПЦР
2. Микрочип
3.Риботипирование
4.Отпечатки пальцев
5.Плазмидный
профиль
6. Мультилокусное секвенирование
Идентификация микроба без выделения чистой культуры
Внутривидовая идентификация
Слайд 36
Риботипирование
Применяется для для выявления у изучаемых штаммов различий
в количестве рибосомальных оперонов, а также рестрикционального полиморфизма их
нуклеотидных последовательностей
Слайд 37
Риботипирование
1. Исследуемую ДНК подвергают рестрикции
2. Продукты рестрикции разделяют
электрофорезом в полиакриламидном геле
3. Разделенные фрагменты наносят на мембрану
и обрабатывают ДНК-зондами, кодирующими 16S и 23SРНК
Слайд 38
Риботипирование
В результате гибридизации зонда с фрагментами ДНК, содержащими
комплекс рРНК-оперонов (в бактериальной хромосоме имеются многочисленные опероны, содержащие
гены 16Sи 23S РНК) образуется профиль, содержащий до 10 полос, обладающий видовой и штаммовой специфичностью, который исследуется автоматически.
Слайд 40
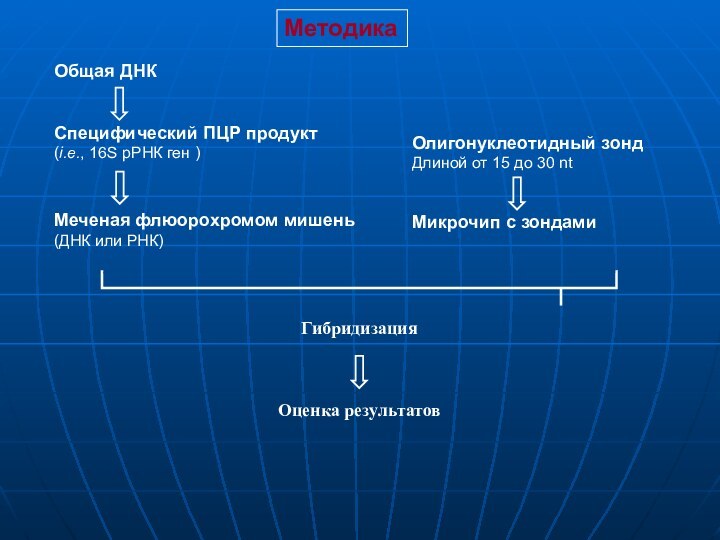
Общая ДНК
Специфический ПЦР продукт
(i.e., 16S рРНК ген )
Меченая
флюорохромом мишень
(ДНК или РНК)
Олигонуклеотидный зонд
Длиной от 15 до 30
ntГибридизация
Микрочип с зондами
Оценка результатов
Методика
Слайд 41
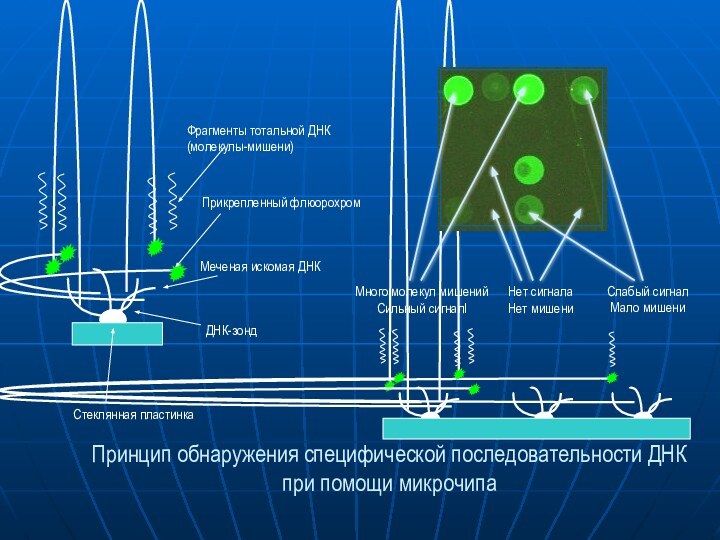
Много молекул мишений
Сильный сигналl
Слабый сигнал
Мало мишени
Нет сигнала
Нет мишени
Стеклянная
пластинка
ДНК-зонд
Меченая искомая ДНК
Прикрепленный флюорохром
Фрагменты тотальной ДНК
(молекулы-мишени)
Принцип обнаружения специфической последовательности
ДНКпри помощи микрочипа
Слайд 42
ПЦР в реальном времени
ПЦР в реальном времени позволяет
провести полный анализ пробы в течение 20-60 мин и
теоретически способен определить даже одну молекулу ДНК или РНК в пробе.
Слайд 43
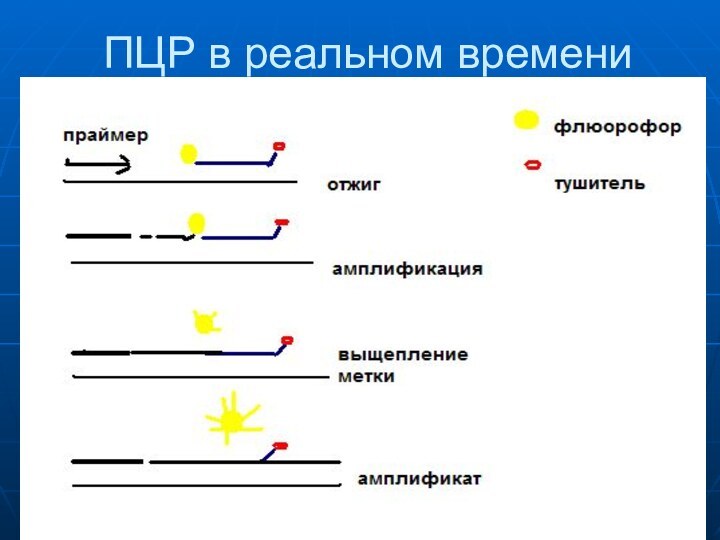
ПЦР в реальном времени
. ПЦР в реальном времени
использует зонд, несущий флуорофор и тушитель, комплементарный средней части
амплифицируемого фрагмента. Когда флуорофор и тушитель связаны с олигонуклеотидным зондом, наблюдается лишь незначительная флуоресцентная эмиссия.
Слайд 44
ПЦР в реальном времени
Во время процесса амплификации за
счет 5'-экзонуклеазной активности Taq-полимеразы флуоресцентная метка переходит в раствор,
освобождаясь от соседства с тушителем, и генерирует флуоресцентный сигнал, усиливающийся в реальном времени пропорционально накоплению амплификата
Слайд 46
Метод branched-DNA (bDNA) амплификации
В основе этого метода амплификация
вирусной РНК осуществляется последовательными шагами олигонуклеотидной гибридизации.
Для этого используют
серию первичных зондов и меченые ферментом вторичные зонды ДНК
Слайд 47
Метод branched-DNA (bDNA) амплификации
Первичные олигонуклеотидные зонды, специфичные для
РНК (или ДНК) исследуемого образца, так называемых РНК-
(ДНК) – мишений, фиксируются на твердой поверхности лунок микротитрационного планшета. Это, так называемые «зонды захвата». Исследуемый образец (РНК-мишень) разводится, и разведения добавляют в титрационные лунки.
Слайд 48
Метод branched-DNA (bDNA) амплификации
Внесенные молекулы РНК(ДНК) гибридизируются с
«зондами захвата». После этого вносят меченые ферментом ДНК-зонды. Добавляют
хемиолюминесцентный субстрат и измеряют интенсивность свечения, которая будет соответствовать количеству РНК-мишени в исследуемом образце.
Слайд 49
Метод branched-DNA (bDNA) амплификации
Количественное определение вирусной РНК проводят
с использованием специальных референс-стандартов.
Слайд 51 Мультилокусное секвенирование-типирование метод генетического типирования, основанный на определении последовательности
нуклеотидов небольших фрагментов (500н.п.) ряда генов и последующем сравнении
соответствующих последовательностей у разных организмов.
Слайд 52
Мультилокусное секвенирование-типирование
Чаще анализируют «гены домашнего хозяйства», которые являются
необходимыми для протекания реакций основного метаболизма, а значит присутствуют
у всех организмов. Они в силу своей исключительной важности, характеризуются низкой скоростью накопления мутаций
Слайд 53
Мультилокусное секвенирование-типирование
Сравнение нуклеотидных последовательностей таких генов позволяет относительно
легко устанавливать степень филогенетического родства между популяциями и систематизировать
их. Чаще исследуют 7-8 локусов, что обеспечивает достаточную разрешающую способность метода
Слайд 54
Мультилокусное секвенирование-типирование
этапы исследования
1. выделения ДНК из образца исследуемых
микроорганизмов
2. амплификация участков определенных локусом ПЦР с использованием подходящих
праймеров3. анализ амплифицированных участков с помощью секвенаторами
4. сравнение с помощью специальных программ полученные результаты с имеющимися в базе данных