Слайд 2
Классификация мутаций
При хромосомных мутациях происходят как изменение числа
отдельных хромосом в геноме (анеуплоидия), так и крупные перестройки
структуры отдельных хромосом (хромосомные аберрации):
Делеция - потеря части генетического материала.
Дупликация - удвоение части генетического материала.
Инверсия - изменение ориентации сегментов хромосом в отдельных хромосомах.
Транслокация - перенос части генетического материала с одной хромосомы на другую.
Слайд 3
Классификация мутаций
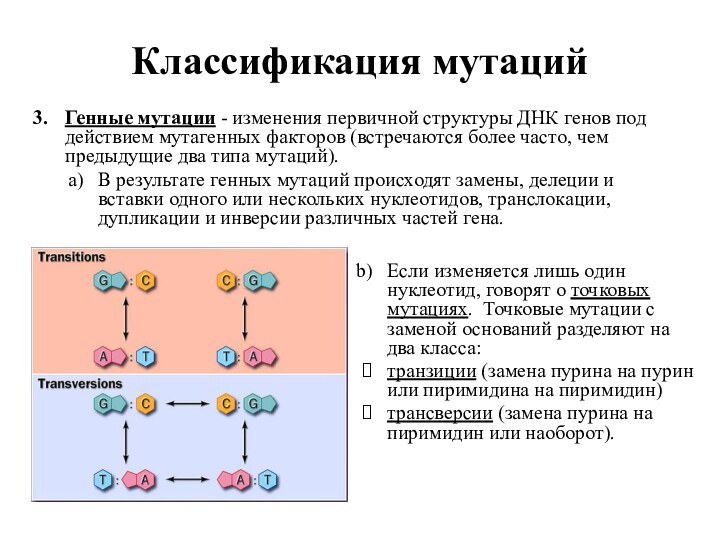
Генные мутации - изменения первичной структуры ДНК
генов под действием мутагенных факторов (встречаются более часто, чем
предыдущие два типа мутаций).
В результате генных мутаций происходят замены, делеции и вставки одного или нескольких нуклеотидов, транслокации, дупликации и инверсии различных частей гена.
Если изменяется лишь один нуклеотид, говорят о точковых мутациях. Точковые мутации с заменой оснований разделяют на два класса:
транзиции (замена пурина на пурин или пиримидина на пиримидин)
трансверсии (замена пурина на пиримидин или наоборот).
Слайд 4
Классификация мутаций
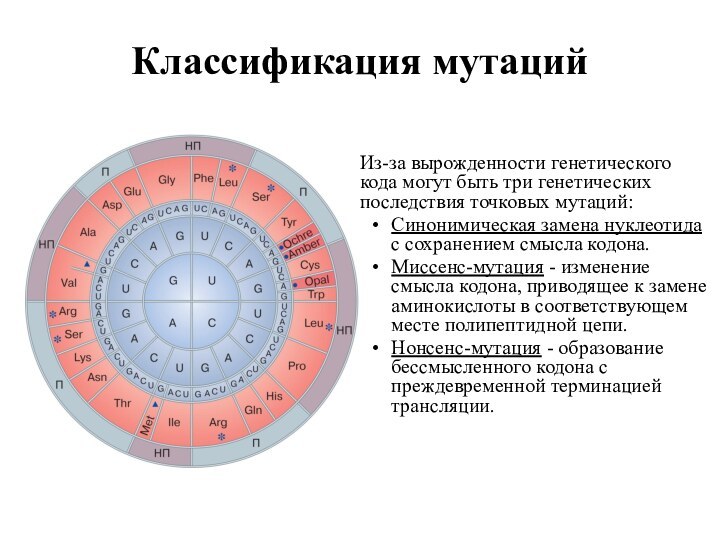
Из-за вырожденности генетического кода могут быть три
генетических последствия точковых мутаций:
Синонимическая замена нуклеотида с сохранением
смысла кодона.
Миссенс-мутация - изменение смысла кодона, приводящее к замене аминокислоты в соответствующем месте полипептидной цепи.
Нонсенс-мутация - образование бессмысленного кодона с преждевременной терминацией трансляции.
Слайд 5
Классификация мутаций
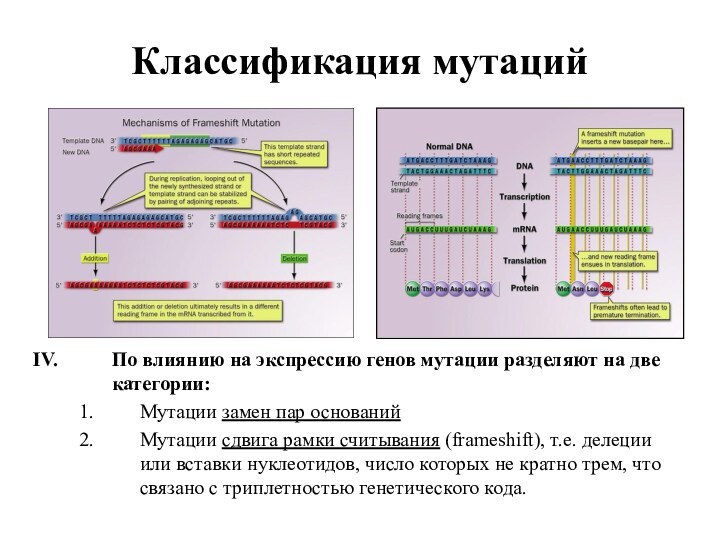
По влиянию на экспрессию генов мутации разделяют
на две категории:
Мутации замен пар оснований
Мутации сдвига рамки считывания
(frameshift), т.е. делеции или вставки нуклеотидов, число которых не кратно трем, что связано с триплетностью генетического кода.
Слайд 7
Повреждения ДНК
Появление различно модифицированных оснований:
Пиримидиновые димеры.
Алкилированые производные.
Дезаминированые основания.
Различные
таутомерные формы.
Появление неспаренных оснований (Mismatch) в результате рекомбинации дуплексов
или ошибок в процессе репликации.
Повреждения структуры дуплекса:
Разрывы фосфодиэфирных связей сахарофосфатного остова молекулы ДНК.
Разрывы β-гликозидных связей между основанием и дезоксирибозой.
Слайд 8
Активные формы кислорода
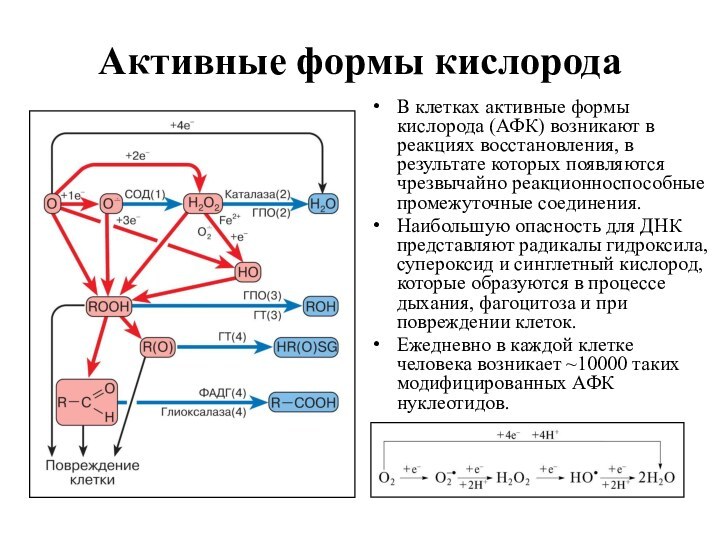
В клетках активные формы кислорода (АФК)
возникают в реакциях восстановления, в результате которых появляются чрезвычайно
реакционноспособные промежуточные соединения.
Наибольшую опасность для ДНК представляют радикалы гидроксила, супероксид и синглетный кислород, которые образуются в процессе дыхания, фагоцитоза и при повреждении клеток.
Ежедневно в каждой клетке человека возникает ~10000 таких модифицированных АФК нуклеотидов.
Слайд 9
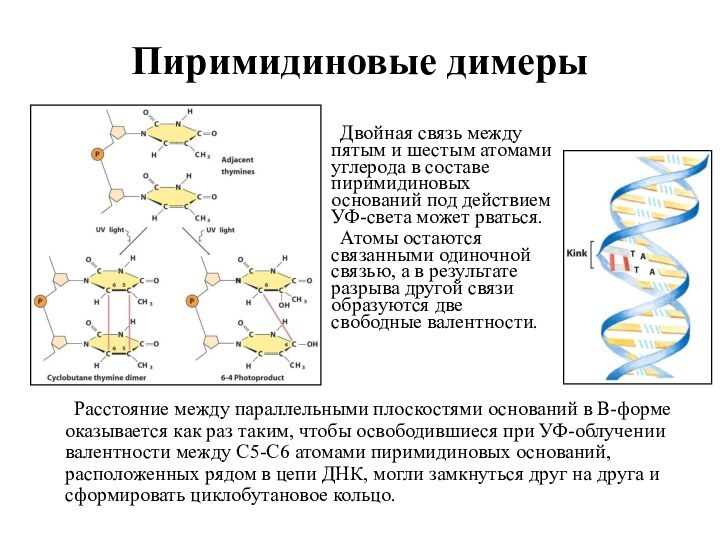
Пиримидиновые димеры
Расстояние между параллельными плоскостями оснований в В-форме
оказывается как раз таким, чтобы освободившиеся при УФ-облучении валентности
между С5-С6 атомами пиримидиновых оснований, расположенных рядом в цепи ДНК, могли замкнуться друг на друга и сформировать циклобутановое кольцо.
Двойная связь между пятым и шестым атомами углерода в составе пиримидиновых оснований под действием УФ-света может рваться.
Атомы остаются связанными одиночной связью, а в результате разрыва другой связи образуются две свободные валентности.
Слайд 10
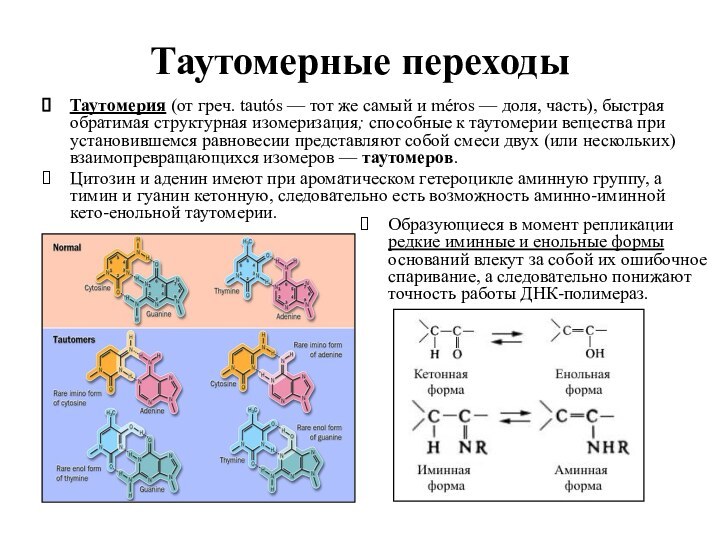
Таутомерные переходы
Таутомерия (от греч. tautós — тот же
самый и méros — доля, часть), быстрая обратимая структурная
изомеризация; способные к таутомерии вещества при установившемся равновесии представляют собой смеси двух (или нескольких) взаимопревращающихся изомеров — таутомеров.
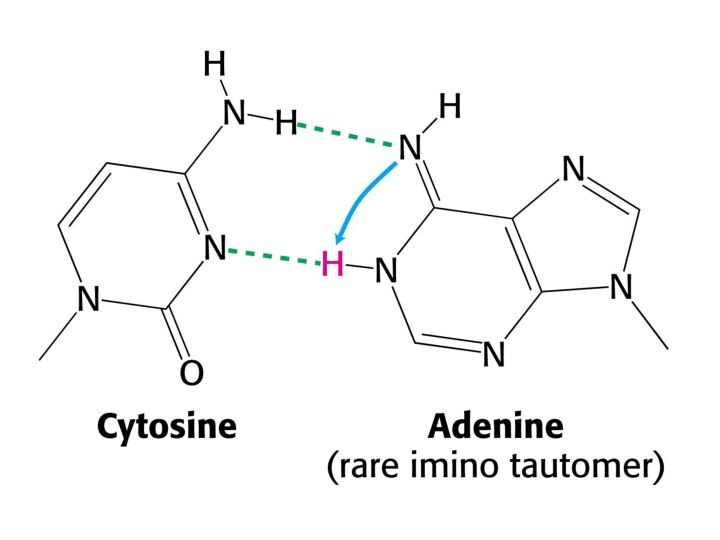
Цитозин и аденин имеют при ароматическом гетероцикле аминную группу, а тимин и гуанин кетонную, следовательно есть возможность аминно-иминной кето-енольной таутомерии.
Образующиеся в момент репликации редкие иминные и енольные формы оснований влекут за собой их ошибочное спаривание, а следовательно понижают точность работы ДНК-полимераз.
Слайд 12
Разнообразие систем репарации
Существует огромное количество самых различных систем
репарации. Все эти системы появлялись в эволюции независимо, в
различные её периоды.
Один тип повреждений, как правило, репарируют несколько различных ферментативных систем, взаимно дополняя друг друга.
К прямой репарации относят процессы в которых происходит узнавание и непосредственное восстановление какого-либо типа повреждений.
К непрямой репарации (опосредованной) относят процессы более универсального характера, позволяющие исправлять широкий набор повреждений с помощью мультиферментных систем.
Слайд 13
Разнообразие систем репарации
Прямая репарация:
Фотореактивация.
Дезалкилирование модифицированных нуклеотидов.
Сшивание однонитевых разрывов.
Прямая
вставка оснований в АП-сайт.
Непрямая репарация:
Эксцизионная репарация ДНК путем удаления
поврежденных азотистых оснований (BER).
Эксцизионная репарация ДНК путем удаления нуклеотидов (NER).
Репарация ошибочно спаренных нуклеотидов (MMR).
Пострепликативная (рекомбинационная) репарация.
SOS-репарация.
Слайд 14
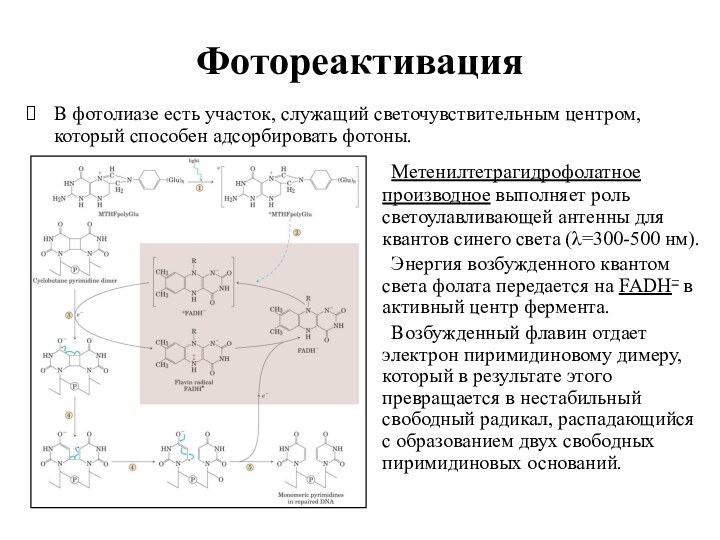
Фотореактивация
В фотолиазе есть участок, служащий светочувствительным центром, который
способен адсорбировать фотоны.
Метенилтетрагидрофолатное производное выполняет роль светоулавливающей антенны для
квантов синего света (λ=300-500 нм).
Энергия возбужденного квантом света фолата передается на FADH– в активный центр фермента.
Возбужденный флавин отдает электрон пиримидиновому димеру, который в результате этого превращается в нестабильный свободный радикал, распадающийся с образованием двух свободных пиримидиновых оснований.
Слайд 15
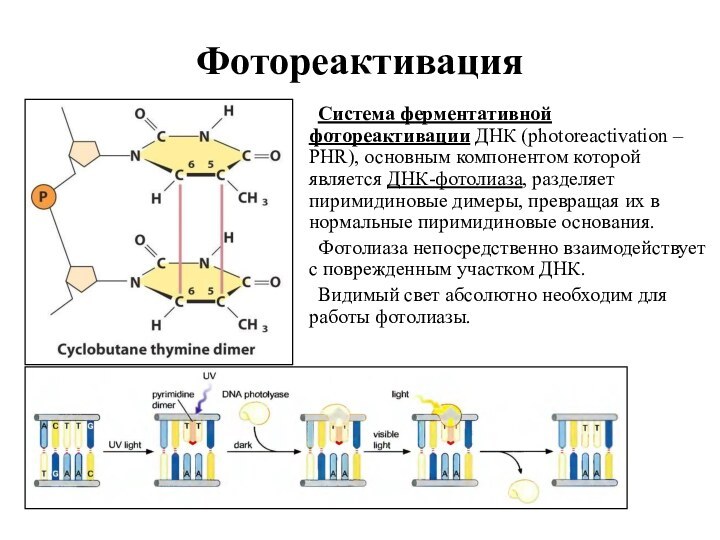
Фотореактивация
Система ферментативной фотореактивации ДНК (photoreactivation – PHR), основным
компонентом которой является ДНК-фотолиаза, разделяет пиримидиновые димеры, превращая их
в нормальные пиримидиновые основания.
Фотолиаза непосредственно взаимодействует с поврежденным участком ДНК.
Видимый свет абсолютно необходим для работы фотолиазы.
Слайд 16
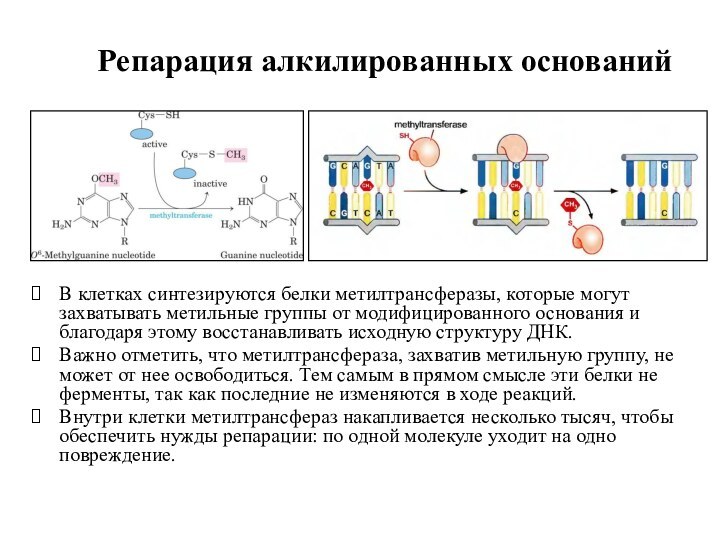
Репарация алкилированных оснований
В клетках синтезируются белки метилтрансферазы, которые
могут захватывать метильные группы от модифицированного основания и благодаря
этому восстанавливать исходную структуру ДНК.
Важно отметить, что метилтрансфераза, захватив метильную группу, не может от нее освободиться. Тем самым в прямом смысле эти белки не ферменты, так как последние не изменяются в ходе реакций.
Внутри клетки метилтрансфераз накапливается несколько тысяч, чтобы обеспечить нужды репарации: по одной молекуле уходит на одно повреждение.
Слайд 17
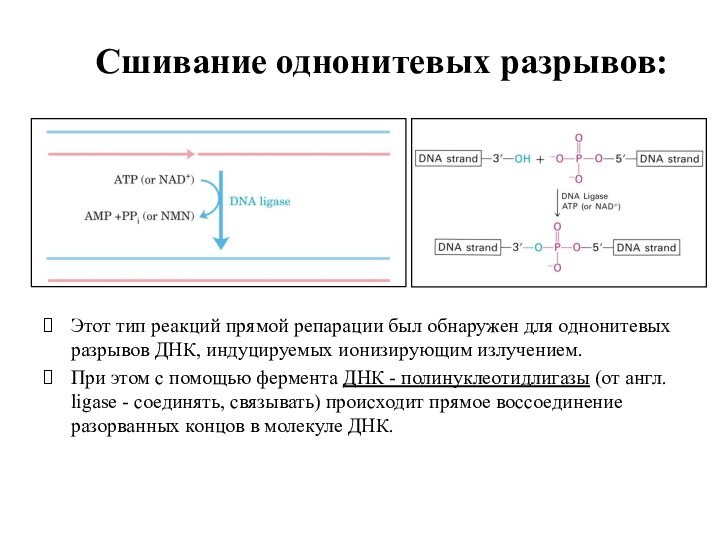
Сшивание однонитевых разрывов:
Этот тип реакций прямой репарации был
обнаружен для однонитевых разрывов ДНК, индуцируемых ионизирующим излучением.
При
этом с помощью фермента ДНК - полинуклеотидлигазы (от англ. ligase - соединять, связывать) происходит прямое воссоединение разорванных концов в молекуле ДНК.
Слайд 18
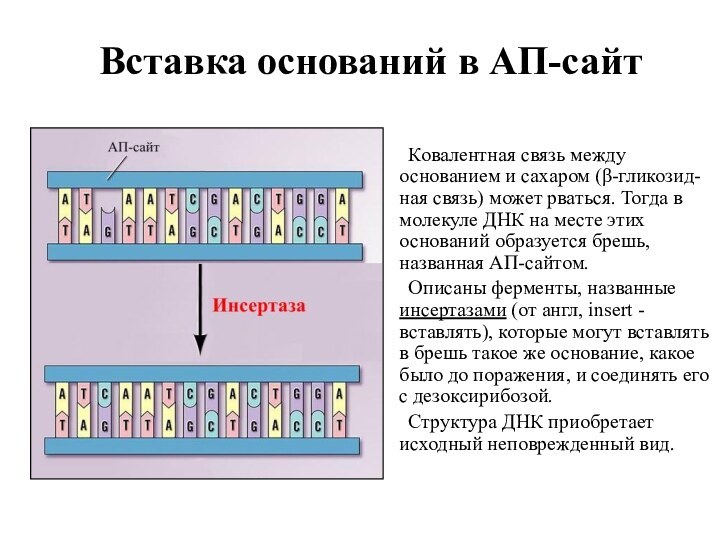
Вставка оснований в АП-сайт
Ковалентная связь между основанием и
сахаром (β-гликозид-ная связь) может рваться. Тогда в молекуле ДНК
на месте этих оснований образуется брешь, названная АП-сайтом.
Описаны ферменты, названные инсертазами (от англ, insert - вставлять), которые могут вставлять в брешь такое же основание, какое было до поражения, и соединять его с дезоксирибозой.
Структура ДНК приобретает исходный неповрежденный вид.
Слайд 19
Эксцизионная репарация ДНК путем удаления поврежденных азотистых оснований
(BER)
Слайд 20
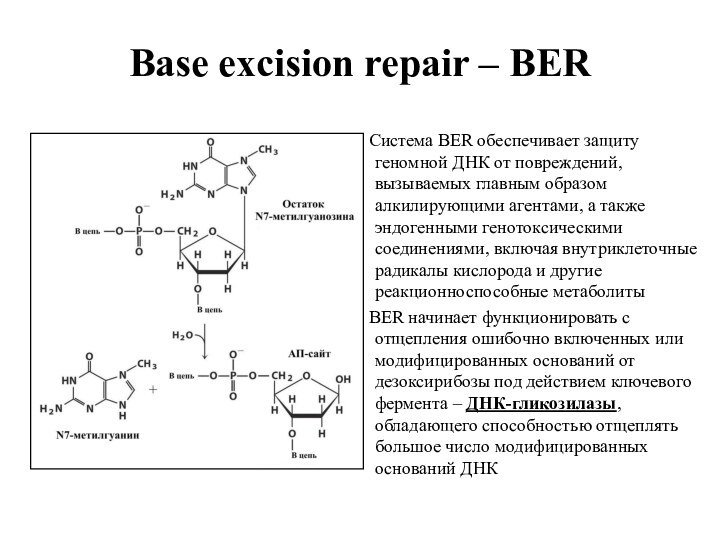
Base excision repair – BER
Система BER обеспечивает
защиту геномной ДНК от повреждений, вызываемых главным образом алкилирующими
агентами, а также эндогенными генотоксическими соединениями, включая внутриклеточные радикалы кислорода и другие реакционноспособные метаболиты
BER начинает функционировать с отщепления ошибочно включенных или модифицированных оснований от дезоксирибозы под действием ключевого фермента – ДНК-гликозилазы, обладающего способностью отщеплять большое число модифицированных оснований ДНК
Слайд 21
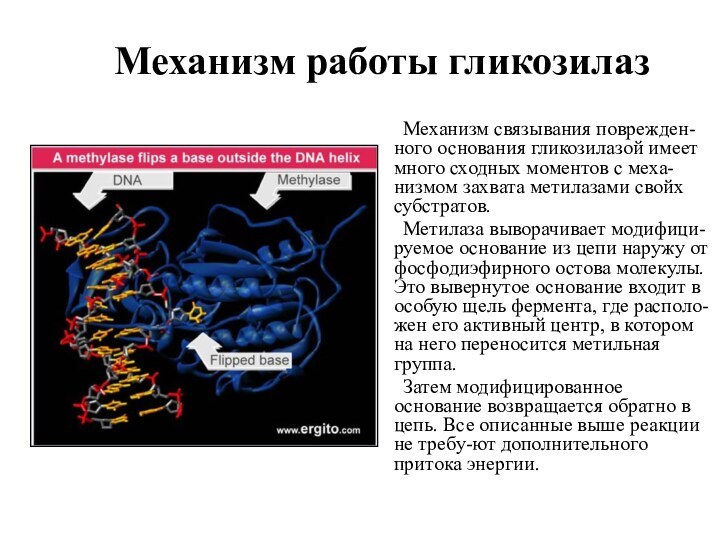
Механизм работы гликозилаз
Механизм связывания поврежден-ного основания гликозилазой имеет
много сходных моментов с меха-низмом захвата метилазами свойх субстратов.
Метилаза выворачивает модифици-руемое основание из цепи наружу от фосфодиэфирного остова молекулы. Это вывернутое основание входит в особую щель фермента, где располо-жен его активный центр, в котором на него переносится метильная группа.
Затем модифицированное основание возвращается обратно в цепь. Все описанные выше реакции не требу-ют дополнительного притока энергии.
Слайд 22
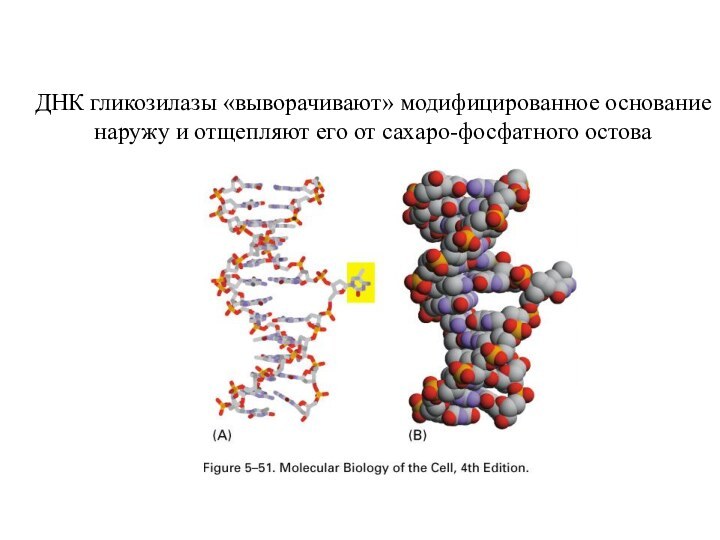
ДНК гликозилазы «выворачивают» модифицированное основание
наружу и отщепляют
его от сахаро-фосфатного остова
Слайд 23
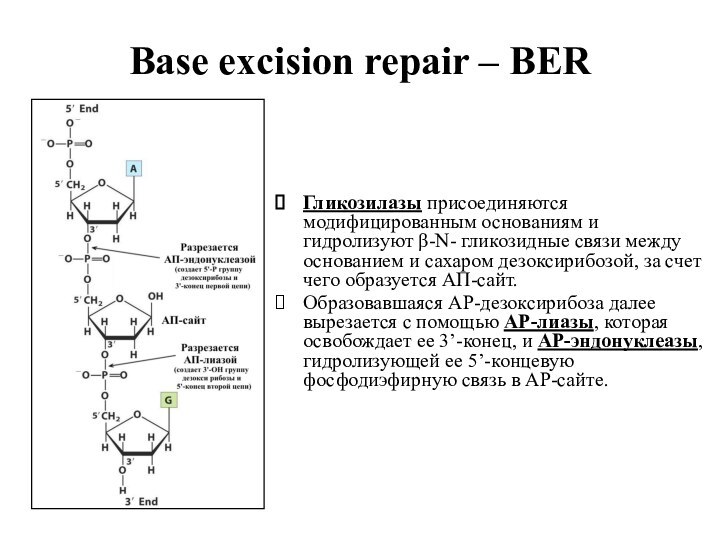
Base excision repair – BER
Гликозилазы присоединяются модифицированным основаниям
и гидролизуют β-N- гликозидные связи между основанием и сахаром
дезоксирибозой, за счет чего образуется АП-сайт.
Образовавшаяся АР-дезоксирибоза далее вырезается с помощью АР-лиазы, которая освобождает ее 3’-конец, и АР-эндонуклеазы, гидролизующей ее 5’-концевую фосфодиэфирную связь в АР-сайте.
Слайд 24
Base excision repair – BER
Появившаяся брешь в одной
цепи ДНК размером в один нуклеотид застраивается с участием
фермента ДНК - полимеразы I. Она вставляет в брешь комплементарный ему нуклеотид, присоединяя его к свободному З‘ОН-концу.
Для соединения одноцепочечного разрыва в фосфодиэфирном остове вступает в действие еще один фермент — ДНК-лигаза.
Слайд 25
Эксцизионная репарация ДНК путем удаления нуклеотидов (NER)
Слайд 26
Nucleotide excision repair – NER
Процесс NER условно
можно разделить на четыре этапа:
Распознавание поврежденного участка ДНК;
Двойное
надрезание (инцизия) цепи ДНК по обеим сторонам поврежденного участка и его удаление (эксцизия);
Заполнение бреши в процессе репаративного синтеза;
Лигирование оставшегося одноцепочечного разрыва ДНК.
Если в системе BER происходит удаление отдельных поврежденных азотистых оснований ДНК путем разрыва соответствующих N-гликозид-ных связей между азотистыми основаниями и остатками дезоксирибозы, то в системе NER поврежденные азотистые основания вырезаются в составе олигонуклеотидов.
Слайд 27
Nucleotide excision repair – NER
В отличии от BER,
субстратами системы NER являются не только поврежденные (модифицированные) основания,
но и одиночные ошибочно спаренные нуклеотиды, а также петли длиной в 1–3 нуклеотида.
Но в отличие от системы MMR, удаляющей неправильно спаренные основания, NER не может идентифицировать, нуклеотид какой цепи ДНК оказывается правильным. В результате происходит вырезание неспаренных нуклеотидов из любой цепи случайным образом.
Главными участниками NER в клетках Е. соli (но не у человека) является мультиферментный комплекс, содержащий эндонуклеазы, кодируемые тремя генами: uvrА, uvrВ и uvrC (названия генов даны по первым буквам слов ultra violet repair).
Комплекс получил название "эксинуклеаза".
Слайд 28
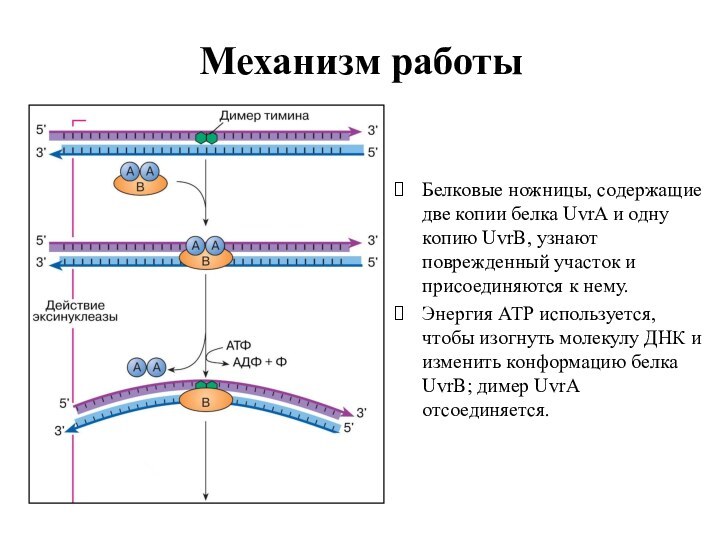
Механизм работы
Белковые ножницы, содержащие две копии белка UvrA
и одну копию UvrB, узнают поврежденный участок и присоединяются
к нему.
Энергия АТР используется, чтобы изогнуть молекулу ДНК и изменить конформацию белка UvrB; димер UvrA отсоединяется.
Слайд 29
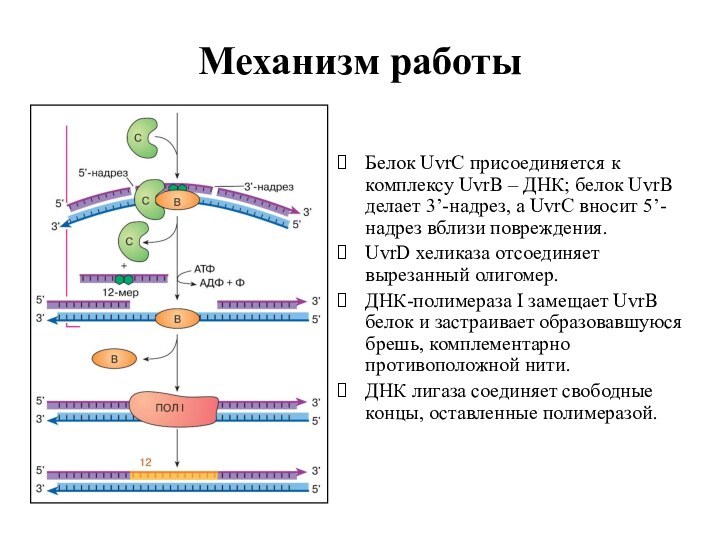
Механизм работы
Белок UvrC присоединяется к комплексу UvrВ –
ДНК; белок UvrВ делает 3’-надрез, а UvrC вносит 5’-надрез
вблизи повреждения.
UvrD хеликаза отсоединяет вырезанный олигомер.
ДНК-полимераза I замещает UvrВ белок и застраивает образовавшуюся брешь, комплементарно противоположной нити.
ДНК лигаза соединяет свободные концы, оставленные полимеразой.
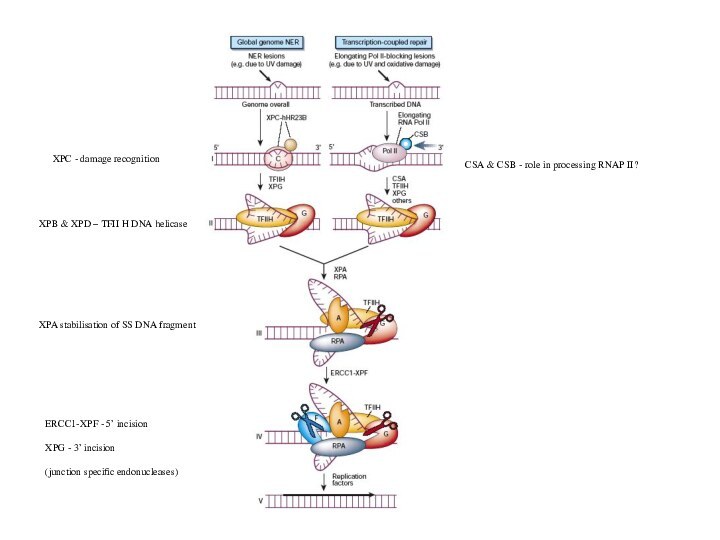
Слайд 30
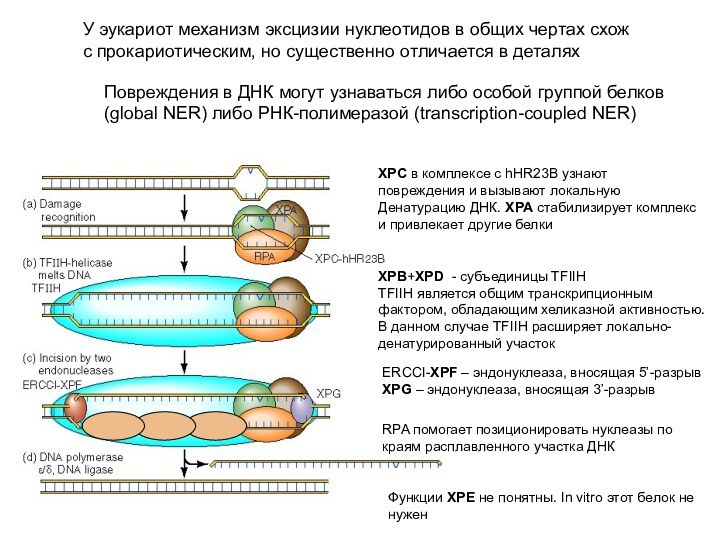
У эукариот механизм эксцизии нуклеотидов в общих чертах
схож
с прокариотическим, но существенно отличается в деталях
Повреждения в ДНК могут узнаваться либо особой группой белков
(global NER) либо РНК-полимеразой (transcription-coupled NER)
XPC в комплексе с hHR23B узнают
повреждения и вызывают локальную
Денатурацию ДНК. XPA стабилизирует комплекс
и привлекает другие белки
XPB+XPD - субъединицы TFIIH
TFIIH является общим транскрипционным
фактором, обладающим хеликазной активностью.
В данном случае TFIIH расширяет локально-
денатурированный участок
ERCCI-XPF – эндонуклеаза, вносящая 5’-разрыв
XPG – эндонуклеаза, вносящая 3’-разрыв
Функции XPE не понятны. In vitro этот белок не
нужен
Слайд 31
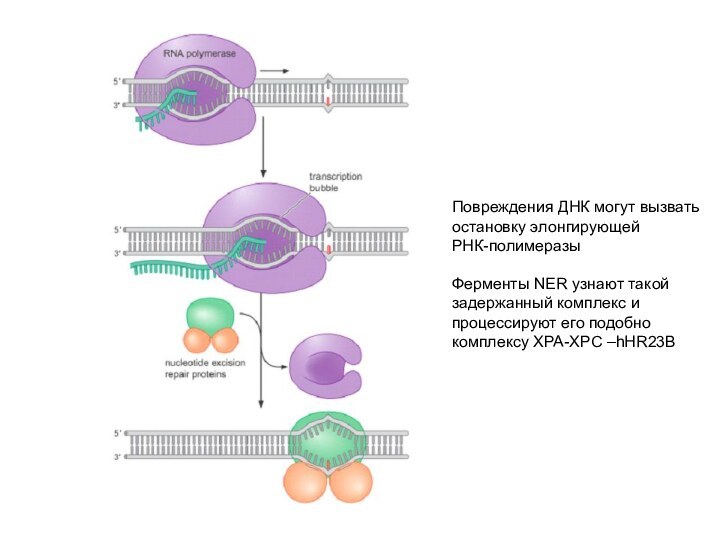
Повреждения ДНК могут вызвать
остановку элонгирующей
РНК-полимеразы
Ферменты NER узнают
такой
задержанный комплекс и
процессируют его подобно
комплексу XPA-XPC
–hHR23B
Слайд 32
XPB & XPD – TFII H DNA helicase
XPC
- damage recognition
XPA stabilisation of SS DNA fragment
ERCC1-XPF -
5’ incision
XPG - 3’ incision
(junction specific endonucleases)
CSA & CSB - role in processing RNAP II?
Слайд 33
Различия NER у про- и эукариот
Гены NER у
E. coli uvrA, uvrB и uvrC не обнаруживают гомологии с
соответствующими генами млекопитающих и дрожжей.
В универсальном механизме эксцизионной репарации как прокариоты, так и эукариоты гидролизуют 3–5-ю фосфодиэфирную связь с 3'-конца от повреждения. При этом прокариоты гидролизуют также 8-ю связь от 5’-конца измененного нуклеотида, тогда как у эукариотических организмов происходит одноцепочечный разрыв на расстоянии 21–25 нуклеотидов от повреждения со стороны его 5’-конца. Таким образом, прокариоты удаляют измененный нуклеотид в составе 12–13-членных олигомеров, тогда как эукариоты – в составе одноцепочечных фрагментов ДНК длиной в 27–29 нуклеотидов.
Млекопитающим требуется в среднем в четыре раза больше ферментов репарации, чем бактериям (эксинуклеаза состоит по крайней мере из 17 белков).
Подавление NER ведет к резкому увеличению числа мутаций хромосом, замедлению роста и развития организмов, и к другим нежелательным последствиям.
Слайд 34
Репарация ошибочно спаренных нуклеотидов (MMR)
Слайд 35
Mismatch repair - MMR
В отличие от NER, так
же удаляющей неправильно спаренные основания, MMR может идентифицировать нуклеотид
какой цепи ДНК является правильным (способна обнаруживать матрицу для репарации).
Субстратами системы MMR у E. coli, использующей белки MutHLS являются все некомплементарные пары оснований за исключением C–C, а также небольшие вставки в одну из цепей ДНК, длина которых не превышает четырех нуклеотидов.
Система MMR выполняет в клетке несколько важных функций:
Исправляет ошибки репликации ДНК, меняя ошибочно включенные нуклеотиды.
Обеспечивает гомологичную рекомбинацию между дивергировавшими последовательностями ДНК, посредством процессинга промежуточных продуктов рекомбинации.
Обеспечивает задержку клеточного цикла в ответ на повреждения ДНК.
Слайд 36
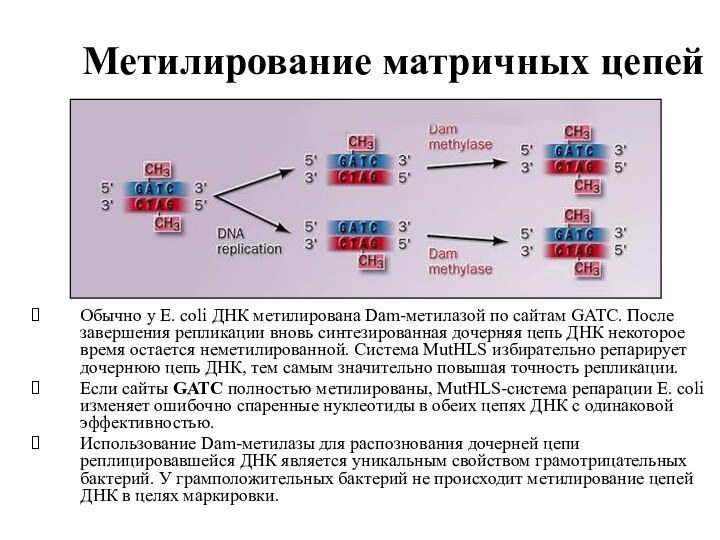
Метилирование матричных цепей
Обычно у E. coli ДНК метилирована Dam-метилазой
по сайтам GATC. После завершения репликации вновь синтезированная дочерняя
цепь ДНК некоторое время остается неметилированной. Система MutHLS избирательно репарирует дочернюю цепь ДНК, тем самым значительно повышая точность репликации.
Если сайты GATC полностью метилированы, MutHLS-система репарации E. coli изменяет ошибочно спаренные нуклеотиды в обеих цепях ДНК с одинаковой эффективностью.
Использование Dam-метилазы для распознования дочерней цепи реплицировавшейся ДНК является уникальным свойством грамотрицательных бактерий. У грамположительных бактерий не происходит метилирование цепей ДНК в целях маркировки.
Слайд 37
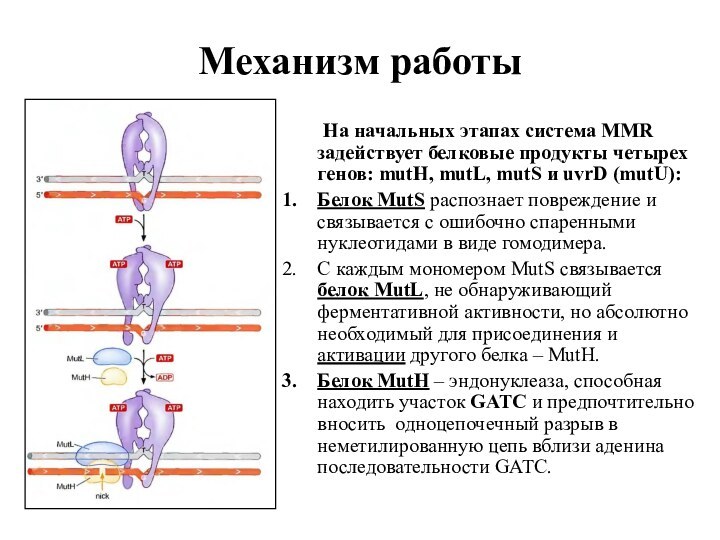
Механизм работы
На начальных этапах система MMR задействует белковые
продукты четырех генов: mutH, mutL, mutS и uvrD (mutU):
Белок
MutS распознает повреждение и связывается с ошибочно спаренными нуклеотидами в виде гомодимера.
С каждым мономером MutS связывается белок МutL, не обнаруживающий ферментативной активности, но абсолютно необходимый для присоединения и активации другого белка – МutH.
Белок MutH – эндонуклеаза, способная находить участок GATC и предпочтительно вносить одноцепочечный разрыв в неметилированную цепь вблизи аденина последовательности GATC.
Слайд 38
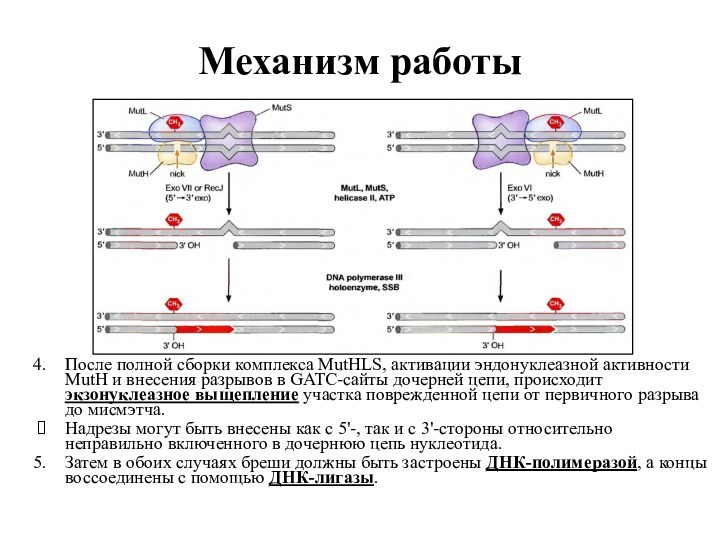
Механизм работы
После полной сборки комплекса MutHLS, активации эндонуклеазной
активности MutH и внесения разрывов в GATC-сайты дочерней цепи,
происходит экзонуклеазное выщепление участка поврежденной цепи от первичного разрыва до мисмэтча.
Надрезы могут быть внесены как с 5'-, так и с 3'-стороны относительно неправильно включенного в дочернюю цепь нуклеотида.
Затем в обоих случаях бреши должны быть застроены ДНК-полимеразой, а концы воссоединены с помощью ДНК-лигазы.
Слайд 39
Другие системы
У E. coli существуют два других специфических пути
репарации ошибочно спаренных нуклеотидов:
Система VSP (very short patch repair
pathway) репарирует некомплементарные пары G–T, заменяя их на G–C. Считается, что такие пары образуются в результате дезаминирования 5-метилцитозина в сайтах, где остатки С метилированы Dcm-метилазой.
MutY-система репарации специфически ликвидирует последствия окислительных повреждений гуанина. Если dGTP окисляется с образованием 8-оксо-dGTP и остается в составе ДНК неотрепарирован-ным, в следующем раунде репликации он спаривается с А, и в итоге может произойти трансверсия G–C→T–A. В этом случае белок MutY действует как ДНК-гликозилаза, удаляющая остаток A из некорректной пары, и как AP-лиаза, вносящая одноцепочечный разрыв по соседству с AP-сайтом.
Продолжение в презентации 3.1
Слайд 40
Механизмы рекомбинации днк у эукариот.
Слайд 41
ГЕНЕТИЧЕСКАЯ РЕКОМБИНАЦИЯ – перераспределение материала между молекулами или
внутри молекулы ДНК, приводящее к появлению новых комбинаций генов.
ГОМОЛОГИЧНАЯ
или ОБЩАЯ Р, или КРОССИНГОВЕР
Здесь синапсис основан на спаривании цепей ДНК с комплементарными основаниями, для чего необходимо наличие протяженной гомологии между рекомбинирующими последовательностями. Чтобы обнажить комплементарные (однонитевые) участки для синапсиса, необходимы разрывы и определенная деградация цепей ДНК.
Слайд 42
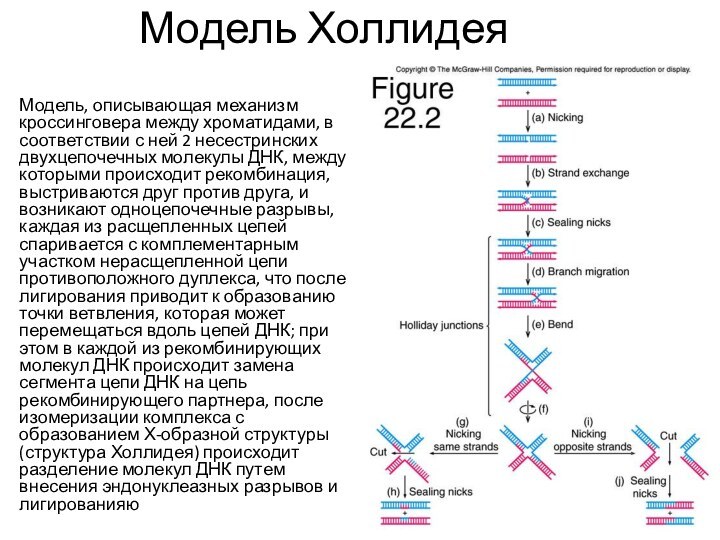
Модель Холлидея
Модель, описывающая механизм кроссинговера между хроматидами, в
соответствии с ней 2 несестринских двухцепочечных молекулы ДНК, между
которыми происходит рекомбинация, выстриваются друг против друга, и возникают одноцепочечные разрывы, каждая из расщепленных цепей спаривается с комплементарным участком нерасщепленной цепи противоположного дуплекса, что после лигирования приводит к образованию точки ветвления, которая может перемещаться вдоль цепей ДНК; при этом в каждой из рекомбинирующих молекул ДНК происходит замена сегмента цепи ДНК на цепь рекомбинирующего партнера, после изомеризации комплекса с образованием Х-образной структуры (структура Холлидея) происходит разделение молекул ДНК путем внесения эндонуклеазных разрывов и лигированияю
Слайд 43
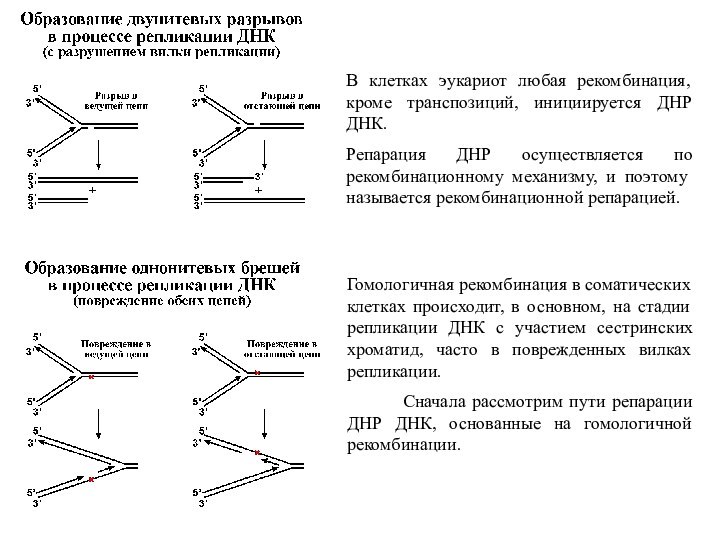
В клетках эукариот любая рекомбинация, кроме транспозиций, инициируется
ДНР ДНК.
Репарация ДНР осуществляется по рекомбинационному механизму, и поэтому
называется рекомбинационной репарацией.
Гомологичная рекомбинация в соматических клетках происходит, в основном, на стадии репликации ДНК с участием сестринских хроматид, часто в поврежденных вилках репликации.
Сначала рассмотрим пути репарации ДНР ДНК, основанные на гомологичной рекомбинации.
Слайд 44
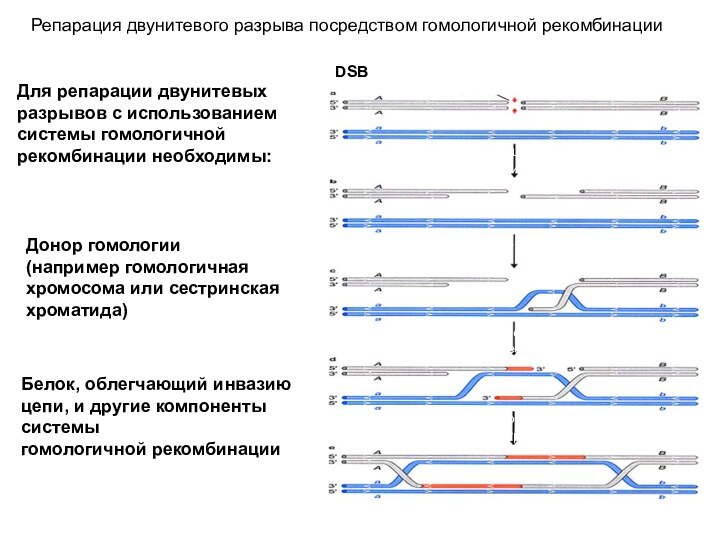
Репарация двунитевого разрыва посредством гомологичной рекомбинации
DSB
Процессирование концов экзонуклеазами;
Создание
выступающих 3’-концов
Инвазия 3’-конца первой цепи
Инвазия 3’-конца второй цепи
и репаративный
синтез
Миграция ветвей с последующим образованием
классической структуры Холидея
Донор гомологии
(например гомологичная хромосома или сестринская хроматида)
Белок, облегчающий инвазию цепи, и другие компоненты системы
гомологичной рекомбинации
Для репарации двунитевых разрывов с использованием
системы гомологичной рекомбинации необходимы:
Слайд 45
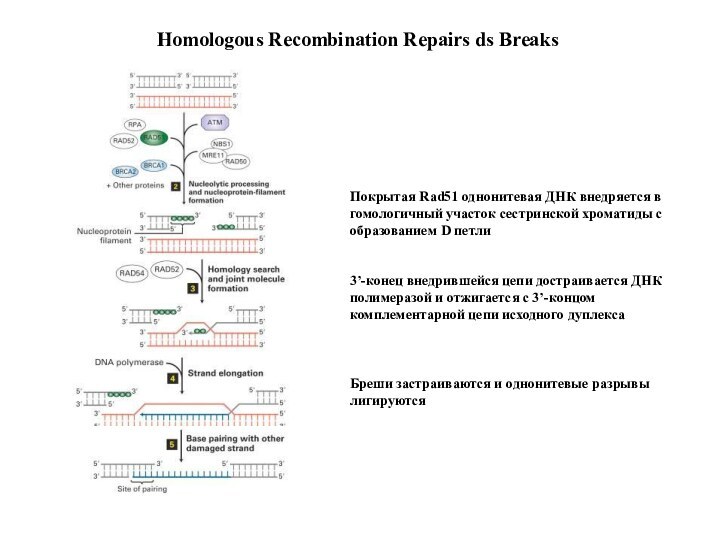
Покрытая Rad51 однонитевая ДНК внедряется в
гомологичный участок
сестринской хроматиды с
образованием D петли
3’-конец внедрившейся цепи
достраивается ДНК
полимеразой и отжигается с 3’-концом
комплементарной цепи исходного дуплекса
Бреши застраиваются и однонитевые разрывы
лигируются
Homologous Recombination Repairs ds Breaks
Слайд 46
К НЕЗАКОННОЙ РЕКОМБИНАЦИИ относят рекомбинационные процессы, происходящие либо
вообще без гомологии между рекомбинирующими участками ДНК, либо с
минимальной гомологией (2-5 п.н.).
У эукариотических организмов широко распространен особый механизм незаконной рекомбинации non-homologous end joining (NHEJ) – соединение негомологичных концов ДНК. Основное назначение этого типа рекомбинации – репарация ДНР ДНК.
Слайд 47
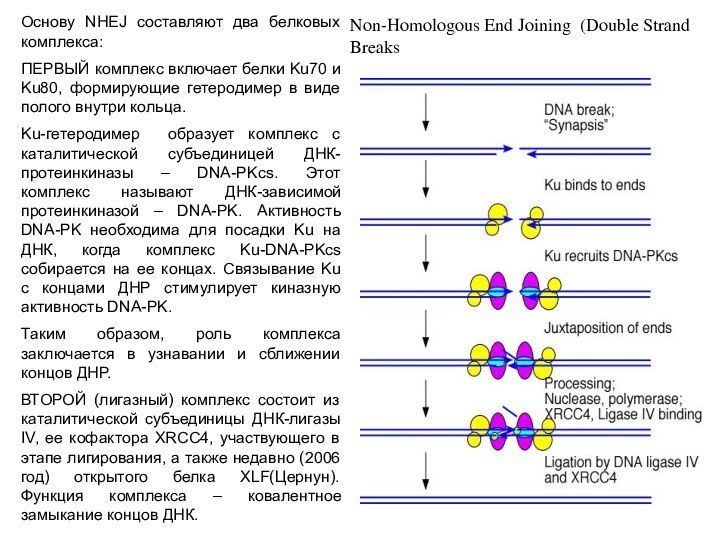
Основу NHEJ составляют два белковых комплекса:
ПЕРВЫЙ комплекс включает
белки Ku70 и Ku80, формирующие гетеродимер в виде полого
внутри кольца.
Ku-гетеродимер образует комплекс с каталитической субъединицей ДНК-протеинкиназы – DNA-PKcs. Этот комплекс называют ДНК-зависимой протеинкиназой – DNA-PK. Активность DNA-PK необходима для посадки Ku на ДНК, когда комплекс Ku-DNA-PKcs собирается на ее концах. Связывание Ku с концами ДНР стимулирует киназную активность DNA-PK.
Таким образом, роль комплекса заключается в узнавании и сближении концов ДНР.
ВТОРОЙ (лигазный) комплекс состоит из каталитической субъединицы ДНК-лигазы IV, ее кофактора XRCC4, участвующего в этапе лигирования, а также недавно (2006 год) открытого белка XLF(Цернун). Функция комплекса – ковалентное замыкание концов ДНК.
Non-Homologous End Joining (Double Strand Breaks
Слайд 48
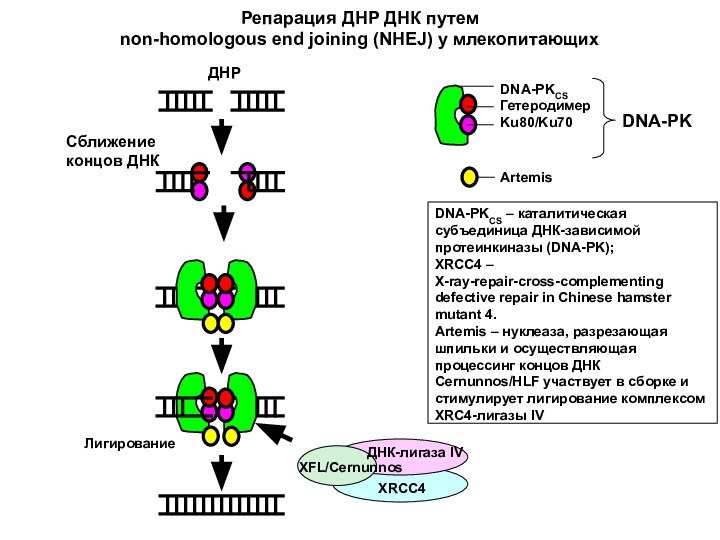
DNA-PKCS
Гетеродимер Ku80/Ku70
Artemis
Лигирование
DNA-PKCS – каталитическая субъединица ДНК-зависимой протеинкиназы (DNA-PK);
XRCC4
– X-ray-repair-cross-complementing defective repair in Chinese hamster mutant 4.
Artemis
– нуклеаза, разрезающая шпильки и осуществляющая процессинг концов ДНК
Cernunnos/HLF участвует в сборке и стимулирует лигирование комплексом XRC4-лигазы IV
Репарация ДНР ДНК путем
non-homologous end joining (NHEJ) у млекопитающих
Сближение концов ДНК
ДНР
DNA-PK
ДНК-лигаза IV
XRCC4
XFL/Cernunnos
Слайд 49
Транспозиции.
В геномах эукариот широко распространены особые генетические элементы,
способные перемещаться из одного участка генома в другой -
мобильные элементы.
Разнообразные рекомбинационные процессы, лежащие в основе перемещений мобильных элементов, объединены под общим названием «транспозиции».
Транспозиции осуществляются особыми белками, гены которых, в основном, локализованы в самих мобильных элементах. Гомология между мобильным элементом и последовательностью ДНК, в которую он перемещается (ДНК-мишень), как правило, отсутствует.
Встраивание элементов, как правило, происходит в случайные сайты ДНК-мишени.
Слайд 50
репликативная транспозиция
нерепликативная транспозиция
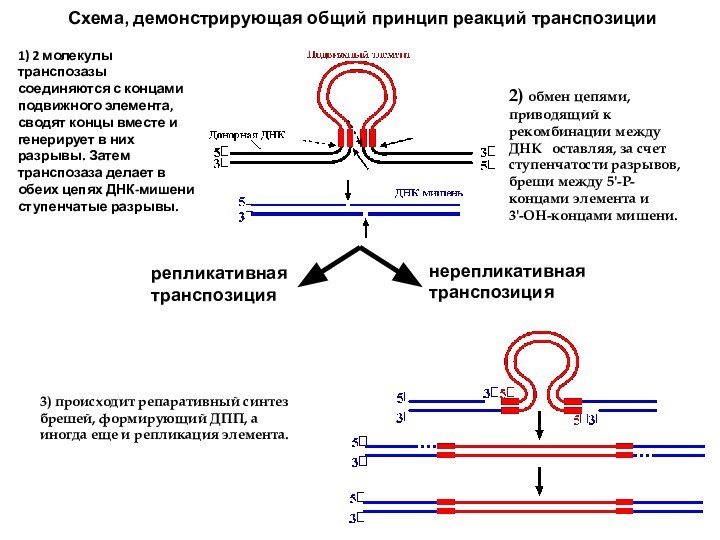
Схема, демонстрирующая общий принцип реакций транспозиции
1)
2 молекулы транспозазы соединяются с концами подвижного элемента, сводят
концы вместе и генерирует в них разрывы. Затем транспозаза делает в обеих цепях ДНК-мишени ступенчатые разрывы.
2) обмен цепями, приводящий к рекомбинации между ДНК оставляя, за счет ступенчатости разрывов, бреши между 5'-P-концами элемента и 3'-OH-концами мишени.
3) происходит репаративный синтез брешей, формирующий ДПП, а иногда еще и репликация элемента.
Слайд 51
Нерепликативная транспозиция заключается в вырезании элемента и его
перемещении в новое место.
При этом 2 молекулы транспозазы
связываются с концами мобильного элемента и делают разрывы одновременно в обеих цепях ДНК на концах мобильного элемента и в ДНК-мишени.
Далее транспозаза сводит вместе концы мобильного элемента и ДНК-мишень, 3-OH-концы элемента соединяются с 5-Р-концами ДНК-мишени, а между 3’-OH-концами ДНК-мишени и 5’-Р- концами элемента образуется брешь, которая заполняется с помощью репаративного синтеза ДНК, в результате чего на концах мобильного элемента возникают ДПП строго фиксированной длины.
В исходном репликоне остается ДНР. Будет ли он репарирован – зависит хозяйской клетки.
Нерепликативная транспозиция