- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Культивирование растительных и животных клеток
Содержание
- 2. Розділ 1Предмет, завдання та перспективи розвитку культивування тваринних і рослинних клітин
- 3. Тема 1. Предмет, завдання, історія розвитку напрямку
- 4. Культура клеток - это клетки многоклеточного организма,
- 5. Из историиТехника культуры ткани была впервые задумана
- 6. Основные направления использования клеточных культур Генетика Клонирование.
- 7. Эмбриология, развитие и дифференцировка клеток Изучение дифференцировки
- 8. Тема 2. Сучасний стан та перспективи розвитку
- 9. Клеточные культуры с каждым годом находят
- 10. Важная роль отводится клеточным культурам в биотехнологии
- 11. Преимущества использования клеточных культур Прижизненное наблюдение за
- 12. Использование клеточной культуры снимает множество этических проблем,
- 13. Розділ 2 Обладнання та поживні середовища для роботи з клітинними культурами
- 14. Тема 1. Обладнання, яке використовується для роботи
- 16. Одним из главных требований к жидким питательным
- 17. Процесс микрофильтрации осуществляется пропусканием жидкости через мембранные
- 18. Установка для стерилизующе й фильтрацииУстановка стерилизующей фильтрации УСФ-293-7В
- 19. Установка, рекомендуемая для стерилизующей фильтрации содержащей сыворотку
- 20. ультрафильтрация
- 21. Культуральная посудаОчень важным вопросом является выбор соответствующей
- 22. Культуральная посуда Основная часть ассортимента специальной культуральной
- 23. Посуда из стеклаХотя в последние годы широко
- 24. Пластиковая посудаНачиная с 1965 года, все большее
- 25. Культуральная посуда Планшет культуральный Флакон культуральный с вентилируемой крышкойПробирка культуральная со скошенным дномЧашка Петри культуральная
- 26. Культуральные флаконы (матрасы для клеточных культур) с
- 27. Помещения для работы с культурами клеток
- 28. Ламинарный бокс
- 29. Ламинарный бокс
- 30. Лабораторные термостаты
- 31. Лабораторные термостаты для культивирования клеток должны отвечать
- 32. СО2 инкубатор
- 33. Необходимость поддержания постоянной величины рН в питательной
- 34. Лабораторные встряхиватели
- 35. Большое значение в оснащении лаборатории, предназначенной для
- 36. АэраторыДля обеспечения аэрации культуральной среды – снабжения
- 37. Лабораторные ферментерыЭто комплексы приборов и аппаратов для
- 38. Лабораторные ферментерыБольшинство перемешиваемых и аэрируемых культур во
- 39. Автоклавируемые лабораторные ферментеры рабочим объемом от 0,5 до 10 литров
- 40. Установка для культивирования микроорганизмов
- 41. Методы массового культивирования микроскопических водорослейРеактор с системой световодовПлоскопараллельный реактор барботажно-камерного типа
- 42. Биореакторы для культур клетокКлетки животных во многом
- 43. Для предотвращения повреждения клеток пузырьками воздуха уменьшают
- 44. Клеточный ферментер (компания Bioengineering) Клеточный ферментер представляет
- 45. Биореакторы для культур клеток
- 46. Эрлифтный ферментер В этих ферментерах перемешивание осуществляется
- 48. Многие клетки млекопитающих растут только будучи прикрепленными
- 49. Биореакторы с взвешенной твердой фазой рекомендуются для
- 50. Для опорнозависимых клеток можно также использовать биореактор
- 52. Мембранный ферментерМембранный ферментер состоит из внутренней и
- 53. Тема 2. Поживні середовища для роботи з
- 54. Принципы составления питательных сред Все живые клетки
- 55. Питательные среды и условия культивированияПосле извлечения клеток
- 56. Питательная среда представляет собой раствор определенного состава,
- 57. Основу питательных сред составляют солевые растворы. Минеральные
- 58. Другим важным условием культивирования является осмотическое давление.
- 59. Стандартные среды для культур животных клеток Среды
- 60. Стандартные среды для культур животных клеток Среда
- 61. Нормальные, сохраняющие специфические функции клетки на стандартных
- 62. Белки сыворотки, прямо и специфически участвующие в
- 63. Гормоны стимулируют или подавляют рост в зависимости
- 64. Недостатки культивирования клеток в присутствии сывороткидля большинства
- 65. В настоящее время предпринимаются попытки создания и
- 66. Следовательно, оптимизация состава питательных сред для культур
- 68. Розділ 3Культивування рослинних клітин
- 69. Тема 1. Методи створення клітинних культур рослинІсторія
- 70. Методы создания клеточных культур растенийКультура клеток растений
- 71. Основные виды культуры клеток растений: Каллусная, суспензионная,
- 72. Каллусная культура картофеляЕсли фрагмент специализированных тканей растения
- 73. Цитоморфологические, физиолого-биохимические особенности каллусных культурПереход клетки in
- 74. Цитоморфологические, физиолого-биохимические особенности каллюсных культурЭнергетический метаболизм каллусных
- 75. Суспензионная культура клеток растенийДля получения клеточной суспензии
- 76. Суспензионная культура клеток растенийПримерно через две недели
- 77. Суспензионная культура клеток растенийКак и каллусные культуры,
- 78. Суспензионная культура клеток растенийРост клеток в суспензионных
- 79. Фазы кривой роста ККРI – лаг-фаза; II
- 80. Тема 2. Протопласти рослинних клітинСпособи виділення і
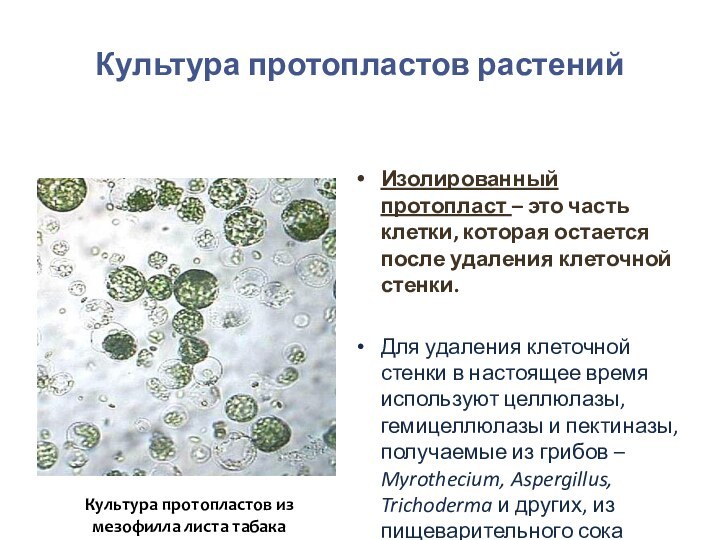
- 81. Культура протопластов растенийИзолированный протопласт – это часть
- 82. Культура протопластов растенийПротопласты выделяют из разных тканей
- 83. Протопласты растительных клеток как объекты биологического конструированияСпособы
- 84. Впервые выделение растительных протопластов было осуществлено в
- 85. Схема общей процедуры получения растительных протопластов
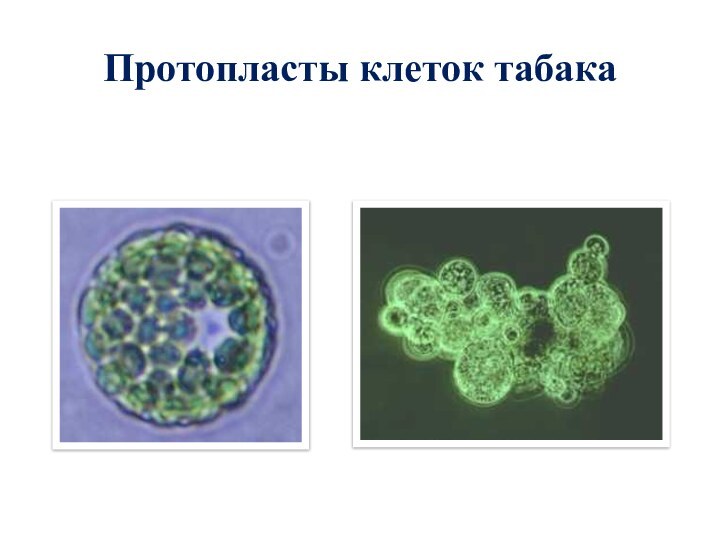
- 86. Протопласты клеток табака
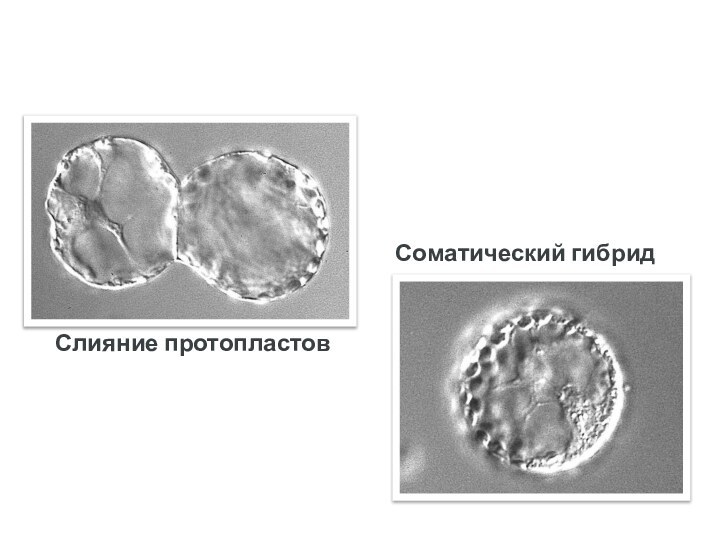
- 87. Слияние протопластовСоматический гибрид
- 88. Применение изолированных протопластовПротопласты являются уникальной моделью для
- 89. Розділ 4 Культивування тваринних клітин
- 90. Тема 1. Історія та проблеми розвитку культивування
- 91. Культивирование лимфоцитов периферической кровиРЕАГЕНТЫСреда Игла 199.Фитогемагглютинин (ФГА).Инактивированная
- 92. Перед началом работы необходимо проверить наличие всей
- 93. Культуру животных тканей применяют для изучения механизмов
- 94. История развития культивирования животных клетокИдея о том,
- 95. Основные культивируемые элементыВ настоящее время практически любые
- 96. Возможности и способы получения, особенности существования первичных
- 97. Возможности и способы получения, особенности существования первичных
- 98. Раковые клетки продолжают расти и после того,
- 99. Округленная форма трансформированных клеток (34 °С). Те
- 100. Тема 2. Відмінні особливості культивування тваринних клітинДинаміка
- 101. Динамика развития клеточных линийФазы роста культуры животных
- 102. Динамика развития клеточных линийПрикрепление клетки к субстратуЖивотные клетки в культуре в процессе деления
- 103. Существует 2 основных способа культивирования животных клеток:
- 104. Суспензионное культивированиеВ 1953 г. Оуенс с сотрудниками
- 105. Суспензионное культивирование дает 2-3-х кратную экономию питательных
- 106. Монослойные культурыБольшинство нетрансформированных клеток млекопитающих могут расти
- 107. Преимущества использования монослойных культур: Монослойные культуры могут
- 108. Недостатки использования монослойных культурнеобходимость большого пространства; возрастание
- 109. Разновидности монослойного культивированияКультивирование в плоских флаконах (матрацах).
- 110. Требования к микроносителям:Микроносители не должны быть:токсичными, не
- 111. Требования к микроносителям:Коммерческие классические микроносители имеют диаметр
- 112. Миобласты, прикрепленные к шарообразным микроносителям, в которых растут обозначенные зелёным взрослые клетки скелетных мышц
- 113. Мультиклеточные опухолевые сфероиды (аденокарцинома человека MCF-7) в альгинат-хитозановых микрокапсулах
- 114. Микроноситель с полимерной поверхностью, выполненной из природных полимеров клеточной стенки пыльцы
- 115. Поверхности клеток животных и поверхности традиционных культуральных
- 116. Системы культивирования клетокНепроточные культуры - тип культур,
- 117. Системы культивирования клеток2. Проточные культуры Обеспечивают истинные
- 119. Скачать презентацию
- 120. Похожие презентации

















































































































Слайд 2
Розділ 1
Предмет, завдання та перспективи розвитку культивування тваринних
і рослинних клітин
Слайд 3 Тема 1. Предмет, завдання, історія розвитку напрямку культивування
клітин
Історія формування уявлень про культивування клітин.
Зв'язок цитології, фізіології,
біотехнології з сучасними аспектами культивування клітин. Завдання процесу культивування рослинних та тваринних клітин. Класифікація процесів культивування.
Слайд 4
Культура клеток
- это клетки многоклеточного организма, живущие
и размножающиеся в искусственных условиях вне организма (in vitro).
Любая система, в которой клетки сохраняют жизнеспособность и способность размножаться in vitro более 24 часов, представляет собой культуру клеток.
Слайд 5
Из истории
Техника культуры ткани была впервые задумана и
разработана в начале двадцатого века [Harrison, 1907; Carel, 1912]
для изучения свойств животных клеток, свободных от системных влияний
Слайд 6
Основные направления использования клеточных культур
Генетика
Клонирование. Хранение
и слияние клеток. Получение и работа с мутантными клетками.
Иммунология
Гибридомная технология. Производство моноклональных антител.
Биотехнология
Культуры клеток используются как источник различных секретируемых веществ: гормонов, интерферона и т. д.
Вирусология
Единственно эффективный метод выращивания вирусов в клеточной культуре, наблюдение за клетками, пораженных вирусом, исследование явления клеточной трансформации.
Слайд 7
Эмбриология, развитие и дифференцировка клеток
Изучение дифференцировки клеток
in vitro. Поиск корреляции между внешним стимулом на клеточную
культуру и морфо-биохимическим ответом клеток.Токсикология и фармакология
Тестирование на клеточной культуре механизма действия различных веществ, которые могут быть использованы в качестве лекарственных препаратов, детергентов, косметических средств, инсектицидов, консервантов.
Биохимия и патобиохимия
Исследование биохимических превращений и патологических путей чрезвычайно эффективно с использованием клеточных культур.
Основные направления использования клеточных культур
Слайд 8 Тема 2. Сучасний стан та перспективи розвитку культивування
тваринних і рослинних клітин
Актуальність використання культур клітин в різних
областях біології, медицини, сільського господарства. Можливість їх використання в вирішенні ряду біологічних проблем.
Роль клітинних культур в біотехнології у виробництві біологічно активних речовин; використання їх в генетичній, медичній, фармакологічній практиці.
Слайд 9 Клеточные культуры с каждым годом находят все
большее применение в самых разнообразных областях биологии, медицины и
сельского хозяйства.Их используют при решении таких общебиологических проблем, как выяснение механизмов дифференцировки и пролиферации, взаимодействия клеток со средой, адаптации, старения, биологической подвижности, злокачественной трансформации и многих других.
Слайд 10 Важная роль отводится клеточным культурам в биотехнологии при
производстве вакцин и биологически активных веществ. Они являются исходным
материалом для создания клеток-продуцентов, используются в целях повышения продуктивности сельскохозяйственных животных и для выведения новых сортов растений.Культуры клеток применяются для диагностики и лечения наследственных заболеваний, в качестве тест-объектов при испытании новых фармакологических веществ, а также для сохранения генофонда исчезающих видов животных и растений.
Слайд 11
Преимущества использования клеточных культур
Прижизненное наблюдение за клетками,
их морфологическими и биохимическими особенностями различными методами, в том
числе с использованием световой микроскопии.Возможность оценки состояния клетки «прижизненно», а не «post faсtum», как в случае с опытами на животных.
Возможность изменения условий культивирования, что дает широкие возможности в оценке факторов, влияющих на клеточный метаболизм.
Оценка и получение результатов, при использованием небольшого количества клеточного материала, что снимает проблему использования большого количества животных.
Слайд 12 Использование клеточной культуры снимает множество этических проблем, связанных
как с использованием большого количества клинического материала, так и
при тестировании потенциально опасных и токсических веществ.Клеточная культура доступна для различных биохимических манипуляций, в том числе с ядами, гормонами, токсинами, радиоактивными соединениями и т.д.
При использовании клеточной культуры оценивается прямое воздействие исследуемого вещества, без опасения, что оно будет метаболизировано печенью или почками.
Становится возможным рассчитать точную концентрацию тестируемого вещества, вызываемого тот или иной эффект.
Преимущества использования клеточных культур
Слайд 14 Тема 1. Обладнання, яке використовується для роботи з
клітинними культурами
Прилади для дозування, розведення і пробовідбора.
Установки для
стерилізуючої фільтрації рідких поживних середовищ. Мікро- та ультрафільтрація поживних середовищ.
Боксові приміщення і ламінарні бокси.
Лабораторні термостати, спеціальні вимоги до них.
СО2-інкубатори і аератори.
Апарати для масового культивування клітин, що забезпечують примусове перемішування і аерацію поживних середовищ з поміщеними в них клітинними культурами.
Лабораторні струшувачі, значення для культивування клітин.
Лабораторні та промислові ферментери, призначення, типи, конструкція і області застосування.
Спеціальний культуральний посуд: флакони, колби, матраци, чашки Петрі, плати, пробірки, піпетки.
Слайд 16 Одним из главных требований к жидким питательным средам
для клеточных культур является их стерильность, достигаемая стерилизующей фильтрацией,
освобождающей питательные среды от примесных частиц, бактерий и коллоидов.Различают микро- и ультрафильтрацию сред.
При микрофильтрации из жидкости удаляются частицы примесей и бактерий размерами от 0,25 до 10 мкм.
Ультрафильтрация приводит к извлечению из раствора очень мелких частиц и коллоидов, а также молекул растворенных веществ с молекулярными массами от 1 тысячи до 1 миллиона.
Для стерилизующей фильтрации питательных сред чаще всего используются мембранные фильтры с диаметром 0,2-0,22 мкм. Для очистки питательных сред пригодны мембранные фильтры, производимые фирмами «Millipore», «Sartorius», «Shleiher-Shull» и др.
Стерилизующая фильтрация
Слайд 17 Процесс микрофильтрации осуществляется пропусканием жидкости через мембранные или
глубинные фильтры. Ряд недостатков, свойственных глубинным фильтрам, изготавливаемым из
ваты, стекловолокна, асбеста, фарфора и других материалов (например, возможность роста микроорганизмов в массе фильтра, поглощение значительных количеств фильтруемых жидкостей), делают предпочтительным использование при очистке питательных сред мембранных фильтров, которые имеют поры гарантированного размера и лишены перечисленных выше недостатков.Мембранные фильтры изготавливаются из различных полимеров, в том числе позволяющих стерилизацию (фторопласт, поливинилдендифторид, эфиры целлюлозы) и обеспечивающих химическую стойкость к компонентам питательных сред.
Стерилизующая фильтрация
Слайд 18
Установка для стерилизующе й фильтрации
Установка стерилизующей фильтрации УСФ-293-7
В общем
случае установка для стерилизующей фильтрации состоит из системы создания
избыточного давления на фильтруемую жидкость, стерильного держателя фильтра, фильтрующей мембраны, трубопроводов и сосудов для размещения фильтруемой жидкости и фильтрата.Для обеспечения движения жидкости через фильтр к ней необходимо приложить определенное давление извне. Подобное давление может быть создано центробежными силами, вакуумом на выходе установки, но чаще для этой цели используется подача нейтрального газа (например, азота) под определенным давлением в сосуд со средой, подлежащей очистке. Величина избыточного давления зависит от размера пор и площади мембраны.
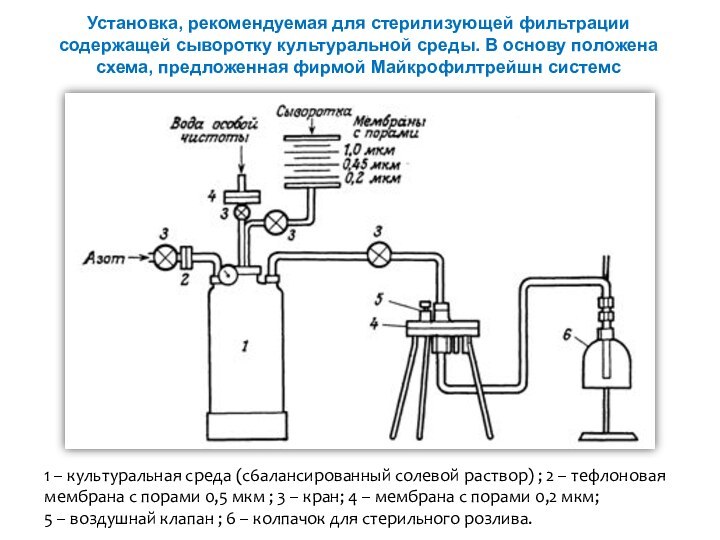
Слайд 19 Установка, рекомендуемая для стерилизующей фильтрации содержащей сыворотку культуральной
среды. В основу положена схема, предложенная фирмой Майкрофилтрейшн системс
1 – культуральная среда (с6алансированный солевой раствор) ; 2 – тефлоновая мембрана с порами 0,5 мкм ; 3 – кран; 4 – мембрана с порами 0,2 мкм; 5 – воздушнай клапан ; 6 – колпачок для стерильного розлива.
Слайд 21
Культуральная посуда
Очень важным вопросом является выбор соответствующей лабораторной
посуды для культивирования клеточных линий. Необходимо учитывать ряд факторов,
таких как: растут ли клетки в суспензии или монослое, каков будет масштаб эксперимента, допустим ли газовый обмен с атмосферой или флаконы должны быть закупорены.
Слайд 22
Культуральная посуда
Основная часть ассортимента специальной культуральной
посуды предназначена для роста клеток в монослое, что определяет
особые требования к свойствам поверхности и материала изделий как из стекла, так и из пластика. Для культивирования клеток обычно используют флаконы, колбы, матрасы, чашки Петри, платы, роллерные сосуды, пробирки, пипетки и т. д.
Слайд 23
Посуда из стекла
Хотя в последние годы широко применяется
пластиковая посуда одноразового использования, посуда из стекла не утратила
своего значения, благодаря ряду бесспорных преимуществ: хорошие адгезионные свойства поверхности, способствующие прикреплению клеток; многократность использования; биологическая инертность стекла ряда составов; термостойкость и другие. Кроме того, в экспериментах с контролируемым уровнем кислорода необходимо пользоваться именно стеклянной посудой, т. к. в пластике кислород может растворяться. Помимо этого из пластика могут экстрагироваться водо-растворимые органические соединения.Для стеклянной лабораторной и культуральной посуды на практике в основном применяются два типа составов – многощелочное и малощелочное боросиликатное стекло типа «Пирекс». Щелочесодержащие силикатные стекла имеют недостаточную термостойкость и химическую устойчивость к воде, кислотам и щелочам. Алюмоборосиликатные малощелочные стекла типа «Пирекс» характеризуются высокой устойчивостью к воде, устойчивостью к щелочным растворам и ко всем кислотам за исключением плавиковой (фтористоводородной) и горячей фосфорной. Кроме того стекла типа «Пирекс» обладают хорошими оптическими свойствами.
Существует также группа макропористых стекол, которые не используются для изготовления посуды, но применяются при культивировании клеток в качестве микроносителей.
Однако успех в эксперименте обеспечивается не только качеством стекла, но и степенью подготовки лабораторной посуды. Посуда для культивирования должна быть чистой физически, химически и бактериологически.
Культуральная посуда
Слайд 24
Пластиковая посуда
Начиная с 1965 года, все большее применение
в лабораторной практике находит пластиковая посуда одноразового использования. При
работе с культурами клеток пластиковая посуда в отдельных случаях более пригодна из-за характерных особенностей некоторых клеточных линий. Такая посуда проста в использовании, т. к. выпускается в стерильном, готовом к работе виде. Стерилизация производится в процессе изготовления физическими (облучение УФ светом или гамма лучами) или химическими (газы – окись этилена, жидкости – этиловый спирт, раствор пергидроля) способами. Пластиковая посуда производится в двух модификациях – для культивирования микроорганизмов и для культивирования клеток. Такое разделение вызвано тем, что культивируемые клетки (речь идет о монослойном культивировании) в отличие от бактериальных клеток находятся в непосредственном контакте с поверхностью сосуда, которая является для них субстратом. Клетки оседают на этой поверхности, прикрепляются и распластываются. Для улучшения адгезионных свойств поверхности из полистирола ее подвергают специальной обработке, в то время как биологическая посуда не обрабатывается.Таким образом, одним из первых условий успешного культивирования клеток является хороший субстрат, т.е. посуда, обеспечивающая максимальную адгезию, распластывание и, следовательно, рост.
Культуральная посуда
Слайд 25
Культуральная посуда
Планшет культуральный
Флакон культуральный с вентилируемой
крышкой
Пробирка культуральная со скошенным дном
Чашка Петри культуральная
Слайд 26 Культуральные флаконы (матрасы для клеточных культур) с отслаивающейся
боковой поверхностью
Культуральные флаконы с поддающейся повторной герметизации боковой крышечкой
Слайд 27
Помещения для работы с культурами клеток
Все
манипуляции при работе с клеточными культурами, проводится в боксовых
помещениях или в ламинар-боксах.Боксовое помещение - изолированная комната с несорбирующими пыль моющимися покрытиями, имеющую предбоксник и обеспеченную необходимым общим и специальным освещением, системами приточной и вытяжной вентиляции, холодным и горячим водоснабжением, а также подводами газов и сжатого воздуха.
Альтернативой боксовым помещениям, требующей меньших затрат на оборудование, являются ламинар-боксы, или стерильные рабочие места. В этом случае в любом помещении может быть создан локальный стерильный объем, необходимый для работы и создающий биологическую защиту пользователей.
Слайд 31 Лабораторные термостаты для культивирования клеток должны отвечать ряду
специальных требований: 1) обеспечивать высокую стабильность поддержания заданной температуры,
2) создавать минимальный градиент температуры по полезному объему, 3) обладать системой быстрого восстановления температуры после кратковременного открывания полезного объема, 4) внутренний объем должен изготавливаться из биологически пассивных материалов, т. е. не влияющих на жизнедеятельность клеток и стойких к воздействию компонентов питательных сред. Материалы и покрытия внутренних и наружных частей конструкции термостата должны позволять деконтаминацию водными растворами спирта ректификата и стерилизацию УФ облучением.По своей конструкции лабораторные термостаты подразделяются на жидкостные и воздушные. В жидкостных термостатах полезный объем окружен емкостью, наполненной дистиллированной водой, которую собственно и нагревают. Воздушные термостаты имеют полезный объем, непосредственно контактирующий с электронагревательными элементами. Жидкостные термостаты обеспечивают малые значения температурного градиента в камере, но имеют очень большую тепловую инерцию и поэтому длительное время вхождения в рабочий режим. Усовершенствованные формы воздушных термостатов, ранее уступавших жидкостным по ряду основных параметров, теперь составляют значительную часть серийно выпускаемых моделей.
Лабораторные термостаты
Слайд 33 Необходимость поддержания постоянной величины рН в питательной среде
и ее минимального испарения в период инкубации клеток привела
к разработке специальных приборов, аналогичных описанным выше термостатам. Главным отличием является наличие систем создания и поддержания определенного состава газовой среды в полезном объеме и высокой относительной влажности в нем. Это так называемые углекислотные инкубаторы, выпускаемые фирмами «Heraues», «Hotpack», «Flow».Газовая среда в камерах СО2 - инкубатора содержит повышенную концентрацию кислорода и углекислого газа, а в большинстве случаев только углекислого газа. Величина концентрации задается по условиям культивирования и поддерживается автоматически. В автоматических СО2 - инкубаторах заданный состав газовой среды поддерживается дозированным поступлением нужного газа в поток очищенного от пыли внешнего воздуха, подаваемого во внутренний объем прибора. Другой разновидностью инкубаторов являются так называемые газо-проточные инкубаторы типа ГПИ-1, где подача нужных газов производится непрерывно, а точное процентное содержание достигается изменением скорости протока.
СО2 инкубатор
Слайд 35 Большое значение в оснащении лаборатории, предназначенной для культивирования
клеток, имеют приборы, обеспечивающие принудительное перемешивание питательных сред с
помещенными в них клеточными культурами, обеспечивая лучший газообмен, и, тем самым, повышая эффективность культивирования. Большинство моделей встряхивателей позволяет перемешивание в одном режиме – вращательном или возвратно-поступательном. Хотя наиболее современные модели (фирма «Infors») являются универсальными, т. е. работают в разных режимах перемешивания. Роллерные установки – аппараты, позволяющие успешно применять один из общепринятых методов культивирования клеток – выращивание их в цилиндрических сосудах из боросиликатного стекла с небольшим количеством питательной среды, вращающихся в горизонтальном положении со скоростью 8 оборотов/мин, обеспечивая постоянное перемешивание питательной среды и интенсивный рост клеток. Для повышения эффективности массового культивирования установки обеспечены системой, дающей возможность заменять питательную среду и удалять супернатант без остановки вращения. Для этого сосуды снабжаются специальными перфузионными пробками, в которых центральная часть вращается независимо от периферийной. В эту часть пробки вводятся трубки для смены питательной среды, удаления супернатанта и введения инокулята. В состав данной системы также входят перистальтические насосы и блок автоматики, регулирующий их работу.Лабораторные встряхиватели
Слайд 36
Аэраторы
Для обеспечения аэрации культуральной среды – снабжения кислородом
- используют воздух, воздух, обогащенный кислородом, реже чистый кислород.
Процессы, протекающие без доступа кислорода (анаэробные), зависят от газообразных субстратов и требуют отвода газообразных продуктов жизнедеятельности.
Аэраторы – основной пример функционирующих систем газоснабжения и газоотвода.
Слайд 37
Лабораторные ферментеры
Это комплексы приборов и аппаратов для массового
суспензионного или глубинного культивирования клеточных и бактериальных культур. В
лабораторной практике ферментеры применяются для ведения научно-исследовательских работ или отработки технологии массового культивирования (пилотные биореакторы).В общем случае ферментер состоит из культивационного сосуда, насосов и соединительных трубопроводов (для подачи питательной среды, газов, инокулята и отбора продукта), измерительных приборов и регуляторов, управляющих температурой среды в сосуде, ее рН, окислительно-восстановительным потенциалом и другими параметрами.
В лабораторной практике наиболее часто применяются ферментеры с емкостью сосудов от 1 до 20 л, для отработки технологий – от 30 до 400 л. Во всех случаях питательной средой заполняется не более 75 % объема сосуда.
Части ферментеров, контактирующие с питательной средой (сосуды, соединительные трубопроводы, насосы и др.), изготавливаются из биологически пассивных, химически стойких материалов, позволяющих производить стерилизацию насыщенным водяным паром (качественная нержавеющая сталь, фторопласт, боросиликатное стекло, силиконовая резина).
Сосуды ферментеров имеют цилиндрическую (реже коническую) форму. В них размещены датчики температуры, рН, кислорода, а также система для аэрации питательной среды, производимой барботированием газов (подача газов снизу через барботер) через питательную среду или сочетанием продувки газов с механическим перемешиванием среды. При использовании механических мешалок их соединение с приводным двигателем производится при помощи магнитных муфт, что снижает риск загрязнения питательной среды. Помимо механического и пневматического перемешивания используются также системы циркуляционного (гидродинамического) перемешивания направленным током жидкости по замкнутому контуру при помощи насосов.
Слайд 38
Лабораторные ферментеры
Большинство перемешиваемых и аэрируемых культур во время
роста образуют довольно много пены. Образование на поверхности среды
культивирования слоя из пузырьков связано с наличием в среде поверхностно-активных веществ (ПАВ), к числу которых относятся продукты распада жиров – мыла, а также белки. ПАВ включают как полярные ионные, так и неполярные группировки. Заряженные группы имеют сродство к водной фазе, а нейтральные выталкиваются в воздушную фазу, где, встраиваясь в стенки газовых пузырьков, увеличивают время их жизни. Умеренное пенообразование способствует росту многих аэробных микроорганизмов (пенный слой – кислородный коктейль). Особое внимание уделяется борьбе с избыточным пенообразованием, так как, если не препятствовать этому, пена смачивает фильтры для стерилизации воздуха, что приводит к контаминации культуры посторонней микрофлорой, уменьшению полезного объема биореактора, а также выходу пены наружу. Контроль пенообразования осуществляется путем введения в сосуд специального датчика. Для борьбы с избыточным пенообразованием используется механическое и химическое пеногашение. При механическом пеногашении лопасти пеногасителя размещаются на валу мешалки. При химическом пеногашении в крышке сосуда предусматривается специальный ввод для реагента гашения. Химические пеногасители более дешевы, их используют время от времени при необходимости подавления пенообразования. Однако при добавлении этих веществ может изменяться состав питательной среды. Пеногасящие вещества растительного (кукурузное, касторовое, соевое, подсолнечное масло, масло из семян хлопчатника и другие) и животного (свиной, говяжий, бараний, китовый и другие жиры) происхождения могут служить микроорганизмам источником углерода и энергии и, следовательно, стимулировать их активное развитие. Однако известны случаи, когда природные пеногасители оказывали отрицательное действие на метаболизм клетки. А такие неметаболизируемые пеногасители, как силиконы, в высокой концентрации токсичны. Поэтому пеногасители, являющиеся поверхностно-активными веществами, следует использовать только в очень низких концентрациях и только после тщательной проверки. Пеногасители добавляют непосредственно в среду перед стерилизацией или в ферментер через специальный ввод.
Слайд 41
Методы массового культивирования микроскопических водорослей
Реактор с системой световодов
Плоскопараллельный
реактор барботажно-камерного типа
Слайд 42
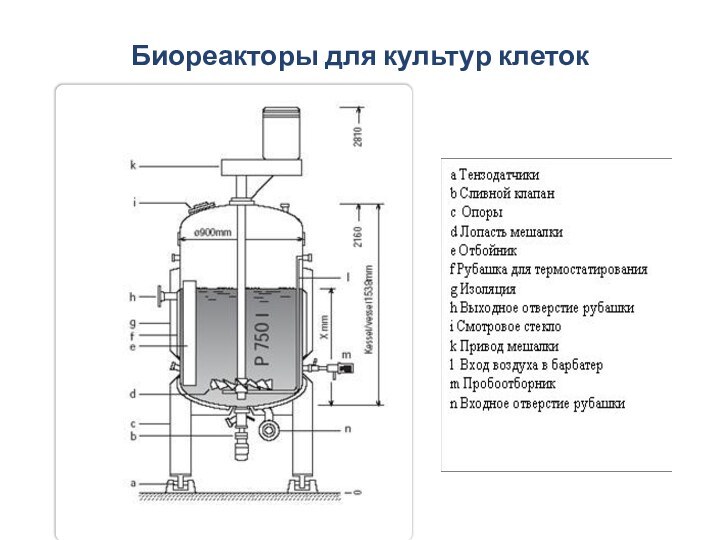
Биореакторы для культур клеток
Клетки животных во многом отличаются
от микробных и растительных клеток, имеющих клеточные стенки: они
медленнее растут, у них большая чувствительность к ранению и пузырькам воздуха. Эти свойства клеток определяют выбор системы перемешивания и аэрации, которые не должны создавать стрессовых условий для культуры.Перемешивание должно быть гомогенным, чтобы избежать градиентов температуры и рН, повышенных концентраций субстрата и продуктов. При этом необходимо учитывать высокий уровень травматизма клеток. Обычно перемешивание осуществляется большими лопастными мешалками при низких скоростях. Также используют пневматическое (воздушное) перемешивание в эрлифтных реакторах или гидравлическое перемешивание с помощью внешних насосов в реакторах с взвешенной твердой фазой (fluidized bed reactors).
Слайд 43 Для предотвращения повреждения клеток пузырьками воздуха уменьшают объем
подаваемой газовой смеси, используют поверхностную продувку или аэрацию через
мембраны. При сокращении объема подаваемого газа необходимо увеличить в нем концентрацию кислорода. Оптимальное снабжение кислородом, азотом, и углекислым газом создается с помощью систем перемешивания газов.Выращивание животных клеток можно осуществлять в периодической (batch), периодической с подпиткой (fed- batch) или непрерывной (continuous) культуре.
Из-за низкой продуктивности, связанной с медленным ростом, для клеток животных предпочтителен непрерывный процесс культивирования с удержанием клеток (перфузионная система). Это приводит к большей плотности культуры клеток и большему контакту с ними среды, что увеличивает продуктивность. Для удержания биомассы и предотвращения ее выноса с культуральной жидкостью используют различные системы фильтрации, например, роторные или вращающиеся фильтры.
Слайд 44
Клеточный ферментер (компания Bioengineering)
Клеточный ферментер представляет собой
резервуар с мешалкой. Он доступен в пилотном и производственном
масштабе (общим объемом до 2000 л). Снабжен лопастными мещалками.Культивирование может быть стационарным, стационарным с подпиткой, а также непрерывным. Реактор используется для культивирования взвеси клеток или клеток, иммобилизованных на микроносителях. Для задержания биомассы при непрерывном культивировании можно использовать роторные или спиральные фильтры.
Встроенное устройство пробоотбора обеспечивает стерильный отбор контагиозных клеток (например, для производства вирусов).
Слайд 46
Эрлифтный ферментер
В этих ферментерах перемешивание осуществляется потоком
воздуха, а не лопастью мешалки, обеспечивая эффективный массоперенос и
низкие силы рассечения. Для контроля за циркуляцией жидкости устанавливают вытяжную трубу, направляющую поток пузырьков по центру. Распределение газа может осуществляться с помощью перфорированных, пористых или гидрофобных трубок. Если клетки могут повредиться пузырьками газа, установивают систему безпузырьковой аэрации через силиконовые трубочки.Биореакторы доступны как лабораторные, так и промышленные. Последние имеют широкую верхнюю часть, действующую как сепаратор газов.
Культивирование может быть стационарным, стационарным с подпиткой или непрерывным. Эрлифтные ферментеры подходят для культивирования суспензий клеток, включая клетки насекомых.
Слайд 48 Многие клетки млекопитающих растут только будучи прикрепленными к
поверхности. Такие опорнозависимые клетки иммобилизуют на микроносителях. Если носитель
пористый, клетки могут расти внутри него, при этом они защищены от раневого стресса, что позволяет использовать более высокие скорости перемешивания и продувки в процессе культивирования.Биореакторы, которые поддерживают носители с иммобилизованными клетками в состоянии суспензии, называются реакторами с взвешенной твердой фазой (fluidized bed reators).
Обычно в этих реакторах присутствует три фазы – твердая, жидкая и газообразная. Для непрерывного культивирования с удержанием биомассы используется специально разработанная система сепарации. Она состоит из различных камер и обеспечивает полное задержание частиц при перфузионных процессах. Перемешивание достигается с помощью продувки. Это обеспечивает низкий раневой стресс и равномерный массоперенос.
Слайд 49 Биореакторы с взвешенной твердой фазой рекомендуются для клеток
на микроносителях, для клеток, чувствительных к раневому стрессу, для
заключенных в капсулу клеток и для продуцирования целевых метаболитов в долговременной культуре клеток.Слайд 50 Для опорнозависимых клеток можно также использовать биореактор с
фиксированной твердой фазой (fixed bed reactor), в котором клетки
и их носители захватываются в закрепленную подложку. Эта система не нуждается в сепарационных приемах для удаления жидкой фазы. Раневой стресс и повреждение клеток пузырьками газа минимальны.В процессе культивирования через фиксированную подложку циркулирует насыщенная кислородом среда. Поэтому длина подложки является критическим параметром, поскольку обеспечение культуры кислородом и питательными веществами может быть недостаточным. В больших реакторах эту проблему можно решить с помощью радиально распространяющегося потока. Среда, обогащенная продуктами метаболизма, удаляется непрерывно или периодически.
В таких реакторах выращивают нуждающиеся в иммобилизации и чувствительные к ранению клетки. Система подходит и для долговременного выращивания культур клеток с продуктами метаболизма.
Слайд 52
Мембранный ферментер
Мембранный ферментер состоит из внутренней и внешней
камер, которые разделены диализной мембраной. Мембрана обеспечивает безпузырьковую продувку
и задержание биомассы при непрерывном культивировании.С помощью мембранной технологии токсические (низкомолекулярные) метаболиты удаляются, а (высокомолекулярные) соединения удерживаются во внутренней камере. Перемешивание в каждой из камер осуществляется мешалкой. Среда и воздух поставляются во внешнюю камеру.
Биореактор сконструирован для непрерывного культивирования, но может быть также использован в стационарных и стационарных с подпиткой процессах. также могут выращиваться в этом биореакторе В таких реакторах также возможно выращивание взвешенных клеток, а также клеток на микроносителях.
Слайд 53 Тема 2. Поживні середовища для роботи з клітинними
культурами
Основні вимоги, які пред’являють до поживних середовищ для клітинних
культур. Принципи складання поживних середовищ.
Основні типи та склад поживних середовищ для культивування різних типів клітин.
Основні поживні потреби клітин.
Якісний і кількісний вміст усіх необхідних компонентів, що забезпечують оптимальний розвиток живих клітин, отриманих з різних джерел.
Переваги та недоліки різних типів поживних середовищ
Слайд 54
Принципы составления питательных сред
Все живые клетки нуждаются
в экзогенных источниках питания, содержащихся в питательных средах. Питательная
среда обеспечивает жизнедеятельность, рост и развитие биообъектов.Постоянным компонентом питательных сред является вода, в которой нуждаются все живые клетки. Питательные вещества образуют в воде истинные (минеральные соли, сахара, аминокислоты, карбоновые кислоты, спирты, альдегиды) или коллоидные (белки, липиды, неорганические соединения) растворы. Некоторые компоненты питательных сред, находящиеся в твердом агрегатном состоянии, могут либо образовывать придонный осадок, либо равномерно распределяться по всему объему в виде взвеси, либо плавать на поверхности раствора (частицы угля). Жидкие углеводороды при внесении в воду образуют несмешивающуюся фракцию.
В питательной среде должны присутствовать все элементы, необходимые для построения компонентов живых клеток в доступной для усвоения форме. В больших количествах клеткам необходимы макроэлементы: углерод, азот, кислород, водород, фосфор, сера, калий, кальций, магний. Снабжение клеток кислородом и водородом осуществляется за счет воды. Углерод является составной частью всех органических соединений и его источники многочисленны и многообразны: чаще всего сахара, многоатомные спирты и органические кислоты. В качестве азотистого субстрата для изготовления питательных сред служат в основном белки животного и растительного происхождения.
Помимо макроэлементов, клетки в незначительных количествах нуждаются также и в некоторых микроэлементах: натрий, марганец, никель, кобальт, хлор, цинк, медь, кремний, молибден, бор, ванадий и некоторые другие.
Кроме основных пластических и энергетических компонентов, питательные среды могут содержать и так называемые факторы роста. Это органические соединения (витамины, аминокислоты, пуриновые и пиримидиновые основания и др.), в которых нуждаются ауксотрофные клетки и которые они синтезировать не в состоянии. Отсутствие таких веществ приводит к нарушению обменных процессов и прекращению роста клеток.
В качестве необходимых компонентов питательных сред могут выступать газы: хорошо (NH3, H2S), умеренно (CO2) или плохо (N2, O2, H2, CH4) растворимые в воде. Питательные среды могут иметь неопределенный состав, т. е. включать биогенные добавки (растительного, животного или микробного происхождения), например мясной экстракт, дрожжевой экстракт, кукурузную муку, морские водоросли и т. д. Такие питательные среды называются натуральными. Применяют также среды, приготовленные из чисто химических соединений в заранее определенных соотношениях. Это так называемые синтетические среды. Применение находят и полусинтетические питательные среды, сочетающие в своем составе компоненты как натуральных, так и синтетических сред.
Среды данных типов имеют как преимущества, так и недостатки. С экономической точки зрения наиболее целесообразно использование природного, более дешевого сырья, чем веществ в чистом виде, полученных химическим путем. Однако только применение сред строго определенного состава позволяет точно регистрировать и регулировать протекающие в культуральной среде процессы, добиваясь их оптимизации. Компромиссным подходом является использование полусинтетических сред, в состав которых наряду с соединениями известной химической природы входят биогенные добавки.
Слайд 55
Питательные среды и условия культивирования
После извлечения клеток из
ткани или органа культуральная среда должна обеспечивать все внешние
условия, которые клетки имели in vivo. Это обеспечивает выживание клеток, их пролиферацию и дифференцировку. Внеклеточная среда должна обеспечивать клетки питательными и гормональными факторами, т.е. обладать всем необходимым для роста и выживания клеток.Культуры клеток животных и человека предъявляют определенные требования к жидкой (питательная среда), газообразной (концентрация газов) и твердой (поверхность субстрата) фазе.
Слайд 56 Питательная среда представляет собой раствор определенного состава, к
которому добавляются компоненты неидентифицированного биологического происхождения (плазма, сыворотка крови,
тканевые экстракты и т.д.).Слайд 57 Основу питательных сред составляют солевые растворы. Минеральные компоненты
в этих растворах подобраны так, что раствор выполняет буферные
функции, поддерживая постоянный кислотно-щелочной баланс среды в процессе культивирования.Постоянство рН среды является одним из главных требований условий культивирования.
Для приготовления питательных сред обычно используются солевые растворы Эрла и Хенкса. Эти растворы, как и фосфатносолевой буфер Дульбекко и Фогта используются также для орошения и промывки клеток при пассировании культур, выделении клеточных линий и других манипуляциях с культурами клеток.
Слайд 58 Другим важным условием культивирования является осмотическое давление. Оно
определяется числом молей осмотически активных частиц (ионов и неионизированных
молекул) растворенных веществ на 1 кг растворителя (осмоляльность) или на 1 литр раствора (осмолярность). В разбавленных водных растворах эти величины близки.Диапазоны рН и осмоляльности, при которых происходит размножение клеток, узки и варьируют в зависимости от типа клеток.
Для поддержания рН в большинстве сред используется бикарбонатный буфер. Растворы могут содержать малое количество бикарбонатного буфера (раствор Хенкса), они предназначены для поддержания рН в плотно закрытых сосудах. В других (растворе Эрла) бикарбоната больше, они используются в системах с повышенным парциальным давлением СО2.
Если культивирование ведется вне СО2-инкубатора, где рН поддерживать труднее, необходимы альтернативные буферные системы. Хорошим буфером является HEPES 4-(2-оксиэтил)-1-пиперазинэтансульфоновая кислота. HEPES легко растворим в воде, не связывает двухвалентные катионы, не цитотоксичен до концентрации 0.05 М. Применяется в концентрациях 0.01- 0.03 М.
Слайд 59
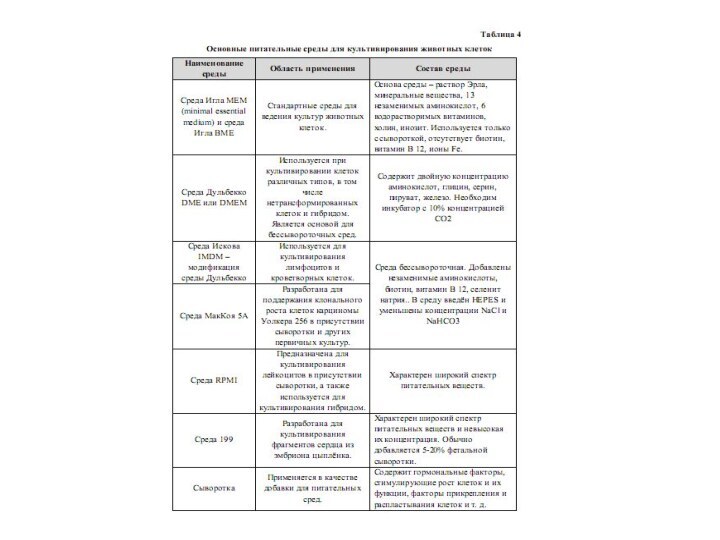
Стандартные среды для культур животных клеток
Среды Игла
MEM (minimal essential medium) и BME (basal medium, Eagle).
Чаще используется МЕМ. Она содержит минеральные вещества, аминокислоты (13 незаменимых), 6 водорастворимых витаминов, холин и инозит, выполняющие роль углеводородного субстрата. МЕМ используется только с сывороткой, так как в ней отсутствуют биотин, витамин В12, ионы железа и микроэлементы. Основа раствор ЭрлаСреда Дульбекко DME или DMEM (двойная модификация среды Игла). Используется при культивировании клеток различных типов, в том числе нетрансформированных клеток и гибридом. Является основой для бессывороточных сред. Содержит двойную концентрацию аминокислот, глицин, серин, пируват, железо. При использовании этой среды необходим инкубатор с 10% концентрацией СО2
Среда Искова IMDM - модификация среда Дульбекко. Добавлены незаменимые аминокислоты, биотин, витамин В12, селенит натрия. В среду введен HEPES и уменьшены концентрации NaCl и NaHCO3. Среда бессывороточная, обычно используется для культивирования лимфоцитов и кроветворных клеток.
Слайд 60
Стандартные среды для культур животных клеток
Среда МакКоя
5А и серия сред RPMI. Среда МакКоя 5А разработана
в 1958 году для поддержания клонального роста клеток карциносаркомы Уолкера 256 в присутствии сыворотки, а затем уже других первичных культур и различных клеточных линий. Обычно производится в модификации Ивката и Грейса (RPMI) и предназначена для культивирования лейкоцитов в присутствии сыворотки, часто применяется и для культивирования гибридом. Концентрация СО2 в атмосфере при культивировании 5%.Среда 199 разработана в 1950 году для культивирования фрагментов сердца из эмбриона цыпленка. Для среды характерны широкий спектр питательных веществ и невысокая их концентрация. Используется без добавок, как поддерживающая для первичных клеток, а с сывороткой как ростовая среда для быстро размножающихся клеток.
Слайд 61 Нормальные, сохраняющие специфические функции клетки на стандартных средах
не размножаются (если они не трансформированы). Для оптимизации роста
клеток обычно добавляют 5-20% фетальной (эмбриональной) сыворотки.Сыворотка представляет собой чрезвычайно сложную смесь мелких и крупных молекул, способных как вызывать, так и тормозить рост клеток.
К главным функциям сыворотки относятся:
обеспечение гормональными факторами, стимулирующими рост клеток и их функции;
обеспечение факторами прикрепления и распластывания клеток;
обеспечение транспортными белками, переносящими гормоны, минеральные вещества, липиды и т.д.
Слайд 62 Белки сыворотки, прямо и специфически участвующие в стимуляции
клеточного деления, называются факторами роста.
Большинство ростовых факторов присутствуют
в сыворотке в неопределяемых следовых количествах. Некоторые из этих факторов специфичны для клеток на определенной стадии дифференцировки, действие других не ограничено каким-либо одним типом клеток. Один и тот же тип клеток может быть стимулирован различными ростовыми факторами. Например, фибробласты размножаются в ответ на фактор роста фибробластов, фактор роста эпидермиса, фактор роста, синтезируемый тромбоцитами и соматомедины. Все эти вещества являются митогенами (стимулируют митоз). Другим важным фактором роста практически для всех типов клеток является гормон инсулин. Из других гормонов наиболее часто применяются глюкокортикоиды (гидрокортизон, дексаметазон), стероиды (эстрадиол, тестостерон, прогестерон) и гормоны щитовидной железы (трииодтиронин).
Слайд 63 Гормоны стимулируют или подавляют рост в зависимости от
типа клеток и их плотности. Глюкокортикоиды, например, влияют на
пролиферацию клеток, изменяя их чувствительность к факторам роста.Для переноса низкомолекулярных факторов (витаминов, аминокислот, липидов и других) необходимы транспортные белки. В этой роли выступает альбумин. Транспорт железа обеспечивает трансферрин, и поверхность большинства культивируемых клеток содержит рецепторы для этого белка.
К факторам прикрепления и распластывания клеток относятся содержащиеся в сыворотке коллаген и фибронектин, ά-глобулиновая сывороточная фракция фетуин. Более специализированы хондронектин (адгезия хондроцитов) и ламинин (адгезия эпителиальных клеток).
Слайд 64
Недостатки культивирования клеток в присутствии сыворотки
для большинства тканей
сыворотка не является физиологической жидкостью, с которой они контактировали
в исходной ткани. Например, сыворотка вызывает рост фибробластов, но тормозит рост эпидермальных кератиноцитов;сыворотка может быть цитотоксичной, так как содержит полиаминоксидазу, действующую на полиамины (спермин, спермидин), являющиеся продуктами секреции быстро пролиферирующих клеток;
значительная вариабельность состава сывороток разных партий;
сыворотки могут содержать недостаточное количество специфических ростовых факторов, что вызывает необходимость добавления их к культурам клеток.
Слайд 65 В настоящее время предпринимаются попытки создания и применения
бессывороточных питательных сред, в которых сыворотка заменяется смесью гормонов
(инсулин, трансферрин, глюкокортикоиды и др.) и ростовых факторов. Эти среды необходимы, если требуется избежать присутствия чужеродного белка и из-за высокой стоимости эмбриональной сыворотки крупного рогатого скота.Бессывороточные среды имеют определенные преимущества: улучшение воспроизводимости результатов вследствие большей стабильности состава среды; снижение риска заражения культуры вирусами, грибами, микоплазмами; облегчение очистки продуктов клеточного метаболизма; отсутствие цитотоксичности сыворотки. Однако в настоящее время бессывороточные среды имеют существенные недостатки: добавление в дешевую среду гормонов и факторов роста делает ее такой же дорогой, как среда с сывороткой. Кроме того, чаще всего бессывороточные среды пригодны для ограниченного числа клеток, т.е. узко специализированы.
Слайд 66 Следовательно, оптимизация состава питательных сред для культур животных
клеток развивается в двух направлениях – разработка сред, требующих
внесения природных добавок (сыворотки, эмбриональные экстракты и др.), и создание сред химически определенного состава.В настоящее время наиболее широко применяются среды, содержащие источники энергии (углеводы) и азота; незаменимые аминокислоты; витамины; неорганические соли – источники макро- и микроэлементов, включая селенит; нуклеозиды; жиры и жирорастворимые компоненты; гормоны (инсулин, трансферрин, глюкокортикоиды, эстроген, андроген, тироксин, трииодтиронин); ростовые факторы (фактор роста, синтезируемый тромбоцитами, фактор роста фибробластов, фактор роста эпидермиса), а также сыворотку (до 20%) и в ряде случаев некоторые другие добавки (бактопептон, триптозофосфат и т. п.).
Слайд 69
Тема 1. Методи створення клітинних культур рослин
Історія створення
культур клітин рослин.
Подальша розробка методів, поживних середовищ і
умов культивування клітин рослин.Середовища і методи вирощування калусних клітин: поверхневий спосіб на агаризованому живильному середовищі, суспензійні культури і глибинне культивування, культивування окремих (одиночних) клітин.
Динаміка росту популяції рослинних клітин і особливості кожної фази.
Слайд 70
Методы создания клеточных культур растений
Культура клеток растений может
быть получена и успешно поддерживаться только при условии соблюдения
асептики. Это достигается благодаря использованию различных методов стерилизации помещений, лабораторной посуды, инструмента, питательных сред. Особо тщательно стерилизуют поверхность эксплантатов, предназначенных для получения культуры клеток. Все работы, при которых открывают культуральные сосуды (разлив стерильной питательной среды по пробиркам, чашкам Петри, колбам, вычленение эксплантатов и их перенос на питательную среду, перенос части культуры на свежую питательную среду и др.) проводят в стерильных условиях в рабочем пространстве ламинар-бокса с соблюдением правил асептики.
Слайд 71
Основные виды культуры клеток растений:
Каллусная, суспензионная, культура
протопластов.
Каллус – особая ткань, состоящей их однородных паренхимных
клеток, которые, интенсивно делясь, покрывают место поранения. В процессе их вторичной дифференцировки происходит восстановление поврежденных тканей и органов.
Слайд 72
Каллусная культура картофеля
Если фрагмент специализированных тканей растения (эксплантат)
поместить на питательную среду, содержащую фитогормоны, необходимые для образования
каллуса, то можно получить культуру каллусных клеток in vitro - основной тип культуры клеток растений.
Слайд 73
Цитоморфологические, физиолого-биохимические особенности каллусных культур
Переход клетки in vitro
из дифференцированного состояние к дедифференцировке и активным клеточным делениям
обусловлен изменением активности генов.В процессе дедифференцировки в каллусных клетках появляются специфические белки и одновременно исчезают другие, характерные для клеток эксплантата. Клетки эксплантатов теряют запасенные липиды, крахмал, белки. Фотосинтезирующие клетки утрачивают хлорофилл и липиды хлоропластов. При этом возрастает количество амилопластов, разрушается аппарат Гольджи, перестраивается эндоплазматический ретикулум и элементы цитоскелета.
Слайд 74
Цитоморфологические, физиолого-биохимические особенности каллюсных культур
Энергетический метаболизм каллусных клеток
в значительной мере напоминает таковой у клеток меристемы.
Митохондрии
у них слабо развиты, в них мало крист, что оказывает негативное влияние на активность аэробного дыхания. Они потребляют меньше кислорода по сравнению со специализированными клетками растения. У них происходит сдвиг соотношения между дыханием и брожением в сторону брожения. Имеет место повышенное потребление углеводов из-за аэробного гликолиза, сдвиг в обмене углеводов в направлении пентозофосфатного пути, который является источником пентоз, необходимых для делящихся клеток.
Слайд 75
Суспензионная культура клеток растений
Для получения клеточной суспензии каллусную
ткань помещают в сосуд с жидкой питательной средой (приблизительно
2 г ткани на 100 мл среды). Предпочтительно использовать рыхлые каллусы, которые легко распадаются на кластеры и небольшие агрегаты клеток. Суспензия перемешивается на качалке со скоростью 100-120 об/мин.
Слайд 76
Суспензионная культура клеток растений
Примерно через две недели суспензию
фракционируют на одиночные клетки, мелкие кластеры и большие агрегаты
каллюсных клеток. Проще всего это сделать с помощью отстаивания суспензии в течение 1-2 минут. Крупные агрегаты оседают на дно, а одиночные клетки и мелкие агрегаты клеток остаются в поверхностной фазе. Чтобы удалить из суспензии крупные агрегаты клеток также используют фильтрование через 1-2 слоя марли, нейлоновые сита.Улучшить дезагрегацию каллюсных клеток при получении суспензионной культуры клеток можно, предварительно выращивая каллюс на питательной среде без ионов кальция, содержащей в качестве ауксина 2,4 Д. Хороший эффект дает добавление в среду ферментов пектиназы (около 2 мг/л) и целлюлазы (0,01 мг/л).
Слайд 77
Суспензионная культура клеток растений
Как и каллусные культуры, суспензию
клеток периодически переносят на свежую питательную среду (пассируют). Для
этого суспензию фильтруют через нейлоновое сито и часть объема культуры, содержащего одиночные клетки или мелкие агрегаты - инокулят (inoculum), переносят в стерильных условиях в приготовленную питательную среду. Каждая линия культуры клеток растений характеризуется минимальным объемом инокулята, меньше которого культура не возобновляет рост (чем он меньше, тем лучше линия).
Слайд 78
Суспензионная культура клеток растений
Рост клеток в суспензионных культурах
клеток оценивают по одному или нескольким из следующих параметров:
- Объем осажденных клеток (ООК) – величина, равная отношению объема осадка к объему суспензии, выраженное в %.
- Число клеток в единице объема питательной среды: подсчитывается в камере Фукса-Розенталя.
- Сырая и сухая масса.
- Содержание белка.
- Проводимость среды; ее определяют с помощью кондуктометра – она обратно пропорциональна массе клеток.
- Жизнеспособность клеток. Ее оценивают, изучая движение цитоплазмы под микроскопом, а также с помощью окраски 0,5 % раствором синего Эванса или 0,01% раствором флюоресцеиндиацетата: живые клетки не окрашиваются красителями вследствие непроницаемости для них клеточных мембран.
Слайд 79
Фазы кривой роста ККР
I – лаг-фаза; II –
экспоненциальная фаза; III – фаза линейного роста;
IV – фаза
замедленного роста; V – стационарная фаза; VI – фаза отмирания
Слайд 80
Тема 2. Протопласти рослинних клітин
Способи виділення і умови
культивування рослинних протопластів.
Значення культур клітин рослин і ізольованих
рослинних протопластів для створення методів біологічного конструювання рослин із заданими властивостями.
Слайд 81
Культура протопластов растений
Изолированный протопласт – это часть клетки,
которая остается после удаления клеточной стенки.
Для удаления клеточной стенки
в настоящее время используют целлюлазы, гемицеллюлазы и пектиназы, получаемые из грибов – Myrothecium, Aspergillus, Trichoderma и других, из пищеварительного сока улитки Helix pomatia.Культура протопластов из мезофилла листа табака
Слайд 82
Культура протопластов растений
Протопласты выделяют из разных тканей растений,
а также из клеток каллусных и суспензионных культур.
С
целью получения большого числа однотипных протопластов у двудольных используют мезофилл молодых листьев. Наиболее освоены методы изоляции и культивирования протопластов у представителей семейства Solanaceae и отдельных видов Brassica.
Трудными объектами для получения протопластов, способных к реализации тотипотентности, являются однодольные растения, в том числе злаки, а также хвойные.
Слайд 83
Протопласты растительных клеток как объекты биологического конструирования
Способы выделения
растительных протопластов
Протопласты растений – это клетки, лишенные целлюлозной оболочки,
т.е. ограниченные мембраной цитоплазматические образования, несущие внутриклеточные органоиды и характеризующиеся структурной целостностью и способностью осуществлять активный метаболизм и выполнять биосинтезы и трансформацию энергии. Термин был использован Д. Ханстеином (Ганштейном) в 1880 г. для обозначения морфологически обособленных образований при плазмолизе.
Слайд 84 Впервые выделение растительных протопластов было осуществлено в 1892
г. Дж. Клеркером при изучении плазмолиза в клетках водного
телореза (Stratiotes aloides) при механическом повреждении ткани.Данный способ выделения протопластов получил название «механический».
Механический метод получения растительных протопластов.
Энзиматический метод получения протопластов.
Слайд 88
Применение изолированных протопластов
Протопласты являются уникальной моделью для изучения
фундаментальных и прикладных физиологических проблем у растений.
Изолированные протопласты
имеют ряд областей применения:Изучение химии и структуры клеточной стенки (и при разрушении, и при синтезе «de novo»).
Изучение свойств плазмалеммы, трансмембранных перемещений.
«Мягкое» выделение органелл.
Наблюдение за закономерностями дифференцировки клеток при слиянии протопластов, отслеживание взаимодействия ядра и цитоплазмы в полученной гибридной клетке, изучение соматических гибридов.
Введение чужеродных органелл (клеточная инженерия).
Введение чужеродных генов в растительную клетку (трансгенез).
Слайд 90 Тема 1. Історія та проблеми розвитку культивування клітин
тварин
Історія та проблеми розвитку культивування клітин тварин.
Основні культивовані
елементи. Можливості та способи отримання і особливості існування первинних культур.
Особливості поведінки та розвитку нормальних, трансформованих і пухлинних клітин.
Слайд 91
Культивирование лимфоцитов периферической крови
РЕАГЕНТЫ
Среда Игла 199.
Фитогемагглютинин (ФГА).
Инактивированная эмбриональная
телячья сыворотка.
Пенициллин.
Стрептомицин.
Краситель Романовского-Гимза.
Смесь Никифорова (3 : 1 / этанол
: эфир).ХОД МЕТОДА
Стерильно взятую периферическую кровь выдерживают 30-40 мин. При комнатной температуре до четкого разделения эритроцитов и плазмы.
В стерильные пенициллиновые флаконы вносят по 4 мл. среды 199, содержащей 200 ЕД пенициллина и 100 ЕД стрептомицина в 1 мл., и 0,5 мл инактивированной эмбриональной сыворотки.
0,3 - 0,5 мл плазмы, содержащей клетки, добавляют во флаконы со средой 199.
В опытные пробы добавляют по 0,1 мл изотонического раствора, содержащего 100 мкг ФГА. В контрольные пробы добавляют по 0,1 мл изотонического раствора.
Флаконы с пробами помещают на 48 – 72 ч. в термостат при температуре 37о С.
После инкубации снимают 3 мл надосадочной жидкости, осадок ресуспензируют в оставшемся 1 мл среды и переносят в центрифужные пробирки.
Центрифугируют 10 мин при 1000 об/мин, после чего надосадочную жидкость удаляют.
В пробирки добавляют 5 мл 20% - ной уксусной кислоты, выдерживают 5 мин, центрифугируют 10 мин при 1000 об/мин, надосадочную жидкость удаляют, а осадок переносят на обезжиренное в смеси Никифорова предметное стекло и после высыхания на воздухе, окрашивают.
Мазок окрашивают азур-эозином по Романовскому-Гимза в течение 30 мин.
УЧЕТ РЕЗУЛЬТАТОВ И ОЦЕНКА МЕТОДА
Под микроскопом в нескольких полях зрения подсчитывают отдельно количество лимфоцитов и количество бластов.
Слайд 92 Перед началом работы необходимо проверить наличие всей необходимой
посуды и инструментов в боксе. Обработать резиновые пробки всех
сосудов с растворами горящей ватой, смоченной в 70° или 96° спиртеСлайд 93 Культуру животных тканей применяют для изучения механизмов роста
и дифференцировки клеток, гистогенеза, межтканевых и межклеточных взаимодействий, обмена
веществ и т. п.Культуры животных клеток являются важными продуцентами многих биологически важных веществ. На них выращивают вирусы для их идентификации и получения вакцин.
Клеточные культуры часто применяют при тестировании и изучении механизма действия лекарственных и косметических средств, пестицидов, консервантов и т. п.
Слайд 94
История развития культивирования животных клеток
Идея о том, что
клетки тканей животных можно выделить из организма и затем
создать условия для роста и воспроизводства их in vitro, возникла на базе концепции, принадлежащей К. Бернару.в 1885 г., Ру показал возможность сохранения вне организма живых тканей на практике.
в 1897 г., Леб поддерживал в жизнеспособном состоянии клетки крови и соединительной ткани в пробирках с сывороткой и плазмой крови.
Льюнгрен (1898) показал возможность поддержания эксплантатов кожи человека в жизнеспособном состоянии в кислой среде с сохранением способности к реимплантации.
Джолли (1903) наблюдал деление клетки в висячей капле, содержащей лейкоциты саламандры
Биб и Эвинг (1906) подтвердили это в экспериментах с лимфосаркомной тканью собаки.
Впервые клоны клеток в культуре из одиночной клетки были получены Эрлом с сотрудниками в 1948 г.
Первые суспензионные культуры клеток животных, полученные в 1953 г. Оуенсом и сотрудниками, основывались на клетках злокачественных тканей. Это – клетки HeLa, выделенные из раковой опухоли шейки матки человека. Перевиваемая линия клеток карциномы шейки матки была выделена еще в 1952 г. Джеем с сотрудниками и используется в настоящее время во многих лабораториях мира.
Игл (1955) систематически исследовал пищевые потребности клеток человека и мыши.
До тех пор, пока в 1961 г. Хейфлик и Мурхед не выделили линию диплоидных клеток человека (НDС) WI-38, считалось, что один раз установившаяся клеточная линия имеет неограниченное время жизни.
Слайд 95
Основные культивируемые элементы
В настоящее время практически любые клетки
человека и животных могут быть введены в культуру и,
тем самым, служить средством и объектом во многих исследованиях. Благодаря культивированию клеток возможности исследования и диагностики расширяются почти беспредельно, так как имеется возможность оценки не только морфологических и биохимических изменений, но и изменений в поведении клеток, их реакции на различные агенты, в том числе и на лекарственные воздействия.Наиболее часто культивируются следующие элементы:
соединительной ткани – фибробласты;
скелетной – кость и хрящи;
мышечной – скелетные, сердечные и гладкие мышцы;
эпителиальной – печень, легкие, кожа, мочевой пузырь, почки, молочная железа;
нервной – глиальные клетки и нейроны (хотя они лишены способности к пролиферации);
эндокринной системы – гипофиз, надпочечники, клетки островков Лангерганса;
различные типы опухолевых клеток.
Слайд 96
Возможности и способы получения, особенности существования первичных культур
Первичной
называют клеточную культуру, полученную непосредственно от животного и имеющую
ограниченный срок существования. По прошествии определенного времени (20-30 суток) в клетках возникают явления неспецифической дегенерации, что выражается в грануляции и вакуолизации цитоплазмы, ошаривании клеток, утрате связи между ними и твердым субстратом, на котором они выращивались. Периодическая смена среды, изменение ее состава и другие процедуры могут лишь несколько увеличить сроки жизни первичной клеточной культуры, но не могут предотвратить ее конечной деструкции и гибели. По всей вероятности, этот процесс связан с естественным угасанием метаболической активности клеток, выведенных из-под контроля нейрогуморальных факторов, действующих в целостном организме.Культуры первичных клеток легко получить из многих тканей. Они существуют 20-30 суток и дают начало диплоидным культурам. Какое-то время диплоидные клетки экспоненциально размножаются, но затем примерно через 6 месяцев скорость роста культуры снижается, а через 10-12 месяцев клетки деградируют и погибают. Это наблюдается примерно после 20-50 генераций (в зависимости от возраста тканей-источников первичных клеток – из эмбриональной – 50, из взрослой – 20). В некоторых случаях отдельные клетки выживают и продолжают размножаться, что приводит к установлению клеточной линии.
Слайд 97
Возможности и способы получения, особенности существования первичных культур
Отбор
осуществляют при регулярной смене питательной среды, омывающей монослой. Смену
среды производят регулярно, не реже 1 раза в неделю. В течение первых 3 недель заменяют по 20-30% объема среды, в течение следующих 3-4 недель – 50-60%, позднее проводят полную замену среды.По мере смены среды клетки меняют морфологию. Часть клеток ошаривается и отделяется от субстрата. Большинство клеток стягивается к центру, и монослой приобретает звездчатый вид. Сами клетки при этом удлиняются. Через 7-10 смен, как правило, начинают появляться новые атипичные клеточные элементы, имеющие в разных культурах разную морфологию. Именно они наиболее часто дают начало жизнеспособным линиям перевиваемых клеток.
Таким образом, установление клеточных линий определяется отбором клеток с повышенной активностью из популяций первичных и диплоидных клеток.
Слайд 98
Раковые клетки продолжают расти и после того, как
заполнят всю поверхность субстрата, образуя мультислой
Линии клеток А431: эпидермальной
карциномы человека. Стрелками показаны места "нарастания" клеток друг на другаОсобенности поведения и развития нормальных, трансформированных и опухолевых клеток
Слайд 99 Округленная форма трансформированных клеток (34 °С). Те же
клетки приобретают нормальную морфологию, когда продукт онкогена инактивируется повышением
температуры (39 °С).Клетки, трансформированные in vitro ретровирусом (вирус саркомы Рауса), несущим температурочувствительную мутацию в онкогене
Слайд 100
Тема 2. Відмінні особливості культивування тваринних клітин
Динаміка розвитку
клітинних ліній.
Моношарові та суспензійні клітинні культури.
Культивування тваринних
клітин на мікроносіях. Типи культуральних систем для непроточних і проточних культур.
Слайд 101
Динамика развития клеточных линий
Фазы роста культуры животных клеток:
I
– лаг-фаза; II – фаза логарифмического роста; III –
стационарная фаза;IV – фаза снижения количества клеток и их гибели
Слайд 102
Динамика развития клеточных линий
Прикрепление клетки к субстрату
Животные клетки
в культуре в процессе деления
Слайд 103 Существует 2 основных способа культивирования животных клеток: суспензионные
культуры и монослойные культуры.
Суспензионные культуры предпочтительнее с точки зрения
увеличения выхода клеток.
Слайд 104
Суспензионное культивирование
В 1953 г. Оуенс с сотрудниками получили
первые суспензионные культуры животных клеток, которые удобнее использовать для
наращивания клеточной массы.Как правило, клетки, отделившиеся от субстрата, на котором они росли, неспособны к росту в суспензии и быстро деградируют. Но если некоторые клетки культивировать во вращающемся флаконе (2 об\мин), не дающем возможности прикрепления клеток к поверхности, в среде, содержащей метилцеллюлозу, предотвращающую агрегацию клеток, можно получить жизнеспособные суспензионные клеточные штаммы. Метилцеллюлоза в концентрации 0,1-0,2% обладает максимальным протективным действием на взвешенные клетки, т.к. ее молекулы образуют вокруг клеток защитный слой препятствующий не только агрегации, но повреждениям при перемешивании.
Слайд 105 Суспензионное культивирование дает 2-3-х кратную экономию питательных сред,
по сравнению с общепринятым стационарным культивированием с полным исключением
дорогостоящих протеолитических ферментов и буферных растворов. Кроме того суспензионные культуры представляются предпочтительными с точки зрения выхода клеток.Суспензионные культуры широко используется в вирусологических исследованиях и для накопления больших количеств вируссодержащего материала, при изготовлении вакцин и диагностических препаратов.
Слайд 106
Монослойные культуры
Большинство нетрансформированных клеток млекопитающих могут расти только
в виде монослоя, прикрепленными к субстрату – к другим
клеткам либо к стеклу (алюмо-боросиликатное стекло типа пирекс), пластику (полистирол, полиэтилен, поликарбонат, поливинилхлорид, тефлон, целлофан и др. при условии правильной обработки этих полимеров) - пластиковая поверхность должна быть специально обработана, чтобы клетки могли к ней прикрепиться, причем клетки эукариот не прикрепляются к пластиковым чашкам, предназначенным для бактериальных культур) или металлу – качественная медицинская нержавеющая сталь или титан.Монослойное культивирование осуществляют во флаконах (флаконы Ру – самые большие стационарные флаконы, поверхностью до 200 кв.см или флаконах Колле) или пробирках для культуры тканей, обеспечивающих поверхность роста 5-200 кв.см.
Слайд 107
Преимущества использования монослойных культур:
Монослойные культуры могут быть
применены к любому типу клеток, что обеспечивает наибольшую гибкость
использования.Легко провести полную замену среды и промыть клетки перед добавлением свежей питательной среды. Это важно в тех случаях, когда рост клеток идет в одних условиях, а наработка продукта в других условиях, например при переносе клеток из среды с сывороткой в бессывороточную среду. Можно также полностью удалять нежелательные компоненты.
Позволяют обеспечить высокую плотность клеток.
У многих клеток экспрессия требуемого продукта идет эффективнее, если клетки прикреплены к субстрату.
В некоторых случаях, например для пассирования вирусов, требуются тесные межклеточные контакты.
Слайд 108
Недостатки использования монослойных культур
необходимость большого пространства;
возрастание стоимости
и трудоемкости при увеличении масштаба;
недостаточно эффективный контроль, обусловленный
трудностями отбора пробы и отсутствием информативности визуального анализа; сложности в определении и контролировании рН, концентрации кислорода и обеспечении гомогенности культуры клеток.
Слайд 109
Разновидности монослойного культивирования
Культивирование в плоских флаконах (матрацах).
Культивирование
во вращающихся бутылях, когда в каждый момент времени 15-20%
поверхности бутыли покрыто питательной средой, а клетки находятся попеременно то в среде, то в воздухе.Культивирование в колонках на микроносителях, в качестве которых выступают плотно упакованные, не смещающиеся стеклянные бусы диаметром 35 мм, стопка пластин и др., а питательная среда омывает их, протекая сверху вниз.
Слайд 110
Требования к микроносителям:
Микроносители
не должны быть:
токсичными,
не сорбировать
компоненты питательных сред и продукты метаболизма клеток,
должны иметь:
поверхностный
заряд или обменную емкость, достаточную для прикрепления клеток, возможность многократного использования.
Слайд 111
Требования к микроносителям:
Коммерческие классические микроносители имеют диаметр 100-250
мкм и подразделяются на 6 основных групп:
декстрановые микроносители поперечно
сшитые (Цитодекс 1), которые благодаря пористой структуре пригодны для выращивания различных клеточных линий, но имеют заряд, равномерно распределенный по всему объему частицы и хорошо сорбируют белки и низкомолекулярные компоненты питательной среды; декстрановые микроносители, но с несколько сниженной способностью к сорбции субстрата (Цитодекс 2);
микроносители, покрытые коллагеном или желатином (Цитодекс 3) – также декстрановые частицы, покрытые денатурированныи коллагеном или перекрестно сшитым желатином;
полистиреновые микроносители (Биосилон, цитосферес). Не имеют пористой структуры, что предупреждает сорбцию питательной среды;
стеклянные микроносители (Биогласс). Подобно пластикатовым не имеют пористой структуры ростовой поверхности;
целлюлозные микроносители (ДЕ-53), имеющие цилиндрическую форму с микрокристаллической целлюлозной матрицей и наиболее часто используемые для выращивания первичных и диплоидных культур, которые имеют тенденцию расти в виде гигантских агрегатов.
Используемые в настоящее время микроносители на основе микропористого желатина или пористого боросиликатного стекла имеют емкость около 3000 кл/мн.
Слайд 112 Миобласты, прикрепленные к шарообразным микроносителям, в которых растут
обозначенные зелёным взрослые клетки скелетных мышц
Слайд 113 Мультиклеточные опухолевые сфероиды (аденокарцинома человека MCF-7) в альгинат-хитозановых
микрокапсулах
Слайд 114 Микроноситель с полимерной поверхностью, выполненной из природных полимеров
клеточной стенки пыльцы
Слайд 115 Поверхности клеток животных и поверхности традиционных культуральных сосудов
из стекла и пластика, обладающие высокой поверхностной энергией, несут
отрицательные заряды. Поэтому для прикрепления клеток необходимо обеспечить поверхностный суммарный заряд субстрата, обеспечивающий прикрепление клеток.Это может достигаться: 1) за счет электоростатического взаимодействий и 2) за счет присутствия внеклеточного биоматрикса.
1. Суммарный заряд поверхности субстрата (например, за счет образования отрицательно заряженных карбоксильных групп) может достигаться предварительным воздействием химическими (окисляющие агенты) и физическими факторами (высоковольтный разряд, облучение УФ и др.), что облегчает электростатическое прикрепление клеток.
2. Поверхность культурального сосуда может быть также покрыта веществом, облегчающим прикрепление клеток. К природным субстратам, на которых растут клетки относится коллаген. Другими излюбленными субстратами являются желатин и фибронектин. Возможно использование для этих целей полиаминокислот (поли-D-лизин), а также присутствие двухвалентных катионов кальция и магния.
Слайд 116
Системы культивирования клеток
Непроточные культуры - тип культур, в
котором клетки вводят в фиксированный объем среды.
По мере
роста клеток происходит использование питательных веществ и накопление метаболитов, поэтому среда должна периодически меняться, что приводит к изменению клеточного метаболизма, называемого еще и физиологической дифференцировкой. Со временем, в результате истощения среды происходит прекращение пролиферации клеток.
Увеличить продолжительность жизни непроточных культур можно несколькими способами: прерывистый; постоянный; перфузионный.
Слайд 117
Системы культивирования клеток
2. Проточные культуры
Обеспечивают истинные гомеостатические
условия.
Характеризуются постоянством концентрации питательных веществ и метаболитов, а
также числа клеток. Гомеостаз обусловлен постоянным вхождением среды в культуру и одновременным удалением равного объема среды с клетками.
Такие системы пригодны для суспензионных культур и монослойных культур на микроносителях.