Слайд 3
Признание идеи о том, что клетки тканей высших

животных можно выделить из организма и затем создать условия
для роста и воспроизводства их in vitro, датируется первым десятилетием XX века.
После того как стало известно, что подобные процессы реальны, наступил второй этап работ, начало которому положила демонстрация возможности выращивания и репродукции в таких клетках фильтрующихся инфекционных агентов—вирусов.
Третий этап истории начинается со времени, когда была показана практическая возможность получения в клетках животных больших количеств вирусного материала для применения в вакцинных препаратах, и простирается до времени, когда: 1) стало возможным вставить в клетки специфические экзогенно полученные гены и получить их экспрессию и 2) подтверждена возможность выращивания в культуре из одиночной клетки целой популяции. Когда такие популяции получали из клетки, выделявшей в окружающую среду антитела, то все молекулы антител в надосадочной жидкости были одинаковыми.
Причины и следствия этих двух феноменов в настоящее время интенсивно исследуются и они знаменуют собой начало четвертого этапа работ в данной области
Слайд 4
Идея о том, что клетки тканей животных можно
выделить из организма и затем создать условия для роста
и воспроизводства их in vitro возникла на базе концепции, принадлежащей Клоду Бернару. Он предположил, что не только живые организмы способны сохранять постоянство внутренних условий, вне зависимости от изменений в окружающей среде. Клетка вне организма животного тоже будет стремиться поддерживать свои внутренние условия. Если различия между внутренними и внешними условиями будут незначительными, то высока вероятность роста и деления клетки. Такое понимание явления приводит к необходимости разработки сред, способных поддерживать и стимулировать рост клеток вне организма.
Чуть позже, в 1885 году, У. Ру (W. Roux) показал возможность сохранения вне организма живых тканей на практике. Он сохранял в жизнеспособном состоянии оболочку куриного эмбриона в теплом физиологическом растворе.
Слайд 6
В соответствии с целями и задачами экспериментальной работы
можно выделить два направления культивирования животных клеток:
- культуры клеток;
- культуры органов и тканей (органные культуры).
Культуры клеток лишены структурной организации, теряют характерную гистиотипическую архитектуру и связанные с ней биохимические признаки и обычно не достигают равновесного состояния при отсутствии специальных условий. Клетки в культурах размножаются, что обеспечивает получение большой массы клеток, затем их идентифицируют (по фенотипическим признакам, путем выращивания в селективной среде, генотипически), разделяют на идентичные параллели и, если это необходимо, сохраняют. Динамические свойства культивируемых клеток часто трудно контролировать, также трудно реконструировать in vitro некоторые клеточные взаимодействия, наблюдаемые in vivo. В связи с этим некоторые исследователи предпочитают использовать клеточные системы, сохраняющие структурную целостность исходной ткани.
Слайд 7
Список типов клеток, которые уже введены в культуру,
достаточно велик. Это элементы
соединительной ткани человека (фибробласты),
скелетные
ткани (кость и хрящи),
скелетные, сердечные и гладкие мышцы,
эпителиальные ткани (печень, легкие, почки и др.),
клетки нервной системы,
эндокринные клетки (надпочечники, гипофиз,
клетки островков Лангерганса),
меланоциты и различные опухолевые клетки.
Слайд 8
Свежевыделенные культуры носят название первичных культур до начала

пассирования или субкультивирования. Клетки первичной культуры обычно гетерогенны и
характеризуются низкой пролиферацией. В них наиболее полно представлены типы клеток той ткани, откуда они были получены.
Пассирование обеспечивает возможность продления существования культуры, возможность клонирования, исследования и сохранения свойств клеток. При этом получаются более однородные популяции, а также теряются специализированные клетки. После нескольких пересевов линия клеток либо гибнет, либо трансформируется и становится постоянной клеточной линией. Свойством "бессмертности" обладают в основном клетки, полученные из опухолей. Появление постоянной линии клеток констатируется по морфологическим изменениям (уменьшение размера клеток, снижение их адгезивности, округление, увеличение ядерно/цитоплазматического отношения, по увеличению скорости роста (время удвоения клеток в культуре снижается с 36 - 48 до 12 - 36 часов), по снижению зависимости от сыворотки, по увеличению эффективности клонирования, по снижению зависимости от субстрата, по увеличению гетероплоидности (хромосомные различия между клетками) и анеуплоидности и по увеличению опухолеродности. Нормальные клетки могут трансформироваться в постоянную линию, не становясь при этом злокачественными.
Слайд 9
Системы культивирования клеток
Существует 2 основных системы культивирования клеток:
непроточные и проточные культуры
1. Непроточные культуры - тип
культур, в котором клетки вводят в фиксированный объем среды. По мере роста клеток происходит использование питательных веществ и накопление метаболитов, поэтому среда должна периодически меняться, что приводит к изменению клеточного метаболизма, называемого еще и физиологической дифференцировкой. Со временем, в результате истощения среды происходит прекращение пролиферации клеток.
Слайд 10
Увеличить продолжительность жизни непроточных культур можно несколькими способами:
прерывистый (часть культуры заменяется равным объемом свежей среды);
постоянный (объем
культуры увеличивается с постоянной низкой скоростью, а небольшие порции клеток периодически удаляются);
перфузионный (осуществляется постоянное поступление свежей среды в культуру и одновременное удаление равного объема использованной (бесклеточной) среды). Перфузия может быть открытой, когда из системы удаляется вся среда, и закрытой, когда удаляемая среда проходит через дополнительный сосуд, где восстанавливается ее рН и осуществляется аэрирование, и возвращается в культуральный сосуд.
Все системы непроточных культур характеризуются накоплением отходов в той или иной форме и непостоянством внешних условий.
Слайд 11
2. Проточные культуры обеспечивают истинные гомеостатические условия без
изменения концентрации питательных веществ и метаболитов, а также числа
клеток. Гомеостаз обусловлен постоянным вхождением среды в культуру и одновременным удалением равного объема среды с клетками. Такие системы пригодны для суспензионных культур и монослойных культур на микроносителях.
Слайд 12
Существует 2 крупных направления в культивировании животных клеток:

монослойные культуры и суспензионные культуры.
Суспензионные культуры предпочтительнее с точки
зрения увеличения выхода клеток.
Монослойные культуры также обладают рядом преимуществ:
1. Легко провести полную замену среды и промыть клетки перед добавлением свежей питательной среды. Это важно в тех случаях, когда рост клеток идет в одних условиях, а наработка продукта в других условиях, например при переносе клеток из среды с сывороткой в бессывороточную среду. Можно также полностью удалять нежелательные компоненты.
2. Позволяют обеспечить высокую плотность клеток.
3. У многих клеток экспрессия требуемого продукта идет эффективнее, если клетки прикреплены к субстрату.
4. Монослойные культуры могут быть использованы для любого типа клеток, что обеспечивает наибольшую гибкость исследований.
5. В некоторых случаях, например для распространения вирусов, требуются тесные межклеточные контакты.
Недостатками монослойных культур являются:
требования большого пространства;
возрастание стоимости и трудоемкости при увеличении масштаба;
недостаточно эффективный контроль, обусловленный трудностями отбора пробы;
сложности в определении и контролировании рН, концентрации кислорода.
Слайд 14
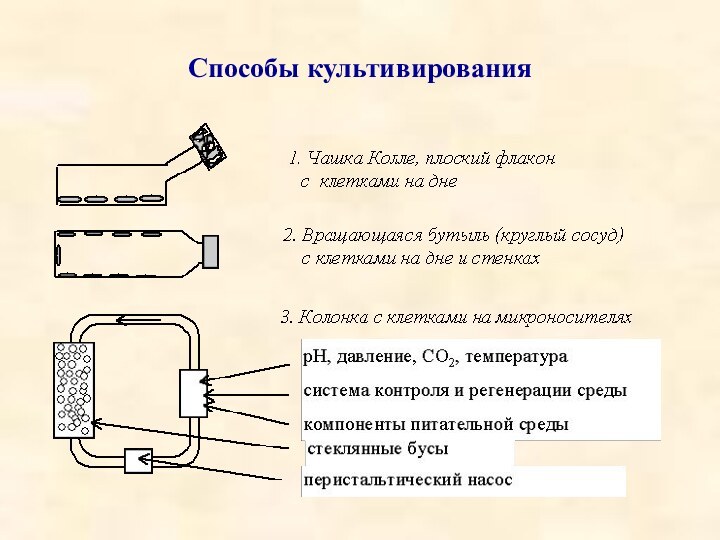
1. Культивирование в плоских флаконах (матрацах).
2. Культивирование
во вращающихся бутылях, когда в каждый момент времени 15-20%
поверхности бутыли покрыто питательной средой, а клетки находятся попеременно то в среде, то в воздухе.
3. Культивирование в колонках на микроносителях, в качестве которых выступают плотно упакованные, не смещающиеся стеклянные бусы диаметром 35 мм, стопка пластин и др., а питательная среда омывает их, протекая сверху вниз
Слайд 15
Использование культуры клеток человека
Практически любые клетки человека могут
быть введены в культуру и служить средством и объектом
во многих медико-биологических исследованиях. Одно из важнейших преимуществ клеток в культуре - возможность прижизненного наблюдения за ними с помощью микроскопа. Немаловажно и то, что культуры клеток к ряде случаем могут быть равноценной заменой клинических экспериментов, для которых потребовалось бы участие добровольцев. Эксперименты, требующие для выяснения того или иного вопроса использования 1000 человек, могут быть с равной статистической достоверностью поставлены на 100 культурах на покровных стёклах.
Слайд 16
Благодаря культивированию клеток возможности исследования и диагностики расширяются
почти беспредельно, так как имеется возможность оценки не только
морфологических и биохимических изменений, но и изменений в поведении клеток, их реакции на различные агенты, в том числе и на лекарственные воздействия.
- Поскольку клетки в культуре легко доступны для различных биохимических манипуляций, то при работе с ними радиоактивные предшественники, яды, гормоны и другие агенты могут быть введены в заданной концентрации и в течение заданного периода.
- Исчезает опасность того, что исследуемое соединение метаболизируется печенью, запасается мышцами или экскретируется почками.
- При использовании клеточных культур, как правило, легко установить время контакта исследуемого вещества с клетками, изменение его концентрации в течение данного периода времени. Это обеспечивает получение реальных значений скорости включения или метаболизма исследуемых соединений.
Слайд 17
Клеточные линии применяют для тестирования и изучения механизма
действия различных веществ, которые могут быть использованы в качестве
лекарственных препаратов, детергентов, косметических средств, инсектицидов, консервантов. Результаты, полученные на клеточных культурах, нельзя экстраполировать на целый организм, но если изучаемое вещество оказывает повреждающее действие в нескольких линиях культивируемых клеток, то следует ожидать от неблагоприятного эффекта и на организм человека.
Кроме того, если в ряду поколений воспроизводится дефект, свойственный клеткам in vivo, значит это дефект наследственный. Благодаря возможностям генной инженерии изменение генотипа клеток стало реальностью. Мы можем выделить из организма мутантые клетки, заменить in vitro дефектные гены, получить линию здоровых генно-модифицированных клеток и ввести их опять в организм.
Слайд 18
Наибольшее распространение получили культуры фибробластов. Широкое использование фибробластов
для изучения патогенеза и диагностики наследственных болезней обусловлено не
только
легкостью их культивирования, но и тем, что соединительная ткань, главным клеточным элементом которой являются фибробласты, составляет значительную часть массы тела.
Кроме того, фибробласты составляют строму многих органов, являются важными участниками их морфогенеза и создают условия микроокружения, необходимого для дифференцировки и функционирования специализированных клеток.
В фибробластах имеется фермент моноаминоксидаза, изменения активности которого характерны для некоторых нервных и психических заболеваний.
Фибробласты содержат рецепторы к глюкокортикоидным гормонам, инсулину, некоторым нейромедиаторам.
Слайд 19
Гринбергом в 1978 году была доказана возможность экстраполяции
данных, полученных на культивируемых фибробластах, на условия in vivo.
Во-первых, фибробласты in vitro сохраняют важнейшие черты, свойственные клеткам в организме, а также онтогенетические и индивидуальногенотипические свойства организма-донора.
Во-вторых, не существует другого такого типа клеток, который в полной мере мог бы представлять свойства клеток организма.
В-третьих, изменения, которые возникают при введении фибробластов в культуру, можно легко контролировать и свести к минимуму при создании соответствующих условий.
Все вышеперечисленное также способствует использованию фибробластов для изучения клеточных, биохимических, молекулярных аспектов патогенеза ряда болезней, в том числе и связанных с наследственными дефектами нервной системы.
Слайд 20
Для получения культуры клеток и тканей беспозвоночных используют

эмбрионы, имагинальные диски и органы насекомых, гомоциты, яичники, жировые
тела:
имагинальные диски (зачатки взрослых органов насекомых) используют для изучения процессов дифференцировки in vitro;
эмбрионы с удаленной оболочкой используют для изучения начальных стадий развития насекомых;
отдельные органы для различных целей, например, слюнные железы Diptera (мух) - для изучения процессов пуффирования в политенных хромосомах (пуф вздутие хромосом при "включении" ДНК на транскрипцию, когда определенные участки ее раскручиваются и РНК-синтезирующие ферменты начинают синтез РНК; при линьке насекомых пуфы появляются в определенной последовательности)
Лучшие источники для получения культивируемых клеток - личинки и куколки насекомых.
Методика получения первичных культур клеток насекомых достаточно отработана. Она включает следующие этапы: стерилизация поверхности насекомых и подлежащих культивированию тканей; диссоциация клеток; пересадка их на питательную среду.
Срок жизни первичных клеточных культур ограничен. Через определенное время культура стареет, что проявляется в грануляции цитоплазмы, сморщивании и округлении клеток, потери связей между клетками и твердым субстратом.
Слайд 22
Первые исследования в области культивирования органов и тканей
относятся к концу прошлого века. Уже в 1897 году
немецкий ученый Лёб (В.Loeb) опубликовал данные о культивировании фрагментов печени, почек, щитовидной железы и яичников кролика на небольших кровяных сгустках в культуральных пробирках. Дальнейшие исследования показали, что для предотвращения центральных некрозов в эксплантах пробирки должны быть заполнены кислородом. В результате многочисленных экспериментов было также установлено, что большинство органов или их фрагментов, за исключением кожи, растут на твердом субстрате лучше, чем в жидкой среде.
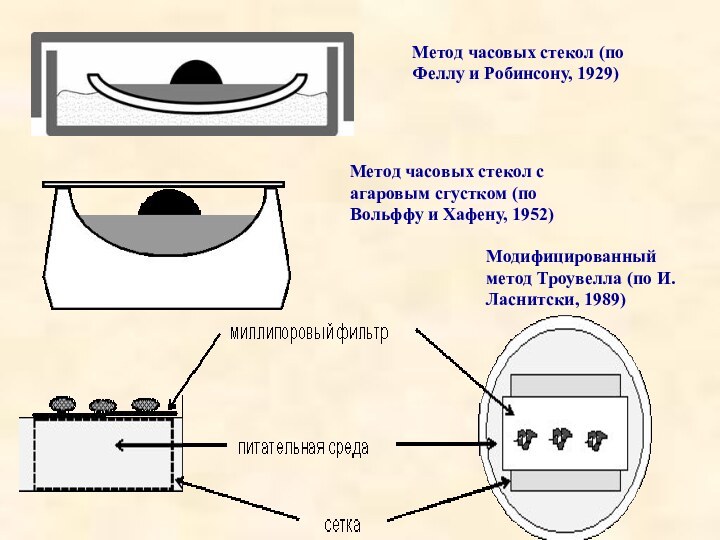
Что же можно использовать в качестве субстрата? Существует несколько видов техники культивирования органов. В качестве субстрата можно использовать сгусток плазмы. Этот способ был предложен Феллом и Робинсоном и получил название "техника часового стекла", став классической техникой морфогенетического анализа эмбриональных органов.
Слайд 23
Метод часовых стекол (по Феллу и Робинсону, 1929)
Метод часовых стекол с агаровым сгустком (по Вольффу и
Хафену, 1952)
Модифицированный метод Троувелла (по И. Ласнитски, 1989)
Слайд 25
История метода
Предположение о том, что соматические клетки могут

сливаться друг с другом, было высказано еще в начале
ХIX века в связи с открытием многоядерных клеток. В историческом аспекте представляет интерес то обстоятельство, что открытие поликарионов как бы подтверждало ошибочное представление Шлейдена, который считал, что новые клетки зарождаются в виде пузырьков внутри цитоплазматической мембраны родительских клеток. Разделявший эту точку зрения Рудольф Вирхов представил в 1851 г. рисунок многоядерной опухолевой клетки в полной уверенности, что ядра являются эндогенными зачатками новых клеток. Кроме того, открытие поликарионов подлило масла в огонь борьбы с клеточной теорией. Противники ее выдвинули гипотезу, согласно которой организм представляет собой единую тканевую массу с непрерывной цитоплазмой, а существование поликарионов рассматривали как подтверждение этой гипотезы. Со временем восторжествовала клеточная теория, а существование поликарионов отнесли к разряду интересных исключений.
Слайд 26
Гибриды соматических клеток были открыты лишь в 60-х
годах нашего столетия. В 1960 г. Барский с сотрудниками
сообщили о выделении линии гибридных клеток. Гибридные клетки были получены путем смешения двух линий, выделенных ранее из 1 клетки мышиной саркомы. Исходные линии отличались по числу и морфологии хромосом, а также по способности к образованию опухоли при введении их мышам. Гибридные клетки
содержали число хромосом, отличное от исходных клеточных линий, а также
содержали поверхностные антигены клеток обеих родительских линий.
Далее было установлено, что клеточные гибриды можно получить, используя клетки различных видов животных. В качестве агента, индуцирующего слияние выступал инактивированный вирус HVJ, называемый также вирусом Сендай. С этих пор вирус Сендай стал широко использоваться в экспериментах по слиянию клеток.
Слайд 27
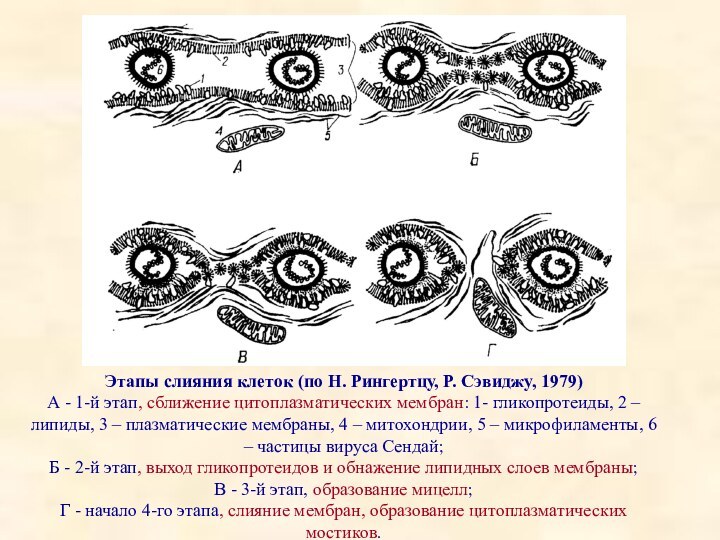
Этапы слияния клеток (по Н. Рингертцу, Р. Сэвиджу,
1979)
А - 1-й этап, сближение цитоплазматических мембран: 1- гликопротеиды,
2 – липиды, 3 – плазматические мембраны, 4 – митохондрии, 5 – микрофиламенты, 6 – частицы вируса Сендай;
Б - 2-й этап, выход гликопротеидов и обнажение липидных слоев мембраны;
В - 3-й этап, образование мицелл;
Г - начало 4-го этапа, слияние мембран, образование цитоплазматических мостиков.
Слайд 28
При изучении межвидовых гибридных клеток, способных к пролиферации

были сделаны два очень важных наблюдения:
- в гибридах
могут проявиться оба генома;
- в долгоживущих межвидовых гибридах элиминируются хромосомы одного вида.
Слияние клеток не обязательно должно быть чем-то стимулировано. Как in vivo, так и in vitro оно может проходить и без добавления специальных агентов
В естественных условиях слияние клеток происходит и у млекопитающих. Например, клетки могут сливаться при формировании мышечных трубочек. Еще в XIX веке было показано, что миофибриллы поперечно-полосатых мышц образуются в поликарионах - крупных удлиненных многоядерных клетках. Поликарионы - продукт слияния одноядерных миобластов. Слияние опухолевых клеток - довольно обычное явление, при этом опухолевые клетки in vivo иногда сливаются и с нормальными. Эксперименты по спонтанному слиянию клеток проводились и in vitro. При проведении подобных экспериментов получают так называемых "химерных" или аллофеных мышей - животных, в тканях которых содержатся клетки различных генотипов
Слайд 30
Методы создания химер
1. Агрегационный - был предложен практически

одновременно и независимо друг от друга Тарковским в Варшаве
и Минц в Филадельфии (1961-1962 гг.).
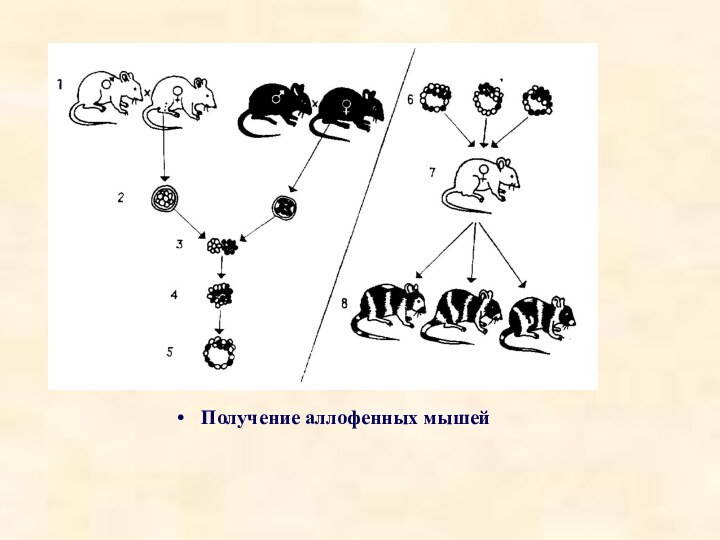
Из матки беременных самок-докторов извлекают зародыши, достигшие стадии 8 бластомеров. Бластомеры, полученные от двух животных с различными генотипами (например, от мышей с белой черной окраской шерсти) помещают в условия, способствующие их агрегации и образованию 16-ти клеточного зародыша. Такие составные зародыши развиваются in vitro до стадии бластоцисты, после чего их вводят в матку приемной матери, у которой предварительно вызывают ложную беременность путем введения соответствующих гормонов. В результате получаются аллофенные мышата. Когда у мышонка появляется шерсть, окраска у него оказывается не белой или черной, как у родителей, а смешанной, с чередующимися черными и белыми пятнами или полосами. Это доказывает, что ткани животных-химер мозаичны, т.е. состоят из "белых" и "черных" клеток. Внутренние ткани таких животных, естественно, также мозаичны, хотя это проявляется не так очевидно, как в случае окраски шерсти. Различия могут касаться белков, выполняющих ферментативную функцию: они могут катализировать одни и те же реакции у мышей-родителей, нуждаться в одних и тех же кофакторах, но при этом быть не идентичными, хотя и сходными. Такие белки называются изоферментами, и их можно разделить с помощью электрофореза. Агрегационные химеры можно получать не только между двумя эмбрионами, но и между различным числом изолированных бластомеров или отдельными частями эмбрионов. Масса химерных эмбрионов не больше обычной и подвержена действию механизмов эмбриональной регуляции. Преимущество метода - не требует вмешательства микрохирургической техники, поэтому широко используется в эмбриогенетике.
Слайд 31
2. Инъекционный - был разработан Р. Гарднером в

1968 г.
Используются эмбрионы на стадии бластоцисты. Бластоцисту фиксируют
и, используя микроманипуляторы, вводят путем инъекции клетки внутриклеточной массы бластоцисты доноров в бластоцель эмбриона - рецепиента. Этим методом можно инъецировать не только внутриклеточную массу ранних эмбрионов, но и более дифференцированные клетки.
Инъекционный метод нашел применение при получении межвидовых химер. Первые межвидовые химеры были получены между двумя ближайшими видами мышей, которые обычно не скрещиваются: M. musculus и M. caroli. Причем было отмечено, что химерные эмбрионы, полученные инъекционным методом, нормально развивались только при пересадке их в матку того вида, чья бластоциста была использована в качестве рецепиента. Например, в бластоцисту M. musculus вводили внутриклеточную массу эмбриона M. caroli. Полученные химеры имплантировались в матку M. musculus и благополучно развивались там, а в организме M. caroli погибали спустя две недели.
Межвидовые химерные зародыши между мышью и крысой путем агрегации были получены только в 70-х годах. Первые химерные животные были получены только в 1973 году Р. Гарднером и М. Джонсоном. Успех этих экспериментов позволил приступить в 80-х годах к созданию химерных сельскохозяйственных животных. Выяснилось, что агрегационный метод неприемлем для получения химер крупного рогатого скота. Химер телят Bos indicus + Bos taurus удалось получить только инъекционным методом.
Слайд 32
В 1984 году были получены межвидовые химеры между

овцой и козой - овцекозы, причем практически одновременно в
Англии и ФРГ. Использовались оба метода. Половым путем овцы и козы не скрещиваются, они имеют разный набор хромосом: коза 2n = 60, овца 2n = 54. В ФРГ в 1985 году были получены химерные телята после агрегации половинок 32-клеточных эмбрионов от коров швицкой (бурой) и голштино-фризской пород. В фенотипе химер сочетались обе масти - бурая и черно-пестрая.
Химерные животные не передают потомкам генетическую мозаичность. У них происходит расщепление, как у гетерозигот, поэтому ценные генетические комбинации нарушаются. Но на протяжении 1 поколения хозяйственно ценные признаки поддерживаются, поэтому можно, например, сочетать как молочную, так и мясную продуктивность.
Химерность довольно часто встречается и у растений. Как правило, она существует в скрытом виде, не проявляясь фенотипически. Однако пластидные мутации позволяют увидеть ее непосредственно на растении. Чаще всего спонтанная химерность наблюдается у гетерозиготных растений. Различные клеточные типы четко разделены в пространстве, образуя отдельные слои при делении апикальных меристем. Примером видимой мутации хлоропластов и образования химерного растения является пестролистность или появление секторов ткани другого цвета.
Слайд 34
Функциональная структура антител
Слияние клеток лежит в основе получения

гибридных клеток, продуцирующих антитела. Антитела - белки сыворотки крови,
которые синтезируются в организме как проявление защитной реакции при попадании в него чужеродного вещества (антигена). Иммунная система вырабатывает специфические антитела на огромное множество антигенов. В основе такой способности лежит наличие большого многообразия клонов лимфоцитов, каждый из которых вырабатывает антитела с узкой специфичностью. В совокупности называемые иммуноглобулинами (Ig), антитела составляют один из главных белковых компонентов крови - по весу около 20% суммарного белка плазмы.
В качестве антигенов выступают различные вещества: клетки микроорганизмов, вирусы, белки, нуклеиновые кислоты, в некоторых случаях низкомолекулярные вещества типа антибиотиков или пестицидов. Антитела образуются не против всей молекулы белка или бактериальной клетки, а только к небольшим участкам на их поверхности, получивших название антигенных детерминант. В случае белковой молекулы антигенной детерминантой являются участки поверхности, содержащие около 5 аминокислотных остатков.
Слайд 35
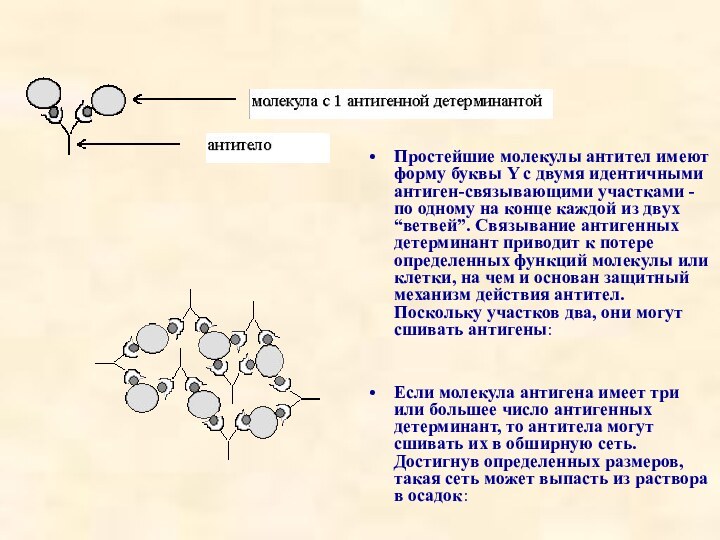
Простейшие молекулы антител имеют форму буквы Y с
двумя идентичными антиген-связывающими участками - по одному на конце
каждой из двух “ветвей”. Связывание антигенных детерминант приводит к потере определенных функций молекулы или клетки, на чем и основан защитный механизм действия антител. Поскольку участков два, они могут сшивать антигены:
Если молекула антигена имеет три или большее число антигенных детерминант, то антитела могут сшивать их в обширную сеть. Достигнув определенных размеров, такая сеть может выпасть из раствора в осадок:
Слайд 36
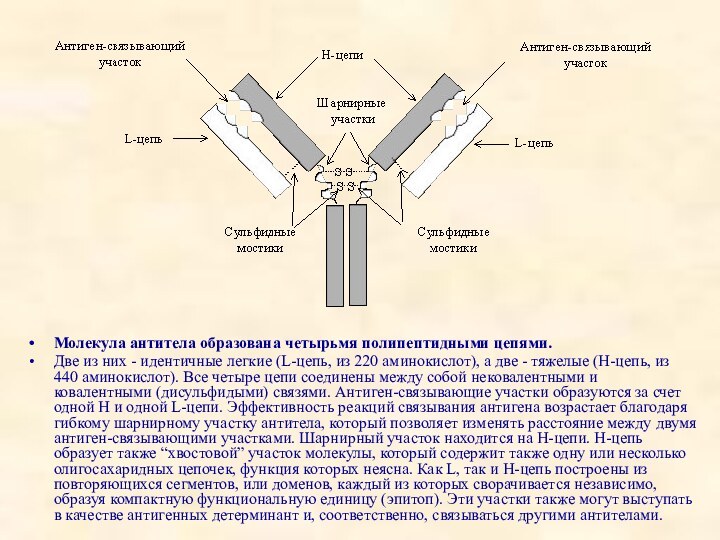
Молекула антитела образована четырьмя полипептидными цепями.
Две из них
- идентичные легкие (L-цепь, из 220 аминокислот), а две
- тяжелые (H-цепь, из 440 аминокислот). Все четыре цепи соединены между собой нековалентными и ковалентными (дисульфидыми) связями. Антиген-связывающие участки образуются за счет одной H и одной L-цепи. Эффективность реакций связывания антигена возрастает благодаря гибкому шарнирному участку антитела, который позволяет изменять расстояние между двумя антиген-связывающими участками. Шарнирный участок находится на H-цепи. H-цепь образует также “хвостовой” участок молекулы, который содержит также одну или несколько олигосахаридных цепочек, функция которых неясна. Как L, так и Н-цепь построены из повторяющихся сегментов, или доменов, каждый из которых сворачивается независимо, образуя компактную функциональную единицу (эпитоп). Эти участки также могут выступать в качестве антигенных детерминант и, соответственно, связываться другими антителами.
Слайд 37
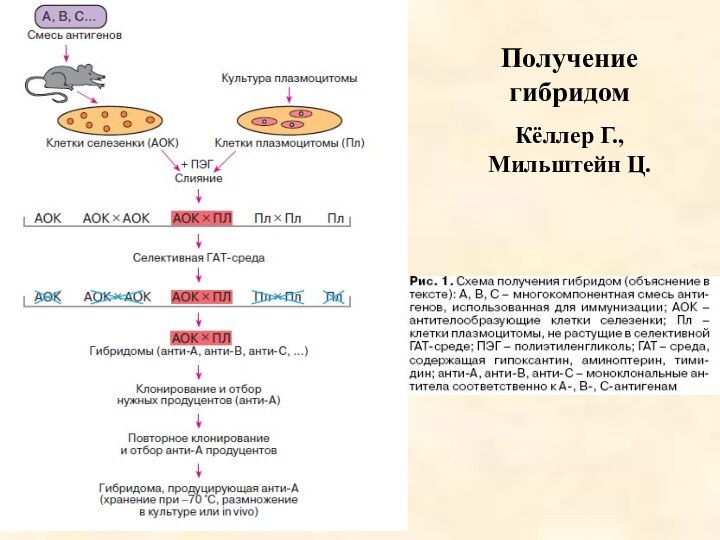
Получение моноклональных антител
Решение проблемы было предложено в 1975

году английскими учеными Георгом Кёлером и Цезарем Мильштейном. Они
разработали методику получения клеточных гибридов - гибридом. Гибридомы образуются в результате слияния лимфоцитов, взятых от иммунизированных животных, с клетками миеломы костного мозга, культивируемыми in vitro.
Животное иммунизируют, в ответ на введение антигена в организме мыши активизируются продуцирующие антитела В-лимфоциты. Эти клетки могут жить только в организме хозяина, при переводе на искусственную питательную среду они гибнут. Если слить иммунную клетку с опухолевой, образуются гибридные клетки, способные неограниченно долго жить в искусственных средах. Одновременно они сохраняют способность синтезировать антитела.
Гибридомы, синтезирующие определенные виды антител, отбирают на селективных ростовых средах. Затем их помещают в культуральную жидкость, в которой они размножаются и образуют много родственных клеток (клон). Такие клоны могут синтезировать антитела, получившие название моноклональных (МКА). МКА - антитела, однородные по структуре и специфичности, которые можно производить в неограниченных количествах.
Слайд 38
Получение гибридом
Кёллер Г., Мильштейн Ц.
Слайд 39
Другой метод получения антител основан на инъекции полученной
гибридомы в брюшную полость мышки. Там гибридома реплицируется и
вызывает образование асцитной опухоли (скопления клеток, плавающих в жидкости, заполняющей брюшную полость). Асцитная жидкость, выделенная из этой мыши, представляет суспензию, содержащую антитела. Клетки и белки, не относящиеся к МКА, удаляются. Оставшийся материал, представленный преимущественно антителами, используют. Этот метод позволяет получать высококонцентрированные препараты антител. Но массовое производство требует одновременного использования нескольких тысяч мышей. Кроме того, получаемый материал требует доочистки. Это дорого и трудоемко, поэтому в настоящее время предпочтение отдается первому способу, с использованием культуры клеток.
Слайд 40
Методы анализа: иммуноферментный (ИФА), иммунолюминесцентный, иммунорадиологический
Высокая специфичность антител
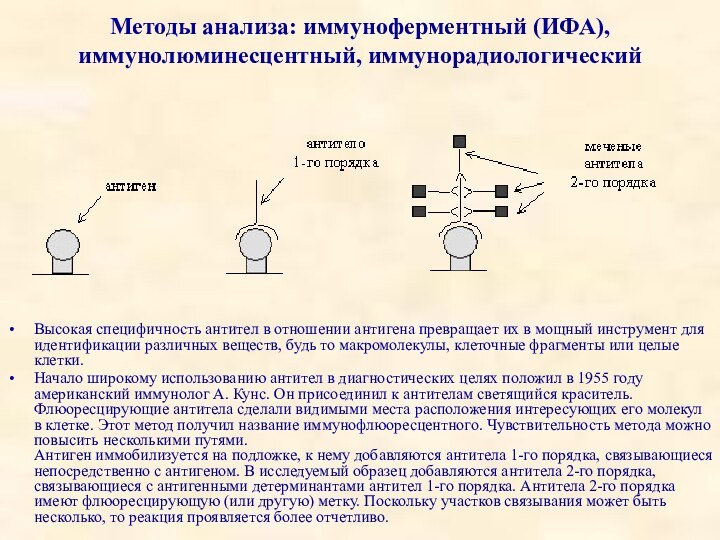
в отношении антигена превращает их в мощный инструмент для
идентификации различных веществ, будь то макромолекулы, клеточные фрагменты или целые клетки.
Начало широкому использованию антител в диагностических целях положил в 1955 году американский иммунолог А. Кунс. Он присоединил к антителам светящийся краситель. Флюоресцирующие антитела сделали видимыми места расположения интересующих его молекул в клетке. Этот метод получил название иммунофлюоресцентного. Чувствительность метода можно повысить несколькими путями.
Антиген иммобилизуется на подложке, к нему добавляются антитела 1-го порядка, связывающиеся непосредственно с антигеном. В исследуемый образец добавляются антитела 2-го порядка, связывающиеся с антигенными детерминантами антител 1-го порядка. Антитела 2-го порядка имеют флюоресцирующую (или другую) метку. Поскольку участков связывания может быть несколько, то реакция проявляется более отчетливо.
Слайд 41
Другая система усиления сигнала основана на высоком сродстве
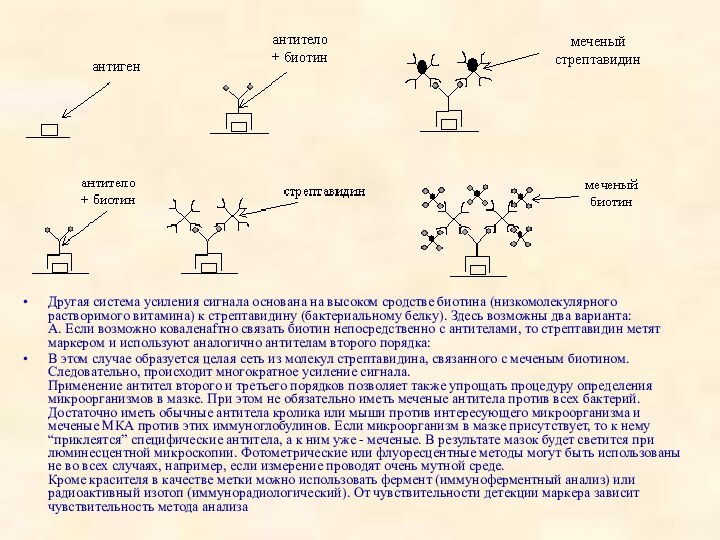
биотина (низкомолекулярного растворимого витамина) к стрептавидину (бактериальному белку). Здесь
возможны два варианта:
А. Если возможно коваленafтно связать биотин непосредственно с антителами, то стрептавидин метят маркером и используют аналогично антителам второго порядка:
В этом случае образуется целая сеть из молекул стрептавидина, связанного с меченым биотином. Следовательно, происходит многократное усиление сигнала.
Применение антител второго и третьего порядков позволяет также упрощать процедуру определения микроорганизмов в мазке. При этом не обязательно иметь меченые антитела против всех бактерий. Достаточно иметь обычные антитела кролика или мыши против интересующего микроорганизма и меченые МКА против этих иммуноглобулинов. Если микроорганизм в мазке присутствует, то к нему “приклеятся” специфические антитела, а к ним уже - меченые. В результате мазок будет светится при люминесцентной микроскопии. Фотометрические или флуоресцентные методы могут быть использованы не во всех случаях, например, если измерение проводят очень мутной среде.
Кроме красителя в качестве метки можно использовать фермент (иммуноферментный анализ) или радиоактивный изотоп (иммунорадиологический). От чувствительности детекции маркера зависит чувствительность метода анализа
Слайд 42
Радиоактивные метки.
Выбор маркера и способа его «привязки» к

антигену является одним из важных этапов в проведении анализа.
Первоначально широко применялись радиоизо тонные метки (радиоиммунный анализ - РИА), предложенные американскими исследователями (С. А. Берсон, Р. С. Ялоу, 1959). Однако в последние годы все более широкое использование в Качестве маркеров находят ферменты. Это обусловлено рядом принципиальных трудностей, связанных с применением изотопныx маркеров. Так, изотоп 125I имеет время полураспада 60 суток, чем ограничивается срок его использования. Изотоп 3Н имеет длительное время жизни (12.5 лет), однако под действием бэта-излучения происходит распад молекул антигена, в результате чего время жизни меченых 3Н-соединений тоже ограничено. Кроме того, эффективность счета трития существенно ниже, чем 125I. Ограничивающими факторами РИА являются сложность и высокая стоимость оборудования, необходимость централизованной системы распределения иммунохимических наборов, меченных радиоактивными изотопами, определенная опасность изотопов для окружающей среды. Учитывая трудности использования ра¬диоизотопных меток, были предложены в качестве маркеров ферменты.
Слайд 43
Применение моноклональных антител (МКА)
Наиболее широко используются моноклональные антитела

в медицинской диагностике. Разработаны сумки-укладки для постановки диагнозов. Если
к антителами присоединить радиоактивные или магнитоактивные материалы и ввести их в живой организм, то можно выявить в нем патологические зоны. Такие МКА присоединяются к пораженным болезнью клеткам организма, а соответствующие индикаторные материалы позволяют выяснить их местонахождение.
МКА используются и в процессах очистки веществ. Современные технологии основаны на присоединении антител к твердой матрице носителя. К ним добавляют смесь молекул, содержащую искомый антиген. Затем комплексы антиген - антитело отмываются от примесей, не связанных с матрицей. После разрушения ковалентных связей антиген - антитело в растворе остаются свободные антигены.
Если получить антитела определенного типа и иммунизировать ими животное, то образуются анти-антитела (анти-идиотипные антитела). Они действуют на иммунную систему как псевдоантиген и поэтому могут быть использованы для ее стимуляции. На этом принципе основано получение вакцин нового типа. Наборы МКА могут быть также предназначены для борьбы с аллергенами.
Слайд 44
4. Моноклональные антитела и “мишенная”
лекарственная терапия. Предполагается, что большое разнообразие раковых заболеваний обусловлено
активацией эндогенных генов, вызванной химическими агентами, внутренними хромосомными перестройками. Эти гены кодируют определенные белки, и поэтому раковые клетки могут содержать уникальные белки на поверхности клетки. Возможно, именно эти белки участвуют в супрессии роста здоровых клеток. Инактивируя эти белки, можно тормозить рост раковых клеток.
5. Благодаря высокий специфичности МКА широко используются в качестве зондов для точного определения природы молекул поверхности клеток и клеточных органелл. С их помощью также можно проводить детекцию активности ферментов.
6. Методы иммуноферментного анализа применяют в диагностике вирусных заболеваний растений. Это позволяет сократить время получения безвирусного посадочного материала, отбирать новые вирусоустойчивые сорта. При генно-инженерных экспериментах можно быстро отбирать клоны - продуценты.
Слайд 47
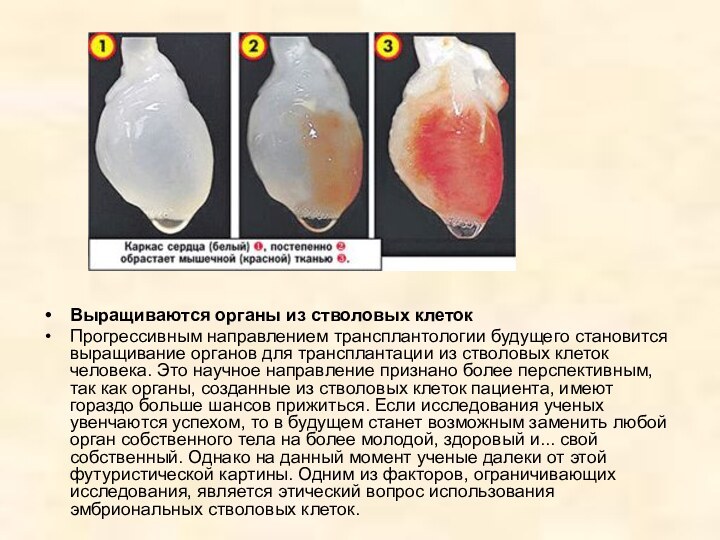
Искусственные сосуды выращиваются из кожи пациентов
Специалисты американской

биотехнологической компании Cytograph Tissue Engineering разработали и опробовали технологию
выращивания искусственных кровеносных сосудов из клеток пациента, которому их предстоит имплантировать. Первые клинические испытания новой технологии успешно прошли в Аргентине и Великобритании.
Искусственные сосуды требуются, например, при операциях шунтирования для обхода поврежденного сосуда. До сих пор искусственные сосуды удавалось выращивать только на искусственном каркасе из пластика. Но такие сосуды не обладают необходимой гибкостью, чтобы реагировать на перепады кровяного давления. Кроме того, чужеродный материал может вызвать воспаление, иммунное отторжение и даже привести к образованию тромбов.
Для этого из кожи берут незрелые клетки соединительной ткани — фибробласты, — помещают их в чашки Петри и выращивают тонкие листы ткани размером с почтовую открытку. Таким листом оборачивают трубку диаметром как у соломинки для коктейля, после чего трубку вынимают, а полученную заготовку сосуда заселяют изнутри клетками эндотелия, которые выстилают внутреннюю поверхность кровеносных сосудов.
Слайд 48
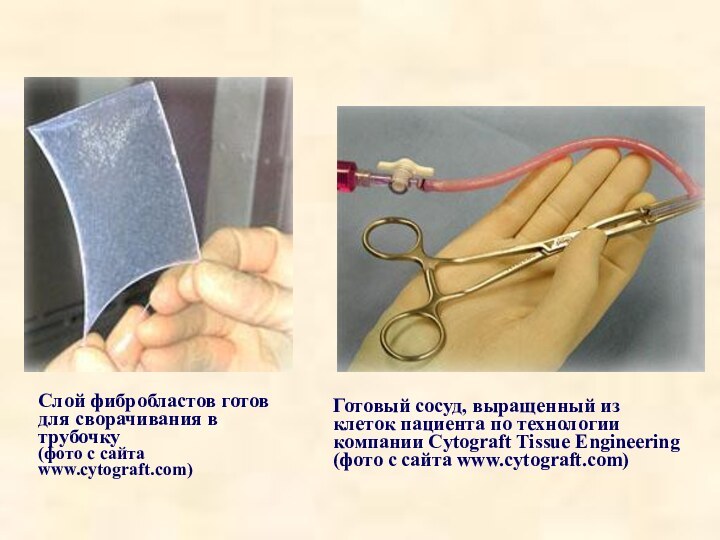
Готовый сосуд, выращенный из клеток пациента по технологии
компании Cytograft Tissue Engineering (фото с сайта www.cytograft.com)
Слой
фибробластов готов для сворачивания в трубочку
(фото с сайта www.cytograft.com)
Слайд 49
Клетки мозга удалось вырастить в чашке Петри
Сотрудникам
Макнайтовского института мозга при Университете Флориды удалось разработать метод
выращивания мозговых клеток в лабораторных условиях.
В своей заметке, опубликованной 13 июня в журнале Proceedings of the National Academy of Sciences, авторы исследования утверждают, что в перспективе разработанный ими метод позволит создать «неисчерпаемый» источник донорских мозговых клеток, необходимых для лечения таких неприятных заболеваний, как болезнь Паркинсона и эпилепсия. Правда, как сообщается в пресс-релизе Университета Флориды, пока речь идет только о клетках мышиного мозга.
Зато группе доктора Денниса Штайндлера удалось найти источник так называемых «настоящих» стволовых клеток, необходимых для инициации процесса нейрогенезиса (порождения новых клеток мозга), бурно происходящего в раннем детстве и «тлеющего» во взрослом мозге.
Слайд 50
Исследователи обратили внимание на то, что механизм воспроизводства

мозговых клеток очень близок к механизму кроветворения (hematopoiesis; вторая
часть слова — «poiesis» — от «творить»). Соответственно, метод генерации новых мозговых клеток, кстати, очень близкий к уже существующему методу искусственного «выращивания крови», назван ими «нейротворением» (neuropoiesis).
В ходе проведенных группой Штайндлера экспериментов ученые использовали клетки мышиного мозга, которые заставляли делиться с помощью специально подобранных химических веществ. Процесс деления клеток фиксировался на пленку в течение 30 часов с частотой 12 кадров в час методом микроскопии живой клетки (live-cell microscopy). Благодаря использованию этого метода ученые получили возможность не только полностью зафиксировать процесс перерождения стволовой клетки в полноценный нейрон, но и получить данные об изменении электрофизиологических параметров клетки.
Если технологию удастся довести до ума, то рано или поздно у больных, страдающих болезнью Паркинсона, Хантигтона и другими подобными расстройствами, появится шанс на выздоровление или, как минимум, на консервацию состояния: вышедшие из строя клетки можно будет заменять выращенными в чашке Петри, в качестве образцов для которых будут использоваться клетки мозга самого больного.
Слайд 51
Разорванный спинной мозг можно будет починить
В Медицинской

школе Пенсильванского университета отрабатывается на грызунах принципиально новый метод
восстановления позвоночника после тяжелых повреждений. Новая технология позволяет в искусственных условиях вырастить нервную ткань для восстановления разорванных связей внутри позвоночного столба.
Первый этап этой проверки уже удалось успешно пройти. «Кирпичик», пересаженный на место разрыва спинного мозга у крысы, благополучно прижился. По прошествии четырех недель после операции он продолжал сохранять свою форму, но, самое главное, с двух внешних торцов появились новые аксоны, которые преодолели коллагеновый барьер и проникли в нервную ткань поврежденного спинного мозга.
Следующим этапом работы станет проверка степени интеграции вновь созданного соединения с нервными тканями организма и его «прозвонка» — то есть измерение электропроводности. А дальше начнется самое интересное — предстоит выяснить, смогут ли у животных восстановиться двигательные функции.
Заранее ясно, что крысам придется заново учиться ходить, поскольку в любом случае нервные волокна срастутся не так, как они были соединены до повреждения. Но главное, чтобы связь вообще имела место и была достаточно стабильной. Тогда есть шанс, что мозг постепенно сможет приспособиться к новой конфигурации соединений.
Если эти проверки будут успешно пройдены, откроются принципиально новые возможности для восстановления двигательных функций у людей с тяжелыми повреждениями позвоночника.
Слайд 52
В питательную среду помещаются две тонкие пластины, покрытые

нервными клетками — нейронами из ганглиев дорсальных корешков крысы (группы
нейронов вне спинного мозга). Некоторое время им дают развиваться, дожидаясь, пока нейроны на разных пластинах установят между собой связи при помощи длинных отростков — аконов. Затем одну из пластин начинают очень медленно отодвигать.
Движение осуществляется при помощи шагового микроэлектродвигателя под управлением компьютера. Натяжение, возникающее при этом в аксонах, стимулирует их рост. Постепенно нейроны разделяются на две популяции, связанные густой сетью переплетающихся аксонов. За неделю расстояние между двумя пластинами достигает одного сантиметра.
Созданная живая трехмерная сеть нейронов переносится в коллагеновую матрицу, содержащую факторы роста, и сворачивается в форме крошечной студенистой трубочки. Приготовленный таким способом препарат готов к имплантации. Разработчики говорят о нем, как о «кирпичике нервной ткани» (nervous-tissue construct).
Как показали эксперименты, две популяции нейронов, соединенные длинным жгутом аксонов, сохраняют способность отращивать новые аксоны в двух направлениях — между собой вдоль жгута и в противоположную сторону, где после пересадки будет находиться спинной мозг пациента, что должно обеспечить восстановление разорванных нервных соединений. Однако это предположение, конечно, нуждается в экспериментальной проверке.
Процесс выращивания «кирпичика» нервной ткани (рис. Douglas H. Smith, MD, University of Pennsylvania School of Medicine)
Слайд 53
Выращена мышечная ткань с готовой кровеносной системой
Долгие
годы главным препятствием на пути создания работоспособной технологии выращивания
«запасных частей» для человека была невозможность воспроизведения в выращиваемом фрагменте собственной кровеносной системы, без которой мышца или любая другая искусственно созданная ткань быстро погибает. Сотрудникам Массачусетского технологического института, похоже, удалось взять этот барьер.
Слайд 54
Как сообщается в пресс-релизеКак сообщается в пресс-релизе института,

ученым из лабораторииКак сообщается в пресс-релизе института, ученым из
лаборатории профессора Роберта Лангера (Robert LangerКак сообщается в пресс-релизе института, ученым из лаборатории профессора Роберта Лангера (Robert Langer), удалось создать подходящий клеточный «коктейль», содержащий эндотелиальные клетки (клетки, выстилающие внутреннюю поверхность кровеносных и лимфатических сосудов, а также сердечных полостей), полученные из эмбриональных стволовых клеток человека. На основе этого «коктейля» можно выращивать полноценную мышечную ткань с собственной, готовой к подключению сосудистой системой. Предварительные опыты, проведенные на мышах и крысах, показали, что выращенная таким образом мышечная ткань приживается гораздо быстрее, чем «мертвая» мышца.
Как заявил коллега Лангера профессор педиатрии Дэниэл Кохане (Daniel Kohane), исследователей больше всего радует тот факт, что разработанная ими методика годится не только для выращивания скелетных мышц, но и для создания других сложных тканей.
По словам ведущего автора исследования Шуламит Левенберг, ныне преподающей в одном из израильских университетов, для создания васкуляризованной мышечной ткани ей необходимо было должным образом скомбинировать три вида клеток: миобласты — стволовые клетки из которых формируется мышечная ткань; эндотелиальные клетки, способные самоорганизовываться в сосудистые трубки; и фибробласты, из которых впоследствии развиваются гладки мышцы сосудов.
Подготовив для этих целей уникальные трехмерные «леса», способные обеспечить развитие сразу трех клеточных культур, госпожа Левенберг сумела подтвердить свою изначальную гипотезу: эндотелиальные клетки действительно сформировали кровяные русла, вошли в контакт с фибробластами и заставили их переродиться в гладкую мускулатуру. Перерожденные фибробласты, в свою очередь, выделили ген VEGF (vascular endothelial growth factor), который способствовал дальнейшему развитию кровеносных сосудов. Размеры полученного образца мышечной ткани составили 5 х 5 х 1 мм.
Первые же опыты по приживлению искусственно выращенной мышцы, проведенные на мышах и крысах, показали, что примерно 41% от общего объема ее кровеносного русла оказался заполненным кровью особи-реципиента. Очень неплохо для первого раза, утверждают исследователи.
Результаты опытов опубликованы 19 июня в журнале Nature Biotechnology.
Слайд 57
Регулирование воспроизводства сельскохозяйственных животных
Воспроизводство животных - это основной
фактор, лимитирующий эффективность производства животноводческих продуктов на промышленной основе.
Причины, препятствующие достижению оптимальных результатов в воспроизводстве домашнего скота различны. Новые методы расширяют возможности регулирования воспроизводства. Они связаны с манипулированием на уровне клеток или эмбрионов, с использованием физиологически активных соединений, поэтому названы биотехнологическими. К числу этих методов относят:
стимуляцию и синхронизацию охоты,
суперовуляцию, искусственное осеменение, трансплантацию эмбрионов,
хранение гамет и эмбрионов,
целенаправленное получение двоен,
регулирование пола,
раннюю диагностику беременности,
управление процессом родов,
создание химер и др.
Слайд 58
Суперовуляция
Потенциальные возможности воспроизводства самок млекопитающих огромны. В их
яичниках содержатся десятки и сотни тысяч овоцитов. Однако в
процессе онтогенеза лишь небольшая часть из них реализуется в виде потомков. Остальные овоциты подвергаются атрезии (обратному развитию) и воспроизводстве не участвуют.
Суперовуляция - состояние, вызванное гормонами, когда в яичниках животных развивается и овулирует в несколько раз больше яйцеклеток. В зависимости от вида число овулирующих яйцеклеток может быть увеличено в 3 - 8 и даже в 50 раз. С помощью этого приема становится возможным получение большего количества эмбрионов от лучших по продуктивности коров.
Слайд 59
Искусственное осеменение
Искусственное осеменение животных является самым старым и
хорошо отработанным биотехнологическим методом разведения сельскохозяйственных животных. Применение этого
метода позволяет ограничить распространение половых инфекций, которые нередко служат причиной бесплодия животных. Оно также позволяет эффективно использовать генетический потенциал лучших производителей. Экономический эффект от искусственного осеменения обусловлен снижением затрат на содержание большого поголовья производителей, возможностью быстрого размножения генотипа с хозяйственно - полезными признаками, улучшением генетического потенциала ремонтного стада
Слайд 60
Трансплантация эмбрионов
Трансплантация эмбрионов в настоящее время является одной

из наиболее актуальных проблем в области животноводства. С помощью
пересадки эмбрионов можно резко увеличить выход числа потомков от высокопродуктивных коров. Трансплантация эмбрионов, или эмбриотехнология, заключается в получении одного или нескольких эмбрионов из матки племенных животных (доноров) и пересадке в матку коров (рецепиентов), где эмбрионы развиваются до отела. Этот метод в сочетании с суперовуляцией у доноров позволяет получить большое потомство от высокопродуктивных животных. Этим способом эмбрионы можно внедрить в ту или иную породу в другие регионы, используя в качестве рецепиентов коров мясных пород. Применение этого метода также упрощает обмен генофондом сельскохозяйственных животных между странами и континентами. Пересадка эмбрионов может быть использована для получения потомства от ценных, но бесплодных коров, утративших способность к размножению в результате несчастного случая, болезни или по возрасту.
Слайд 61
Регулирование пола
В практике разведения животных очень важно научиться
управлять образованием в потомстве мужских и женских особей. Метод
разделения эмбрионов по полу основан на определении белков, специфичных для самцов. Этом метод широко применяется в животноводческой практике многих стран. В Канаде уже с 1975 года рождаются телята, разделенные по полу на стадии эмбрионов. В перспективе для целенаправленного получения особей мужского или женского пола может быть применен метод микрохирургической замены Х и У хромосом. Такие манипуляции уже проводились на растительных клетках и яйцеклетках земноводных.
Слайд 62
Современные вакцины
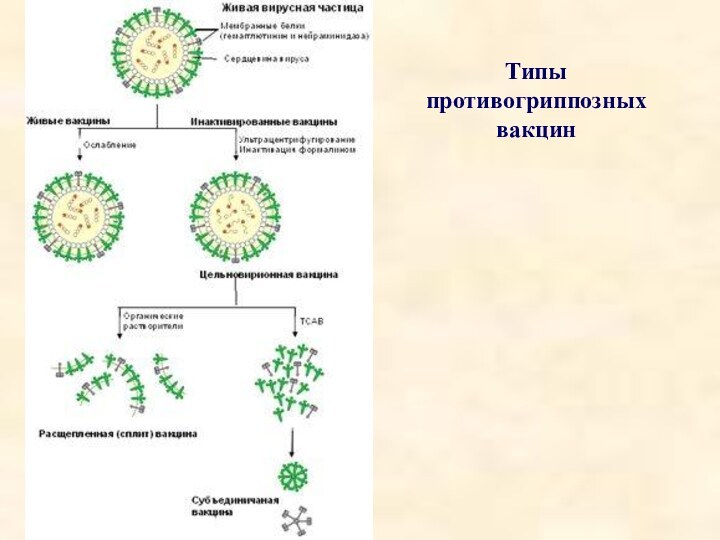
1. Цельновирионные и живые вакцины (вакцины
первого поколения)
Разработка гриппозных вакцин была начата в начале 40-х
годов под эгидой и при поддержке военного ведомства США, так как массовая заболеваемость во время эпидемий гриппа расценивалась как угроза боеспособности войск. Самые первые вакцины содержали в своем составе цельные вирусные частицы (живые аттенуированные и убитые инактивированные). Вакцины получали путем инактивации вируса (выращенного на куриных эмбрионах) формалином. Эффективность таких вакцин была достаточно высокая.
Слайд 63
2. Расщепленные (сплит) вакцины (второе поколение)
Применение диэтиловых эфиров
в качестве растворителей позволило раздробить липидную мембрану вируса на
части, что явилось основой для появления сплит- вакцин (split - англ. расщеплять) в 60-х годах.
Сплит-вакцины содержат частицы разрушенного вируса - поверхностные и внутренние белки. Изготавливается вакцина путем расщепления вирусных частиц при помощи органических растворителей или детергентов. Сплит-вакцины характеризуются значительно меньшим риском побочных реакций, предположительно в связи с разрушением пространственной структуры вируса.
Слайд 64
3. Субъединичные вакцины (третье поколение)
В 70-х годах было
доказано, что наиболее значимыми для обеспечения защиты против гриппа
антителами являются специфические антитела против поверхностных антигенов вирусов (гемагглютинина и нейраминидазы), а не на внутренние белки вируса (нуклеопротеид). Таким образом, от вакцины, содержащей только поверхностные антигены и лишенной компонентов вируса, ожидали при равной эффективности уменьшение реактогенности. Первая субъединичная вакцина появилась в 1980 году. Она содержит только два поверхностных гликопротеина - гемагглютинин и нейраминидазу и максимально очищена от белка. При доказанной одинаковой иммуногенности с цельно-вирионными и сплит-вакцинами субъединичные вакцины обладают меньшей реактогенностью, о чем свидетельствуют результаты проведенного анализа.
Благодаря своей высокой эффективности и низкой реактогенности, данная вакцина может применяться у детей начиная с 6-месячного возраста.
Слайд 66
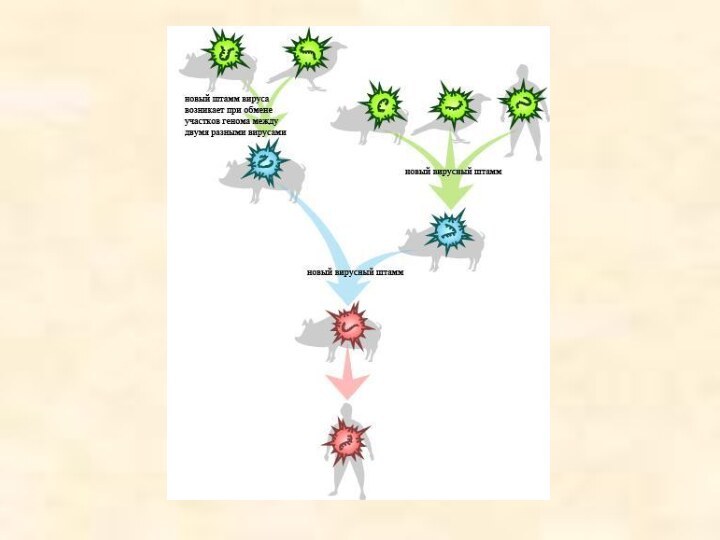
Птичий грипп, свиной грипп и Эволюция
H5 и

N1 – обозначения белков капсида (белковой оболочки) вируса, на
которые в нашем организме вырабатываются антитела. H – это гемагглютинин (белок, склеивающий эритроциты крови), N – нейраминидаза (фермент, отвечающий за проникновение вируса в клетки и выход из нее). Некоторые штаммы вируса гриппа, например H3N2, распространены среди людей очень широко и сегодня не представляют особой опасности, хотя в прошлом, когда в человеческой популяции еще не выработалась иммунологическая устойчивость к ним, также вызывали пандемии, уносившие немало жизней. К сожалению, пока человеческая иммунная система не способна быстро распознать вирус H5N1 и справиться с ним, из-за чего человеческий организм беззащитен перед заболеванием. На сегодняшний день у вируса птичьего гриппа нет генов, позволяющих ему стать высоковирулентным, то есть получить высокую инфицирующую способность. Но эволюция способна это изменить.
Вирус птичьего гриппа H5N1, электронная микрофотография
Слайд 71
Клетки развивающегося мозга подвергаются случайным генетическим модификациям
Американские
биологи экспериментально показали, что в ходе развития человеческого мозга
в клетках — предшественниках нейронов происходит активизация мобильных генетических элементов — ретротранспозонов L1. Ретротранспозоны размножаются и встраиваются в различные участки генома будущих нейронов. В результате клетки мозга одного и того же человека оказываются генетически разнородными.
Перемещения ретротранспозонов влияют на активность генов, что ведет к изменениям свойств нейронов и в конечном счете может повлиять на работу всего мозга. Возможно, этот механизм отчасти объясняет уникальность и разнообразие человеческих личностей.
Слайд 72
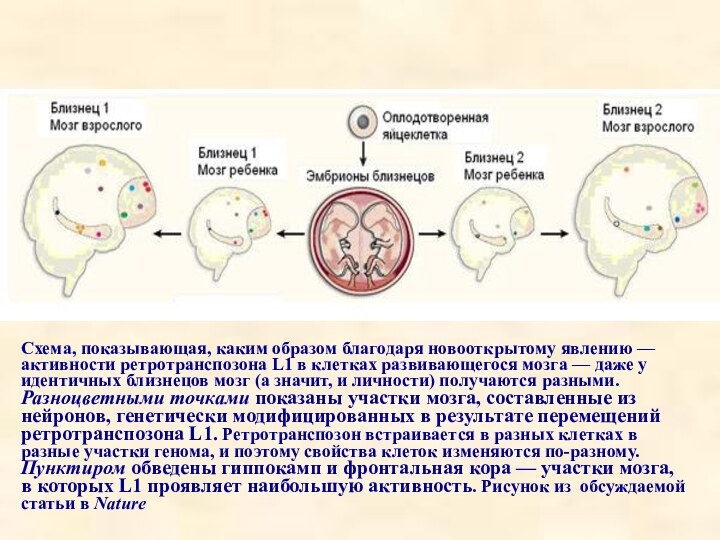
Схема, показывающая, каким образом благодаря новооткрытому явлению — активности
ретротранспозона L1 в клетках развивающегося мозга — даже у идентичных
близнецов мозг (а значит, и личности) получаются разными. Разноцветными точками показаны участки мозга, составленные из нейронов, генетически модифицированных в результате перемещений ретротранспозона L1. Ретротранспозон встраивается в разных клетках в разные участки генома, и поэтому свойства клеток изменяются по-разному. Пунктиром обведены гиппокамп и фронтальная кора — участки мозга, в которых L1 проявляет наибольшую активность. Рисунок из обсуждаемой статьи в Nature
Слайд 73
Мыши-мутанты не становятся наркоманами
Биологи из Франции, США
и Японии расшифровали механизм работы белка DARPP-32, функционирующего в нейронах
прилежащего ядра — отдела мозга, составляющего часть «системы награды». Этот белок играет ключевую роль в процессах обучения «на положительном опыте», а также в развитии наркотической зависимости. Полученные результаты позволили спроектировать мышей-мутантов с ослабленной мотивацией поведения «положительными» стимулами, такими как пища или наркотики. В отличие от обычных мышей, мыши-мутанты проявляют меньше настойчивости в выполнении действий, направленных на добычу пропитания или новой дозы наркотика.
Слайд 74
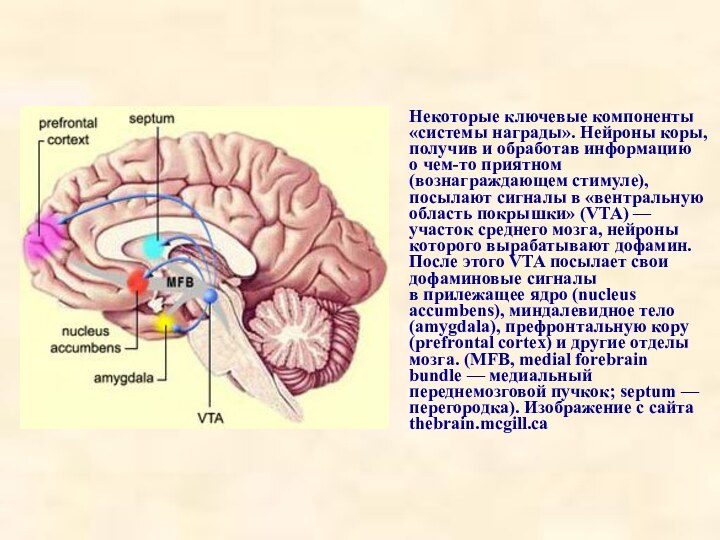
Некоторые ключевые компоненты «системы награды». Нейроны коры, получив
и обработав информацию о чем-то приятном (вознаграждающем стимуле), посылают сигналы
в «вентральную область покрышки» (VTA) — участок среднего мозга, нейроны которого вырабатывают дофамин. После этого VTA посылает свои дофаминовые сигналы в прилежащее ядро (nucleus accumbens), миндалевидное тело (amygdala), префронтальную кору (prefrontal cortex) и другие отделы мозга. (MFB, medial forebrain bundle — медиальный переднемозговой пучкок; septum — перегородка). Изображение с сайта thebrain.mcgill.ca
Слайд 75
Одна из самых ранних культур клеток человека, полученная
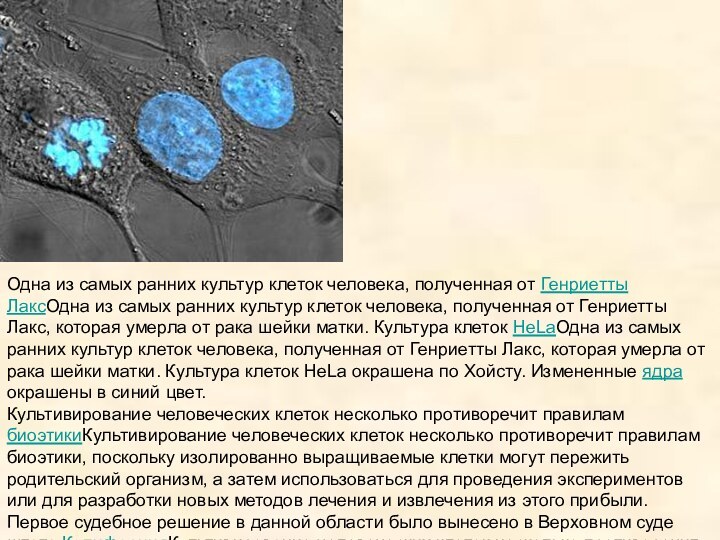
от Генриетты ЛаксОдна из самых ранних культур клеток человека,
полученная от Генриетты Лакс, которая умерла от рака шейки матки. Культура клеток HeLaОдна из самых ранних культур клеток человека, полученная от Генриетты Лакс, которая умерла от рака шейки матки. Культура клеток HeLa окрашена по Хойсту. Измененные ядра окрашены в синий цвет.
Культивирование человеческих клеток несколько противоречит правилам биоэтикиКультивирование человеческих клеток несколько противоречит правилам биоэтики, поскольку изолированно выращиваемые клетки могут пережить родительский организм, а затем использоваться для проведения экспериментов или для разработки новых методов лечения и извлечения из этого прибыли. Первое судебное решение в данной области было вынесено в Верховном суде штата КалифорнияКультивирование человеческих клеток несколько противоречит правилам биоэтики, поскольку изолированно выращиваемые клетки могут пережить родительский организм, а затем использоваться для проведения экспериментов или для разработки новых методов лечения и извлечения из этого прибыли. Первое судебное решение в данной области было вынесено в Верховном суде штата Калифорния по делу «Джон Мур против представителей Калифорнийского университетаКультивирование человеческих клеток несколько противоречит правилам биоэтики, поскольку изолированно выращиваемые клетки могут пережить родительский организм, а затем использоваться для проведения экспериментов или для разработки новых методов лечения и извлечения из этого прибыли. Первое судебное решение в данной области было вынесено в Верховном суде штата Калифорния по делу «Джон Мур против представителей Калифорнийского университета», согласно которому пациенты не имеют никаких прав собственности на линии клеток, полученных из органов, удаленных с их согласия[11].
Слайд 76
Выращивание зубов — перспективная биоинженерная технология, конечной целью которой

является создание/воссоздание полноценных новых коренных зубов у человека — перспективная
биоинженерная технология, конечной целью которой является создание/воссоздание полноценных новых коренных зубов у человека или животных.
Применение у человека возможно не ранее 2020-х - 2030-х годов.
Хронология
2002 год2002 год — английские учёные научились выращивать практически целые, но слабенькие зубы из отдельных клеток[1].
2007 год2007 год — японские учёные вырастили мышам практически полноценные новые зубы, но без корня[2].
2009 год2009 год — из стволовых клеток были выращены полноценные зубы для мышей, причём удалось вырастить даже зубной корень, ранее это не удавалось, но есть и проблема, она состоит в том, что выращенные зубы оказались немного меньше «родных» зубов[3].
Эксперименты на животных
Китайские исследователи показали,что для создания органов и тканей, в том числе зубов могут быть использованы стволовые клетки, полученные из мочи.[4]Китайские исследователи показали,что для создания органов и тканей, в том числе зубов могут быть использованы стволовые клетки, полученные из мочи.[4] Для начала они превратили клетки собранные из мочи в ИПСККитайские исследователи показали,что для создания органов и тканей, в том числе зубов могут быть использованы стволовые клетки, полученные из мочи.[4] Для начала они превратили клетки собранные из мочи в ИПСК.[5]Китайские исследователи показали,что для создания органов и тканей, в том числе зубов могут быть использованы стволовые клетки, полученные из мочи.[4] Для начала они превратили клетки собранные из мочи в ИПСК.[5][6]Китайские исследователи показали,что для создания органов и тканей, в том числе зубов могут быть использованы стволовые клетки, полученные из мочи.[4] Для начала они превратили клетки собранные из мочи в ИПСК.[5][6] Затем из культуры клеток ИПСК получили эпителиальные клетки, соединенные между собой в виде плоского листа. Смешав эти клетки с эмбриональными клетками мезенхимы мыши, они пересадили их мышам. Три недели спустя выросло образование физически и структурно напоминающее человеческие зубы и содержащее пульпу, дентин и клетки, формирующие эмаль.[4]Китайские исследователи показали,что для создания органов и тканей, в том числе зубов могут быть использованы стволовые клетки, полученные из мочи.[4] Для начала они превратили клетки собранные из мочи в ИПСК.[5][6] Затем из культуры клеток ИПСК получили эпителиальные клетки, соединенные между собой в виде плоского листа. Смешав эти клетки с эмбриональными клетками мезенхимы мыши, они пересадили их мышам. Три недели спустя выросло образование физически и структурно напоминающее человеческие зубы и содержащее пульпу, дентин и клетки, формирующие эмаль.[4] По мнению некоторых ученых, модифицировав этот метод, можно будет создавать биоинженерные зачатки зуба in vitro, а затем трансплантировать их в челюсть пациента, чтобы вырос полностью функциональный зуб.[7]Китайские исследователи показали,что для создания органов и тканей, в том числе зубов могут быть использованы стволовые клетки, полученные из мочи.[4] Для начала они превратили клетки собранные из мочи в ИПСК.[5][6] Затем из культуры клеток ИПСК получили эпителиальные клетки, соединенные между собой в виде плоского листа. Смешав эти клетки с эмбриональными клетками мезенхимы мыши, они пересадили их мышам. Три недели спустя выросло образование физически и структурно напоминающее человеческие зубы и содержащее пульпу, дентин и клетки, формирующие эмаль.[4] По мнению некоторых ученых, модифицировав этот метод, можно будет создавать биоинженерные зачатки зуба in vitro, а затем трансплантировать их в челюсть пациента, чтобы вырос полностью функциональный зуб.[7][8]
Способы
Наружный — зуб выращивается отдельно и имплантируется пациенту.
Внутренний — зуб выращивается непосредственно в полости рта пациента.
Прогноз
По прогнозам неназванных ученых от августа 2009, технология, возможно, будет перенесена на человека через 15 лет (т.е. около середины 2020-х годов)[3].
Слайд 77
Ксенотрансплантация (от греч. ξένος — «чужой» и трансплантация — «перенос»),

или межвидовая трансплантация ξένος — «чужой» и трансплантация — «перенос»), или
межвидовая трансплантация — трансплантация органов ξένος — «чужой» и трансплантация — «перенос»), или межвидовая трансплантация — трансплантация органов, тканей ξένος — «чужой» и трансплантация — «перенос»), или межвидовая трансплантация — трансплантация органов, тканей и/или клеточных органоидов ξένος — «чужой» и трансплантация — «перенос»), или межвидовая трансплантация — трансплантация органов, тканей и/или клеточных органоидов от организма ξένος — «чужой» и трансплантация — «перенос»), или межвидовая трансплантация — трансплантация органов, тканей и/или клеточных органоидов от организма одного биологического вида в организм или его часть другого биологического вида.
Источники и объекты ксенотрансплантации
Обычно идёт речь о ксенотрансплантации от наиболее дешёвой в получении и близкой по размеру к человеку иммунологически модифицированной свиньиОбычно идёт речь о ксенотрансплантации от наиболее дешёвой в получении и близкой по размеру к человеку иммунологически модифицированной свиньи[1]Обычно идёт речь о ксенотрансплантации от наиболее дешёвой в получении и близкой по размеру к человеку иммунологически модифицированной свиньи[1][2]Обычно идёт речь о ксенотрансплантации от наиболее дешёвой в получении и близкой по размеру к человеку иммунологически модифицированной свиньи[1][2][3]Обычно идёт речь о ксенотрансплантации от наиболее дешёвой в получении и близкой по размеру к человеку иммунологически модифицированной свиньи[1][2][3] или от высших приматов, близких генетически, но сложных в содержании и разведении
Генетически модифицированная свиньяГенетически модифицированная свинья может быть использована для выращивания человеческих органов и тканей[2]
Слайд 78
Черная горная овца может быть использована для терапии

«свежими стволовыми клетками» (англ. fresh cell therapy)
Разновидностью ксенотрансплантации надо,
очевидно, считать метод, так называемой, терапии «свежими» стволовыми клетками (англ. fresh cell therapy). Этот метод предложенный ещё в 1931 году Полом Нихансом (Paul Niehans). Этот метод предложенный ещё в 1931 году Полом Нихансом (Paul Niehans) — австрийским врачом, который считается отцом клеточной терапии). Этот метод предложенный ещё в 1931 году Полом Нихансом (Paul Niehans) — австрийским врачом, который считается отцом клеточной терапии, заключается в использовании клеток животных (извлекаемых из эмбриона). Этот метод предложенный ещё в 1931 году Полом Нихансом (Paul Niehans) — австрийским врачом, который считается отцом клеточной терапии, заключается в использовании клеток животных (извлекаемых из эмбриона или плода). Этот метод предложенный ещё в 1931 году Полом Нихансом (Paul Niehans) — австрийским врачом, который считается отцом клеточной терапии, заключается в использовании клеток животных (извлекаемых из эмбриона или плода овцы). Этот метод предложенный ещё в 1931 году Полом Нихансом (Paul Niehans) — австрийским врачом, который считается отцом клеточной терапии, заключается в использовании клеток животных (извлекаемых из эмбриона или плода овцы), которые вводят в организм пациента с целью достижения эффекта ревитализации). Этот метод предложенный ещё в 1931 году Полом Нихансом (Paul Niehans) — австрийским врачом, который считается отцом клеточной терапии, заключается в использовании клеток животных (извлекаемых из эмбриона или плода овцы), которые вводят в организм пациента с целью достижения эффекта ревитализации[55]). Этот метод предложенный ещё в 1931 году Полом Нихансом (Paul Niehans) — австрийским врачом, который считается отцом клеточной терапии, заключается в использовании клеток животных (извлекаемых из эмбриона или плода овцы), которые вводят в организм пациента с целью достижения эффекта ревитализации[55][56]). Этот метод предложенный ещё в 1931 году Полом Нихансом (Paul Niehans) — австрийским врачом, который считается отцом клеточной терапии, заключается в использовании клеток животных (извлекаемых из эмбриона или плода овцы), которые вводят в организм пациента с целью достижения эффекта ревитализации[55][56]. Разумеется клетки животных не способны встроиться в организм пациента, однако они снабжают его гуморальными факторами). Этот метод предложенный ещё в 1931 году Полом Нихансом (Paul Niehans) — австрийским врачом, который считается отцом клеточной терапии, заключается в использовании клеток животных (извлекаемых из эмбриона или плода овцы), которые вводят в организм пациента с целью достижения эффекта ревитализации[55][56]. Разумеется клетки животных не способны встроиться в организм пациента, однако они снабжают его гуморальными факторами, способствующими оздоровлению и активируют его иммунную систему). Этот метод предложенный ещё в 1931 году Полом Нихансом (Paul Niehans) — австрийским врачом, который считается отцом клеточной терапии, заключается в использовании клеток животных (извлекаемых из эмбриона или плода овцы), которые вводят в организм пациента с целью достижения эффекта ревитализации[55][56]. Разумеется клетки животных не способны встроиться в организм пациента, однако они снабжают его гуморальными факторами, способствующими оздоровлению и активируют его иммунную систему. Эта терапия связана с определенным риском заразиться от животных некоторыми инфекционными заболеваниями. Так, например, группа туристов из США и Канады, проходивших ежегодные сеансы такой терапии в Германии, заразилась лихорадкой Q). Этот метод предложенный ещё в 1931 году Полом Нихансом (Paul Niehans) — австрийским врачом, который считается отцом клеточной терапии, заключается в использовании клеток животных (извлекаемых из эмбриона или плода овцы), которые вводят в организм пациента с целью достижения эффекта ревитализации[55][56]. Разумеется клетки животных не способны встроиться в организм пациента, однако они снабжают его гуморальными факторами, способствующими оздоровлению и активируют его иммунную систему. Эта терапия связана с определенным риском заразиться от животных некоторыми инфекционными заболеваниями. Так, например, группа туристов из США и Канады, проходивших ежегодные сеансы такой терапии в Германии, заразилась лихорадкой Q[57]
Слайд 79
Гуморальная терапия инкапсулированными клетками животных
Уникальная способность хемокинаУникальная способность

хемокина SDF-1Уникальная способность хемокина SDF-1 (называемого также CXCL12) способствовать
выживанию клеток, а также отталкивать эффекторные Т-клеткиУникальная способность хемокина SDF-1 (называемого также CXCL12) способствовать выживанию клеток, а также отталкивать эффекторные Т-клетки и привлекать регуляторные Т-клеткиУникальная способность хемокина SDF-1 (называемого также CXCL12) способствовать выживанию клеток, а также отталкивать эффекторные Т-клетки и привлекать регуляторные Т-клетки может быть использована для защиты трансплантированных гормон-продуцирующих (эндокринных) клетокУникальная способность хемокина SDF-1 (называемого также CXCL12) способствовать выживанию клеток, а также отталкивать эффекторные Т-клетки и привлекать регуляторные Т-клетки может быть использована для защиты трансплантированных гормон-продуцирующих (эндокринных) клеток ксеногенного происхождения. Для этого эти скопления клеток покрывают защитной оболочкой состоящей из геля содержащего CXCL12. Так, например, островки Лангерганса взятые у поросенка и покрытые гелем с CXCL12 успешно функционировали и не были отторгнуты в организме у мыши[58]Уникальная способность хемокина SDF-1 (называемого также CXCL12) способствовать выживанию клеток, а также отталкивать эффекторные Т-клетки и привлекать регуляторные Т-клетки может быть использована для защиты трансплантированных гормон-продуцирующих (эндокринных) клеток ксеногенного происхождения. Для этого эти скопления клеток покрывают защитной оболочкой состоящей из геля содержащего CXCL12. Так, например, островки Лангерганса взятые у поросенка и покрытые гелем с CXCL12 успешно функционировали и не были отторгнуты в организме у мыши[58] Аналогичная технология была использована для лечения болезни ПаркинсонаУникальная способность хемокина SDF-1 (называемого также CXCL12) способствовать выживанию клеток, а также отталкивать эффекторные Т-клетки и привлекать регуляторные Т-клетки может быть использована для защиты трансплантированных гормон-продуцирующих (эндокринных) клеток ксеногенного происхождения. Для этого эти скопления клеток покрывают защитной оболочкой состоящей из геля содержащего CXCL12. Так, например, островки Лангерганса взятые у поросенка и покрытые гелем с CXCL12 успешно функционировали и не были отторгнуты в организме у мыши[58] Аналогичная технология была использована для лечения болезни Паркинсона инкапсулированными клетками поросенка, продуцирующими спинномозговую жидкостьУникальная способность хемокина SDF-1 (называемого также CXCL12) способствовать выживанию клеток, а также отталкивать эффекторные Т-клетки и привлекать регуляторные Т-клетки может быть использована для защиты трансплантированных гормон-продуцирующих (эндокринных) клеток ксеногенного происхождения. Для этого эти скопления клеток покрывают защитной оболочкой состоящей из геля содержащего CXCL12. Так, например, островки Лангерганса взятые у поросенка и покрытые гелем с CXCL12 успешно функционировали и не были отторгнуты в организме у мыши[58] Аналогичная технология была использована для лечения болезни Паркинсона инкапсулированными клетками поросенка, продуцирующими спинномозговую жидкость, которая питает и очищает мозг от токсичных продуктов метаболизма[59]Уникальная способность хемокина SDF-1 (называемого также CXCL12) способствовать выживанию клеток, а также отталкивать эффекторные Т-клетки и привлекать регуляторные Т-клетки может быть использована для защиты трансплантированных гормон-продуцирующих (эндокринных) клеток ксеногенного происхождения. Для этого эти скопления клеток покрывают защитной оболочкой состоящей из геля содержащего CXCL12. Так, например, островки Лангерганса взятые у поросенка и покрытые гелем с CXCL12 успешно функционировали и не были отторгнуты в организме у мыши[58] Аналогичная технология была использована для лечения болезни Паркинсона инкапсулированными клетками поросенка, продуцирующими спинномозговую жидкость, которая питает и очищает мозг от токсичных продуктов метаболизма[59]. Технологии инкапсуляции подробно описаны в обзоре[60]Уникальная способность хемокина SDF-1 (называемого также CXCL12) способствовать выживанию клеток, а также отталкивать эффекторные Т-клетки и привлекать регуляторные Т-клетки может быть использована для защиты трансплантированных гормон-продуцирующих (эндокринных) клеток ксеногенного происхождения. Для этого эти скопления клеток покрывают защитной оболочкой состоящей из геля содержащего CXCL12. Так, например, островки Лангерганса взятые у поросенка и покрытые гелем с CXCL12 успешно функционировали и не были отторгнуты в организме у мыши[58] Аналогичная технология была использована для лечения болезни Паркинсона инкапсулированными клетками поросенка, продуцирующими спинномозговую жидкость, которая питает и очищает мозг от токсичных продуктов метаболизма[59]. Технологии инкапсуляции подробно описаны в обзоре[60]. В качестве материала для инкапсуляции обычно используют модифицированный альгинатУникальная способность хемокина SDF-1 (называемого также CXCL12) способствовать выживанию клеток, а также отталкивать эффекторные Т-клетки и привлекать регуляторные Т-клетки может быть использована для защиты трансплантированных гормон-продуцирующих (эндокринных) клеток ксеногенного происхождения. Для этого эти скопления клеток покрывают защитной оболочкой состоящей из геля содержащего CXCL12. Так, например, островки Лангерганса взятые у поросенка и покрытые гелем с CXCL12 успешно функционировали и не были отторгнуты в организме у мыши[58] Аналогичная технология была использована для лечения болезни Паркинсона инкапсулированными клетками поросенка, продуцирующими спинномозговую жидкость, которая питает и очищает мозг от токсичных продуктов метаболизма[59]. Технологии инкапсуляции подробно описаны в обзоре[60]. В качестве материала для инкапсуляции обычно используют модифицированный альгинат[61]Уникальная способность хемокина SDF-1 (называемого также CXCL12) способствовать выживанию клеток, а также отталкивать эффекторные Т-клетки и привлекать регуляторные Т-клетки может быть использована для защиты трансплантированных гормон-продуцирующих (эндокринных) клеток ксеногенного происхождения. Для этого эти скопления клеток покрывают защитной оболочкой состоящей из геля содержащего CXCL12. Так, например, островки Лангерганса взятые у поросенка и покрытые гелем с CXCL12 успешно функционировали и не были отторгнуты в организме у мыши[58] Аналогичная технология была использована для лечения болезни Паркинсона инкапсулированными клетками поросенка, продуцирующими спинномозговую жидкость, которая питает и очищает мозг от токсичных продуктов метаболизма[59]. Технологии инкапсуляции подробно описаны в обзоре[60]. В качестве материала для инкапсуляции обычно используют модифицированный альгинат[61][62]
Слайд 80
Межвидовая беременность (в буквальном смысле беременность между видами

или ксенобеременность) — это беременность) — это беременность, при которой эмбрион) —
это беременность, при которой эмбрион или зародыш) — это беременность, при которой эмбрион или зародыш принадлежит к иному биологическому виду) — это беременность, при которой эмбрион или зародыш принадлежит к иному биологическому виду, чем беременная особь. Строго говоря, межвидовая беременность не включает ситуацию, когда зародыш есть гибрид) — это беременность, при которой эмбрион или зародыш принадлежит к иному биологическому виду, чем беременная особь. Строго говоря, межвидовая беременность не включает ситуацию, когда зародыш есть гибрид беременной особи и особи другого вида, то есть беременная особь при межвидовой беременности не является биологической матерью плода. Межвидовую беременность также следует отличать от эндопаразитизма, при котором зародыш паразита растёт внутри организма особи другого вида, но не обязательно внутри матки.
В природе не возникает обстоятельств для межвидовой беременности, но они могут быть созданы искусственно, когда эмбрион одного вида помещается в матку женской особи другого вида.
Возможные применения
Потенциальные возможности включают возможность вынашивания человеческих зародышей свиньями. Её следует рассматривать как, хотя и этически противоречивую, но альтернативу суррогатному материнствуПотенциальные возможности включают возможность вынашивания человеческих зародышей свиньями. Её следует рассматривать как, хотя и этически противоречивую, но альтернативу суррогатному материнству и созданию искусственной маткиПотенциальные возможности включают возможность вынашивания человеческих зародышей свиньями. Её следует рассматривать как, хотя и этически противоречивую, но альтернативу суррогатному материнству и созданию искусственной матки, что позволит иметь детей нетрадиционным семьям[1]Потенциальные возможности включают возможность вынашивания человеческих зародышей свиньями. Её следует рассматривать как, хотя и этически противоречивую, но альтернативу суррогатному материнству и созданию искусственной матки, что позволит иметь детей нетрадиционным семьям[1] или женщинам с болезнями матки. Межвидовая беременность предоставляет трезвого, некурящего и не употребляющего наркотики носителя[1]Потенциальные возможности включают возможность вынашивания человеческих зародышей свиньями. Её следует рассматривать как, хотя и этически противоречивую, но альтернативу суррогатному материнству и созданию искусственной матки, что позволит иметь детей нетрадиционным семьям[1] или женщинам с болезнями матки. Межвидовая беременность предоставляет трезвого, некурящего и не употребляющего наркотики носителя[1]. Она является ценным инструментом в программах сохранения исчезающих видов животных, восстановления таких видов в зоопарках и питомниках[2]Потенциальные возможности включают возможность вынашивания человеческих зародышей свиньями. Её следует рассматривать как, хотя и этически противоречивую, но альтернативу суррогатному материнству и созданию искусственной матки, что позволит иметь детей нетрадиционным семьям[1] или женщинам с болезнями матки. Межвидовая беременность предоставляет трезвого, некурящего и не употребляющего наркотики носителя[1]. Она является ценным инструментом в программах сохранения исчезающих видов животных, восстановления таких видов в зоопарках и питомниках[2][3], а также возрождения уже исчезнувших видов.
Препятствия
Иммунологически эмбрион при межвидовой беременности является скорее ксенотканью, чем аллотканью, что накладывает более жёсткие требования к плацентарной иммунной толерантности. Некоторые опыты на мышах показывают дисбаланс между Th1 и Th2 хелперными клеткамиИммунологически эмбрион при межвидовой беременности является скорее ксенотканью, чем аллотканью, что накладывает более жёсткие требования к плацентарной иммунной толерантности. Некоторые опыты на мышах показывают дисбаланс между Th1 и Th2 хелперными клетками с преобладанием Th1 цитокинов[4]Иммунологически эмбрион при межвидовой беременности является скорее ксенотканью, чем аллотканью, что накладывает более жёсткие требования к плацентарной иммунной толерантности. Некоторые опыты на мышах показывают дисбаланс между Th1 и Th2 хелперными клетками с преобладанием Th1 цитокинов[4]. Однако, другие опыты на мышах показывают, что иммунный ответ на эмбрионы чужого вида не происходит по одному из классических механизмов с участием цитотоксических T-лимфоцитовИммунологически эмбрион при межвидовой беременности является скорее ксенотканью, чем аллотканью, что накладывает более жёсткие требования к плацентарной иммунной толерантности. Некоторые опыты на мышах показывают дисбаланс между Th1 и Th2 хелперными клетками с преобладанием Th1 цитокинов[4]. Однако, другие опыты на мышах показывают, что иммунный ответ на эмбрионы чужого вида не происходит по одному из классических механизмов с участием цитотоксических T-лимфоцитов или естественных киллерных клетокИммунологически эмбрион при межвидовой беременности является скорее ксенотканью, чем аллотканью, что накладывает более жёсткие требования к плацентарной иммунной толерантности. Некоторые опыты на мышах показывают дисбаланс между Th1 и Th2 хелперными клетками с преобладанием Th1 цитокинов[4]. Однако, другие опыты на мышах показывают, что иммунный ответ на эмбрионы чужого вида не происходит по одному из классических механизмов с участием цитотоксических T-лимфоцитов или естественных киллерных клеток[5].
Межвидовая совместимость связана с типом плацентацииМежвидовая совместимость связана с типом плацентации. Самки видов с более активным гемохориальным типом плаценты (например, люди) вынуждены иметь более сильные механизмы регуляции иммунного ответа со стороны материнского организма, и потому они более толерантны к эмбрионам других видов по сравнению с самками видов с эндотелиальнохориальным типом плаценты (кошки и собаки) или с эпителиохориальным типом плаценты (свиньи, коровы, лошади, киты), у которых нет контакта материнской крови с хорионом эмбриона[6].
Ещё одна потенциальная опасность — несовместимость систем питания и иных вспомогательных систем. Важно отметить, что есть риск неправильного взаимодействия между трофобластом плода и эндометрием матери[7]Ещё одна потенциальная опасность — несовместимость систем питания и иных вспомогательных систем. Важно отметить, что есть риск неправильного взаимодействия между трофобластом плода и эндометрием матери[7]. Например, оптимально, если модели гликозилирования на границе между матерью и плодом у двух видов похожи[8]
Слайд 81
Эмбрион индийского бизона может развиваться до полного срока
в коровеЭмбрион индийского бизона может развиваться до полного срока
в корове но с жёстким ограничением на внутриматочный рост
Слайд 82
Эмбрионы большой пандыЭмбрионы большой панды были выращены в
матке кошкиЭмбрионы большой панды были выращены в матке кошки
одновременно с эмбрионами кошки.[10]
Бластоциста с внутренней клеточной массой (отмечена зелёным цветом). Эта клеточная масса станет эмбрионом. Слой клеток трофобласта, который может быть заменен клетками трофобласта особи другого вида (отмечен лиловым цветом).
Слайд 83
Сергей Абрамович Воронов (1866-1951)
Серге́й (Самуи́л) Абра́мович Во́ронов (10

июля (10 июля 1866 (10 июля 1866, Воронеж (10
июля 1866, Воронеж, Российская империя (10 июля 1866, Воронеж, Российская империя — 3 сентября (10 июля 1866, Воронеж, Российская империя — 3 сентября, 1951 (10 июля 1866, Воронеж, Российская империя — 3 сентября, 1951, Лозанна (10 июля 1866, Воронеж, Российская империя — 3 сентября, 1951, Лозанна, Швейцария (10 июля 1866, Воронеж, Российская империя — 3 сентября, 1951, Лозанна, Швейцария) — французский (10 июля 1866, Воронеж, Российская империя — 3 сентября, 1951, Лозанна, Швейцария) — французский хирург (10 июля 1866, Воронеж, Российская империя — 3 сентября, 1951, Лозанна, Швейцария) — французский хирург российского происхождения. Получил известность за методику прививания ткани яичек обезьян к человеческим яичкам, которую он разработал во Франции в 1920-х и 1930-х годах. Эта методика принесла ему много денег, хотя он и был довольно независим в финансовом отношении и до этого. Однако вскоре его работа перестала быть популярной и он стал мишенью для насмешек. Другие ученые, как и публика в целом, отделили себя от Воронова, сделав вид, что его методика прививания никогда их не интересовала. Когда он умер в 1951 году, в 85 лет, большинство газет не заметили его смерти, а те, которые что-либо написали, продолжали высмеивать его исследования. В наше время его работа и исследования в основном реабилитированы.
Воронов был прототипом профессора Преображенского в повести Михаила БулгаковаВоронов был прототипом профессора Преображенского в повести Михаила Булгакова «Собачье сердцеВоронов был прототипом профессора Преображенского в повести Михаила Булгакова «Собачье сердце» (1925).[26]Воронов был прототипом профессора Преображенского в повести Михаила Булгакова «Собачье сердце» (1925).[26] В книге Преображенский, как известно, в виде эксперимента пересадил человеческие яички и гипофиз собаке, но кроме того вообще профессионально практикует «омоложение», пересаживая обезьяньи яичники богатым клиентам.
Слайд 84
Клетки Сертоли (7), соединенные пояском замыкания (zonula occludens)
(8)
Кле́тки Серто́ли (син. сустентоциты, поддерживающие клетки) – соматические клетки.
сустентоциты, поддерживающие клетки) – соматические клетки, расположенные в извитых канальцах семенников. сустентоциты, поддерживающие клетки) – соматические клетки, расположенные в извитых канальцах семенников млекопитающих. сустентоциты, поддерживающие клетки) – соматические клетки, расположенные в извитых канальцах семенников млекопитающих. Разновидность интерстициальных клеток. сустентоциты, поддерживающие клетки) – соматические клетки, расположенные в извитых канальцах семенников млекопитающих. Разновидность интерстициальных клеток. Являются частью гемато-тестикулярного барьера. сустентоциты, поддерживающие клетки) – соматические клетки, расположенные в извитых канальцах семенников млекопитающих. Разновидность интерстициальных клеток. Являются частью гемато-тестикулярного барьера вокруг развивающихся мужских гамет.
Клетки Сертоли обладают уникальными свойствами защиты развивающихся зародышевых клеток от иммунологической атаки. Эта способность к иммунной привилегииКлетки Сертоли обладают уникальными свойствами защиты развивающихся зародышевых клеток от иммунологической атаки. Эта способность к иммунной привилегии изучается исследователями с целью защиты трансплантатовКлетки Сертоли обладают уникальными свойствами защиты развивающихся зародышевых клеток от иммунологической атаки. Эта способность к иммунной привилегии изучается исследователями с целью защиты трансплантатов от иммунной системы организма[2]Клетки Сертоли обладают уникальными свойствами защиты развивающихся зародышевых клеток от иммунологической атаки. Эта способность к иммунной привилегии изучается исследователями с целью защиты трансплантатов от иммунной системы организма[2][3]
Слайд 85
3D-биопринтинг — технология создания объёмных моделей клеток с использованием
3D-печати, при которой сохраняются функции и жизнеспособность клеток[1] — технология
создания объёмных моделей клеток с использованием 3D-печати, при которой сохраняются функции и жизнеспособность клеток[1]. Первый патент, относящийся к этой технологии, был подан в США — технология создания объёмных моделей клеток с использованием 3D-печати, при которой сохраняются функции и жизнеспособность клеток[1]. Первый патент, относящийся к этой технологии, был подан в США в 2003 году и получен в 2006 году[2].
Человеческие уши научились печатать на биопринтере
Биопринтер носитназвание ITOP (Integrated Tissue and Organ Printing System) или объединенная система для печати тканей и органов
Слайд 86
Почку вырастили в чашке Петри, а потом отредактировали
геном
Биоинженерам из нескольких американских университетов удалось совершить важный
шаг в развитии регенеративной медицины.
В чашке Петри из плюрипотентных стволовых клеток они вырастили настоящую миниатюрную человеческую почку. Затем с помощью определенной технологии они отредактировали ее геном таким образом, что она приобрела мутации, свойственные двум распространенным почечным заболеваниям – поликистозу почек и гломерулонефриту.
По словам авторов, такая миниатюрная почка может стать прекрасной моделью для изучения этих болезней и для разработки новых эффективных методов их лечения. Вполне возможно, что с помощью этой технологии можно будет выращивать почки из клеток кожи пациентов, затем редактировать их геном, убирая мутации, и имплантировать уже здоровые органы в организм пациента. Звучит фантастически, но тем не менее, в будущем эта технология, скорее всего, станет реальностью
Слайд 87
Искусственная кожа
Стадия разработки: исследователи на пороге создания настоящей
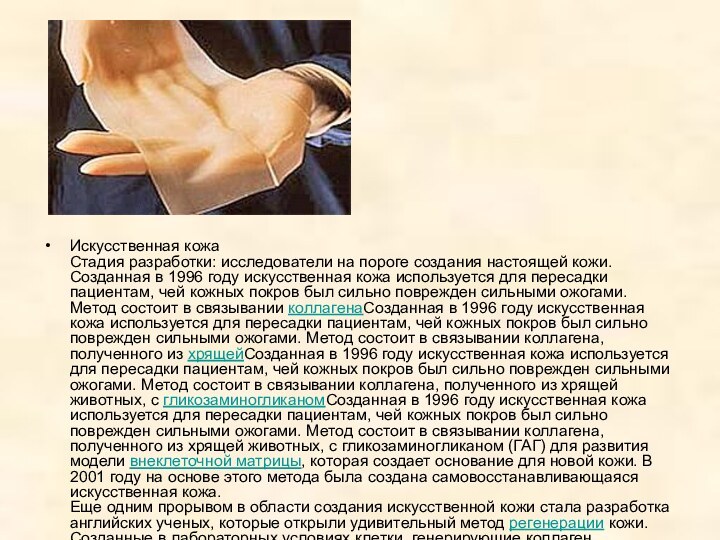
кожи.
Созданная в 1996 году искусственная кожа используется для пересадки
пациентам, чей кожных покров был сильно поврежден сильными ожогами. Метод состоит в связывании коллагенаСозданная в 1996 году искусственная кожа используется для пересадки пациентам, чей кожных покров был сильно поврежден сильными ожогами. Метод состоит в связывании коллагена, полученного из хрящейСозданная в 1996 году искусственная кожа используется для пересадки пациентам, чей кожных покров был сильно поврежден сильными ожогами. Метод состоит в связывании коллагена, полученного из хрящей животных, с гликозаминогликаномСозданная в 1996 году искусственная кожа используется для пересадки пациентам, чей кожных покров был сильно поврежден сильными ожогами. Метод состоит в связывании коллагена, полученного из хрящей животных, с гликозаминогликаном (ГАГ) для развития модели внеклеточной матрицы, которая создает основание для новой кожи. В 2001 году на основе этого метода была создана самовосстанавливающаяся искусственная кожа.
Еще одним прорывом в области создания искусственной кожи стала разработка английских ученых, которые открыли удивительный метод регенерации кожи. Созданные в лабораторных условиях клетки, генерирующие коллаген, воспроизводят реальные клетки человеческого организма, которые не дают коже стареть. С возрастом количество этих клеток уменьшается, и кожа начинает покрываться морщинами. Искусственные клетки, введенные непосредственно в морщины, начинают вырабатывать коллаген и кожа начинает восстанавливаться
Слайд 88
Выращиваются органы из стволовых клеток
Прогрессивным направлением трансплантологии
будущего становится выращивание органов для трансплантации из стволовых клеток
человека. Это научное направление признано более перспективным, так как органы, созданные из стволовых клеток пациента, имеют гораздо больше шансов прижиться. Если исследования ученых увенчаются успехом, то в будущем станет возможным заменить любой орган собственного тела на более молодой, здоровый и... свой собственный. Однако на данный момент ученые далеки от этой футуристической картины. Одним из факторов, ограничивающих исследования, является этический вопрос использования эмбриональных стволовых клеток.
Слайд 89
Российские ученые сообщили о создании биоискусственной печени
Биоинженерный орган
был выращен на основе бесклеточного матрикса – биокаркаса печени,
из которой по специальной технологии удалены все ткани, а оставлены лишь белковые структуры кровеносных сосудов и других компонентов органа. Матрикс был заселен аутологичными (собственными) культивированными клетками костного мозга и печени. Полученная в результате клеточно-инженерная конструкция (КИК), будучи вживленной в паренхиму печени или брызжейку тонкой кишки, способствует регенерации тканей и полному восстановлению функции поврежденной печени,
Слайд 90
В Великобритании будут выращивать органы человека в организме
животных
текст: /Infox.ru
опубликовано 12 янв ‘16 18:20
источник: Stanford University
Британский
комитет по использованию животных в научных исследованиях в ближайшее время планирует разрешить выращивание человеческих органов, пригодных для пересадки, в организме животных – свиней и овец.
Слайд 91
Будущее за персонализированной медициной
Основная идея персонализированной медицины заключается
в том, чтобы на основе генетических данных конкретного человека
рассказать о рисках появления у него тех или иных болезней и, главное – их предотвратить. Если же заболевание уже диагностировано, то персонализированная медицина поможет выяснить, какое лечение будет эффективнее, и какие лекарственные препараты и в каких дозах окажут наилучший результат. Именно с помощью персонализированного подхода разрабатываются таргетные – т.е. направленные на определенные мишени методы лечения самых тяжелых заболеваний.
Все эти исследования основаны на анализе огромных объемов данных, поэтому они стали возможны лишь с появлением соответствующих технологических платформ в области IT.
Слайд 92
Персонализированная терапия в области лечения рака
Регенеративная медицина
Редактировать геном эмбриона и получать здоровых детей
Точно в
цель – доставка лекарственных препаратов в необходимую мишень