ткани
Гладкая
Сердечная
Скелетная
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть

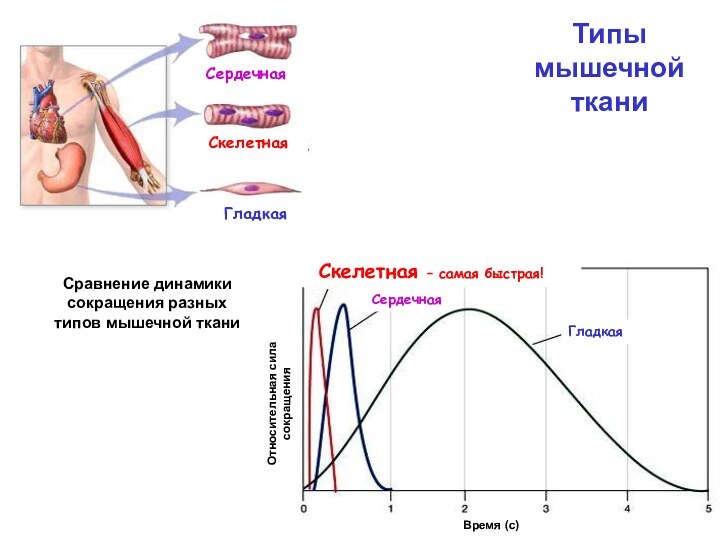















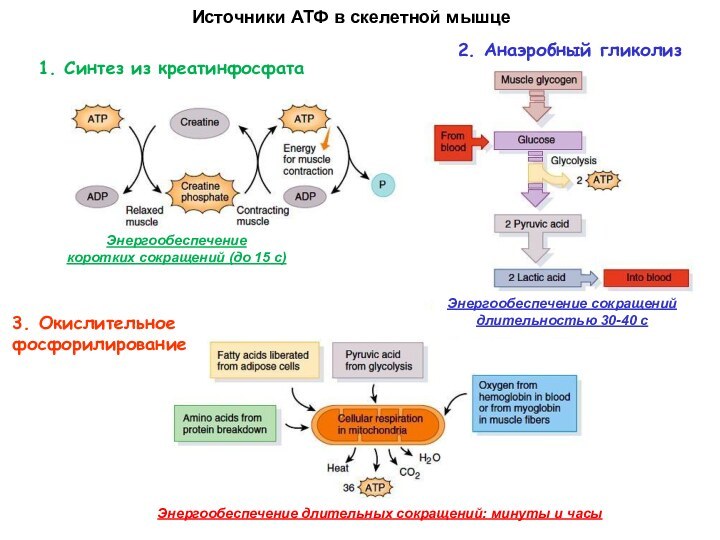
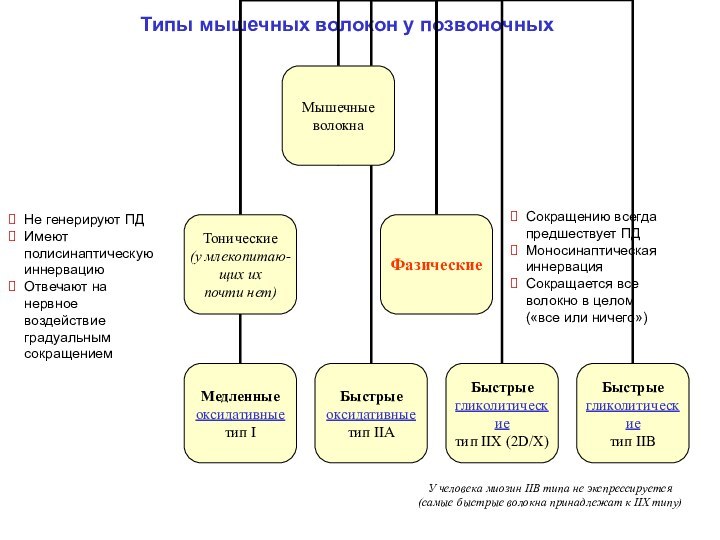
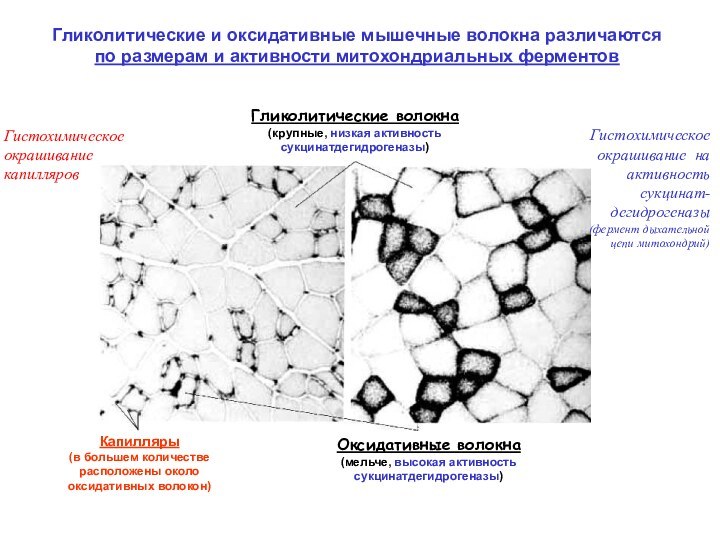
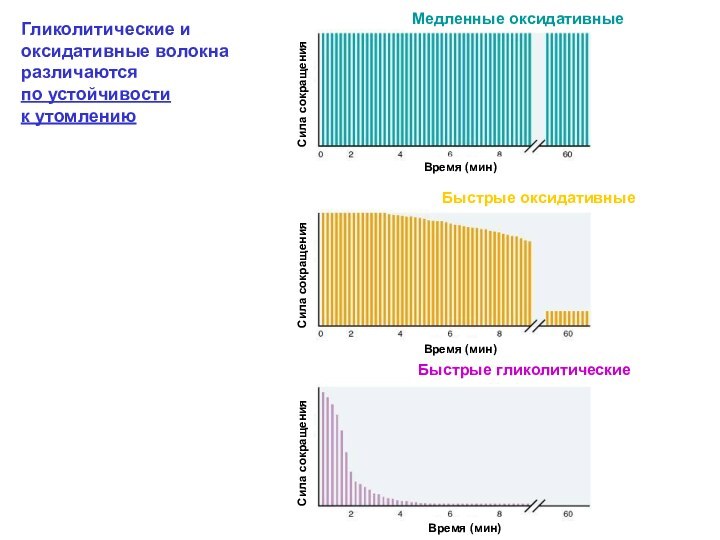



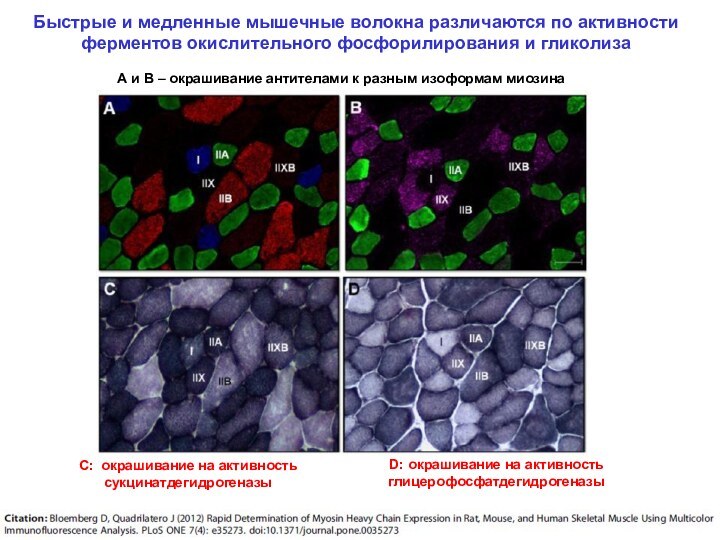
Скелетная
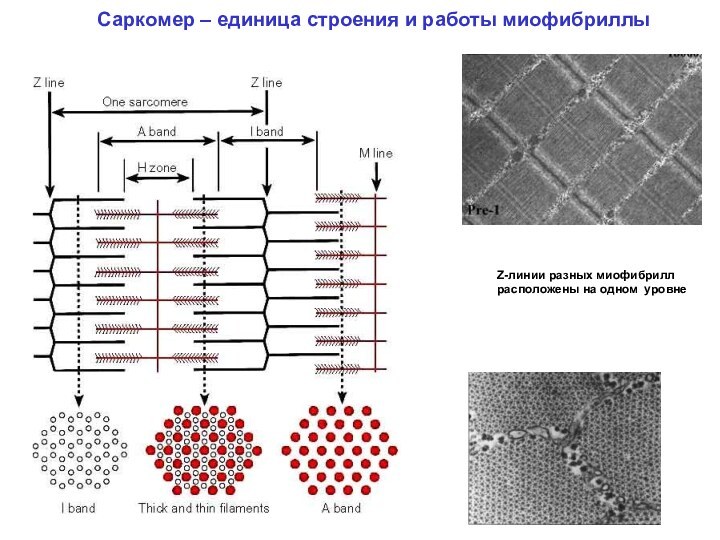
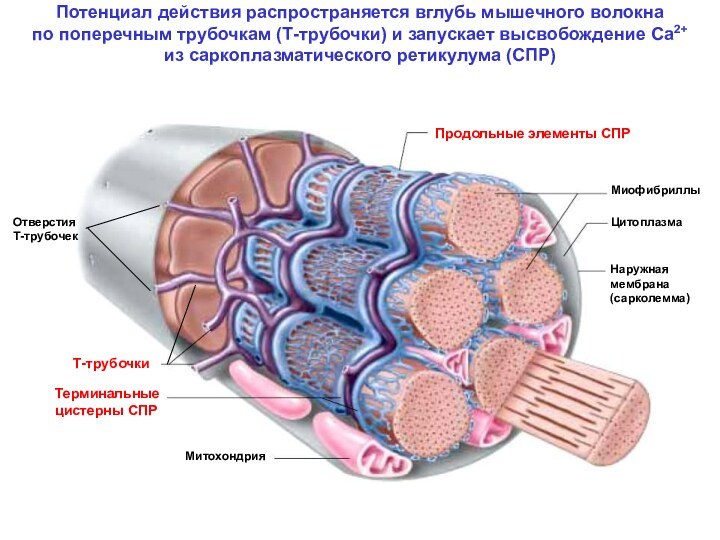
МЫШЕЧНОЕ ВОЛОКНО
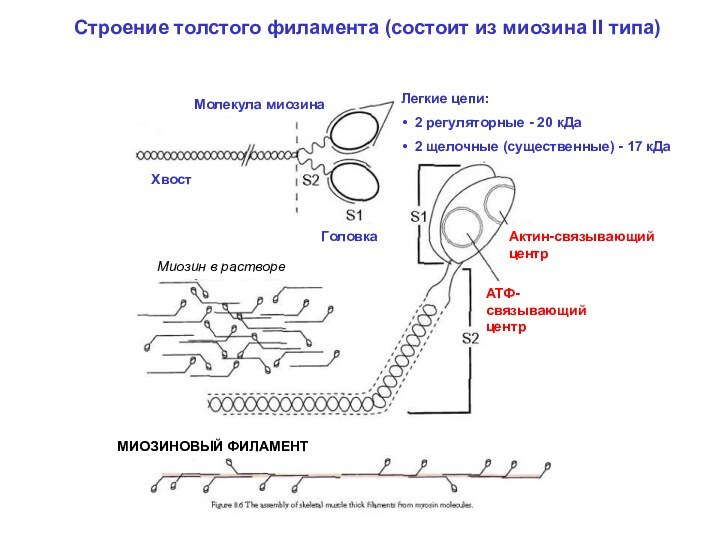
Небулин («линейка» для актинового филамента)
Тропомодулин (кепирует конец актинового филамента)
Миофибриллы «сшиваются» промежуточными филаментами (состоят из десмина и др. белков)
С-белок – регулирует прочность связывания головок миозина с актином
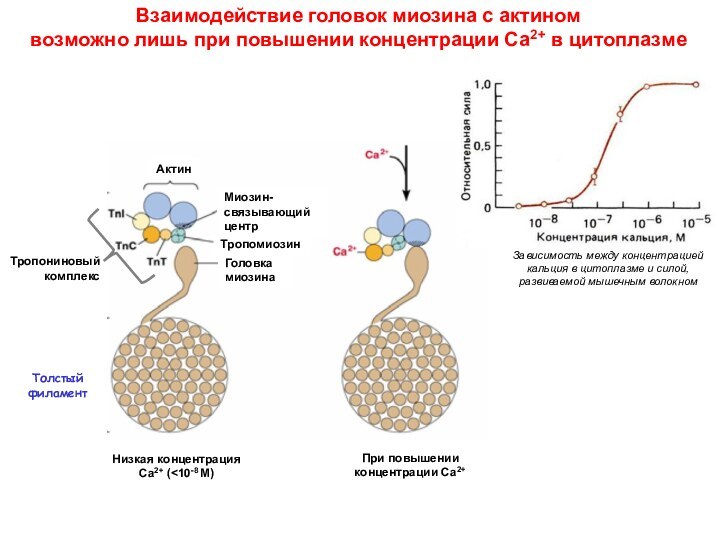
Миозин и актин - основные участники мышечного сокращения
Середина 19 века: немецкий ученый Кюне выделил «сократительную субстанцию» мышц и назвал ее миозином.
1942 г.: венгерский биохимик Штрауб показал, что «миозин» на самом деле является смесью двух белков. Второй белок был назван актином из-за его способности активировать гидролиз АТФ миозином.
Головки
МИОЗИНОВЫЙ ФИЛАМЕНТ
(биполярное строение)
Шейка
Актин-связывающий центр
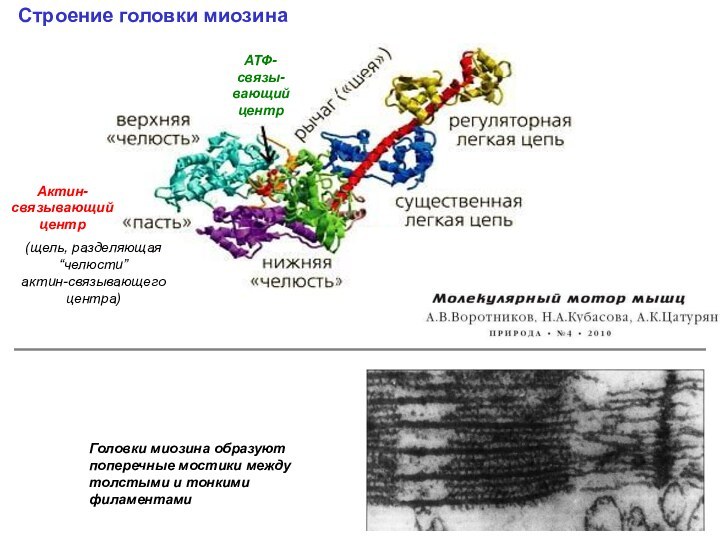
Строение головки миозина
Н.Б.Гусев Соросовский образовательный
журнал 2000, том 6, №8, с.24-32
АТФ-связывающий центр
Щель (“пасть”),
разделяющая две “челюсти”
актин-связывающего центра
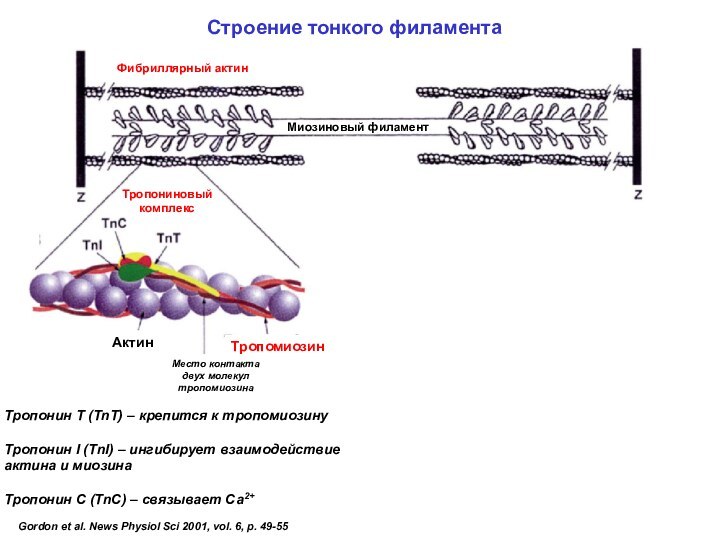
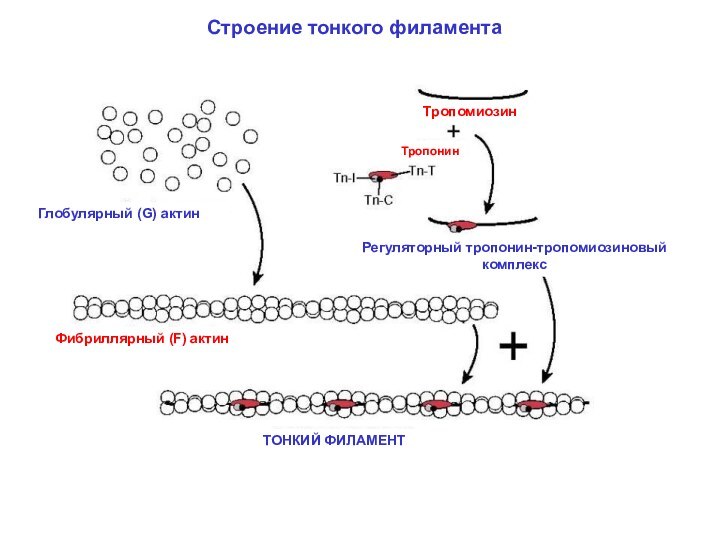
Тропонин T (TnT) – крепится к тропомиозину
Тропонин I (TnI) – ингибирует взаимодействие актина и миозина
Тропонин С (TnC) – связывает Са2+
Строение тонкого филамента
Фибриллярный актин
Миозиновый филамент
Тропонин T (TnT) – крепится к тропомиозину
Тропонин I (TnI) – ингибирует взаимодействие актина и миозина
Тропонин С (TnC) – связывает Са2+
Строение тонкого филамента
Фибриллярный актин
Миозиновый филамент
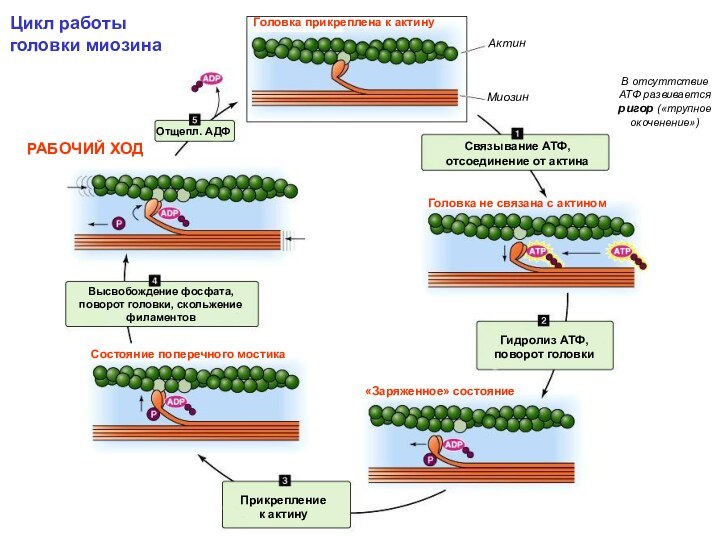
Головки миозина образуют поперечные мостики между толстыми и тонкими филаментами
Теория скольжения нитей была выдвинута
на основании двух независимых наблюдений
Andrew Huxley and Rolf Niedergerke
(Nature 173, 971-973 (22 May 1954)),
световая микроскопия: во время сокращения происходит сужение I-дисков, тогда как ширина А-дисков не изменяется
Hugh E. Huxley and Jean Hanson
(Nature 173, 973-976 (22 May 1954)),
электронная микроскопия: во время сокращения длина толстых и тонких филаментов не изменяется
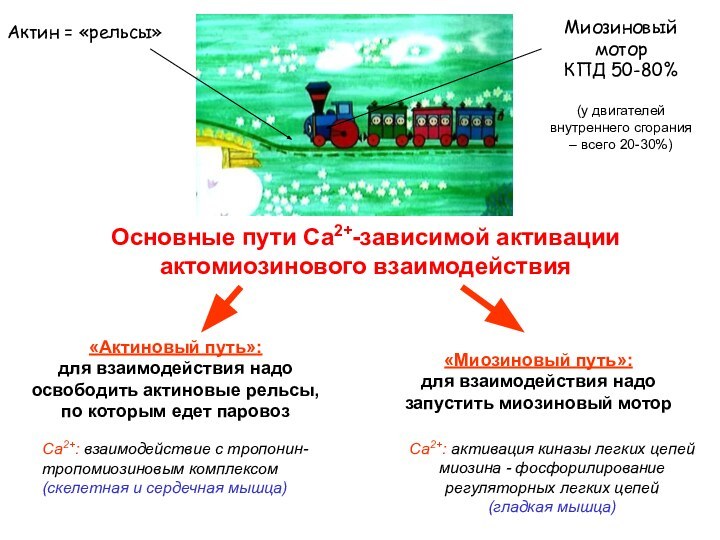
«Миозиновый путь»:
для взаимодействия надо запустить миозиновый мотор
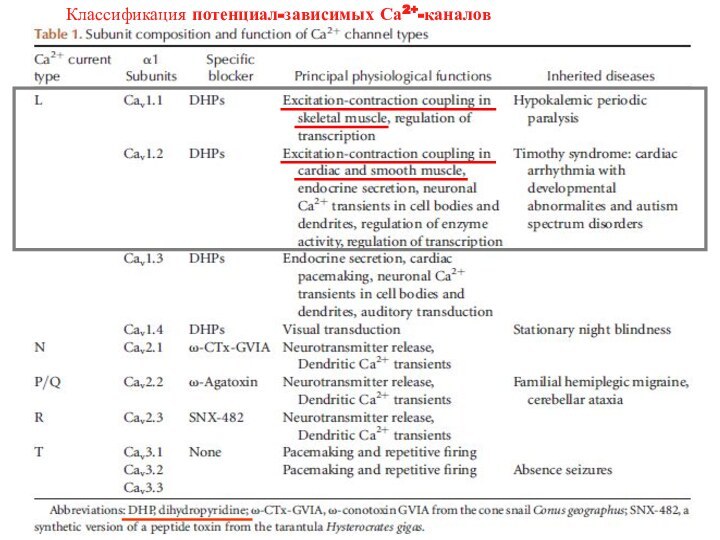
Са2+: взаимодействие с тропонин-тропомиозиновым комплексом
(скелетная и сердечная мышца)
Са2+: активация киназы легких цепей миозина - фосфорилирование регуляторных легких цепей
(гладкая мышца)
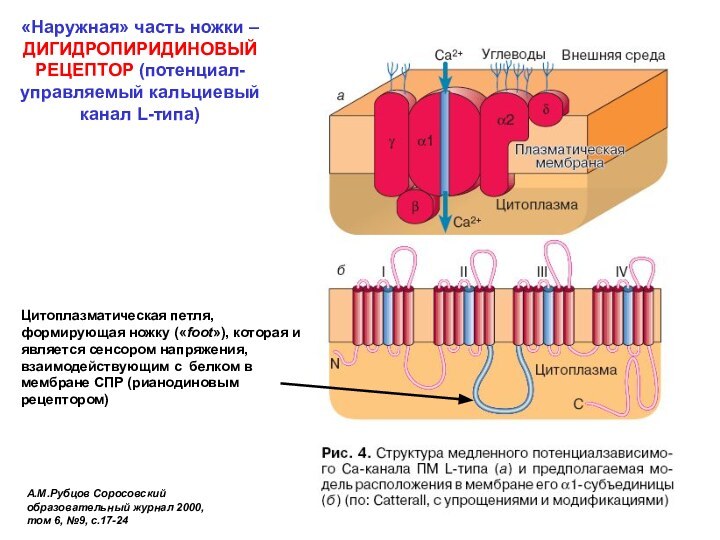
Цитоплазматическая петля, формирующая ножку («foot»), которая и является сенсором напряжения, взаимодействующим с белком в мембране СПР (рианодиновым рецептором)
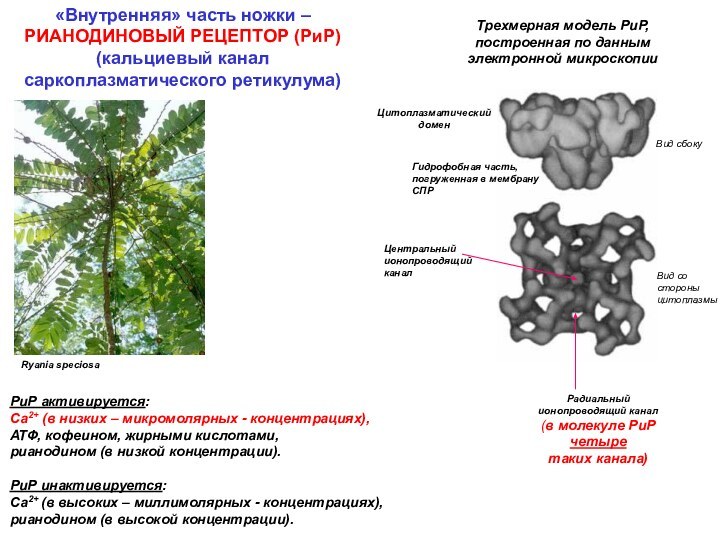
Центральный ионопроводящий канал
Радиальный
ионопроводящий канал
(в молекуле РиР
четыре
таких канала)
РиР активируется:
Са2+ (в низких – микромолярных - концентрациях), АТФ, кофеином, жирными кислотами,
рианодином (в низкой концентрации).
РиР инактивируется:
Са2+ (в высоких – миллимолярных - концентрациях), рианодином (в высокой концентрации).
«Внутренняя» часть ножки – РИАНОДИНОВЫЙ РЕЦЕПТОР (РиР) (кальциевый канал саркоплазматического ретикулума)
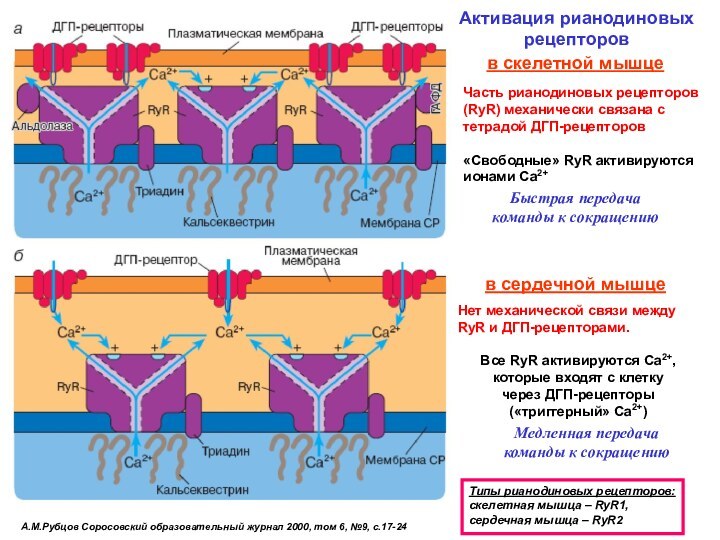
Часть рианодиновых рецепторов (RyR) механически связана с тетрадой ДГП-рецепторов
«Свободные» RyR активируются ионами Са2+
в скелетной мышце
в сердечной мышце
Нет механической связи между RyR и ДГП-рецепторами.
Все RyR активируются Са2+, которые входят с клетку
через ДГП-рецепторы
(«триггерный» Са2+)
Быстрая передача команды к сокращению
Медленная передача команды к сокращению
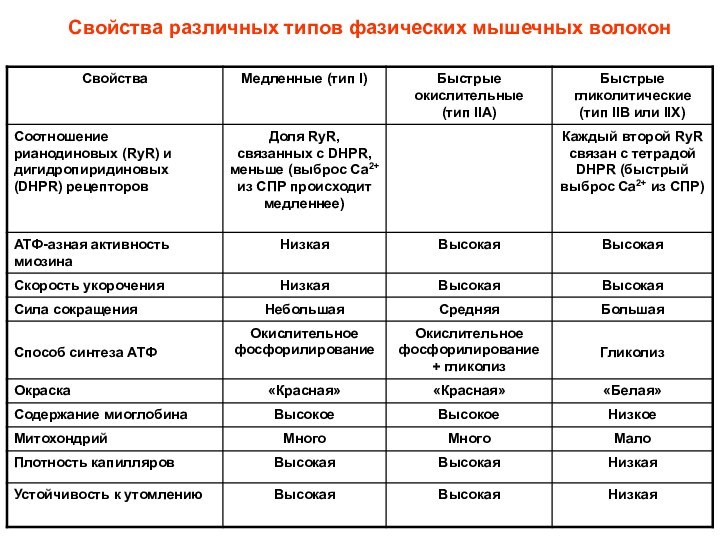
Изоформы тяжелых цепей различаются по АТФ-азной активности (количеству молекул АТФ, расщепляемых в единицу времени), т.е. по «длительности цикла срабатывания головки миозина»
Чем выше АТФ-азная активность миозина,
тем быстрее сокращается мышечное волокно
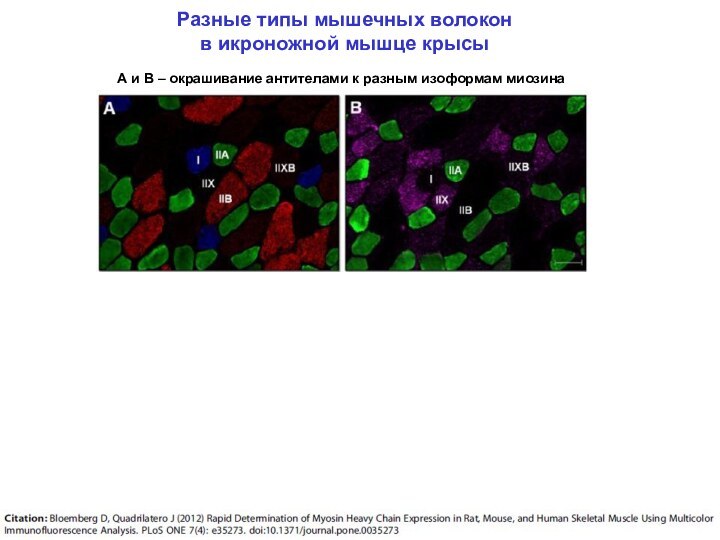
«м» - медленное, «б» – быстрое, «г» – гибридное
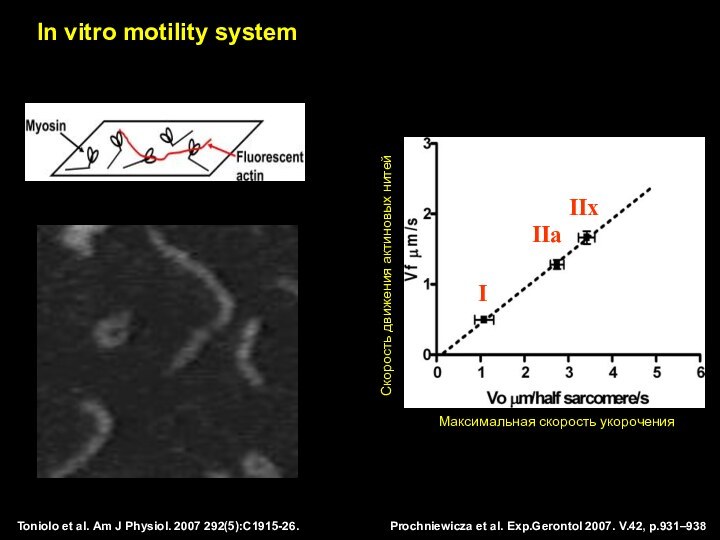
Максимальная скорость укорочения
Скорость движения актиновых нитей
I
IIa
IIx
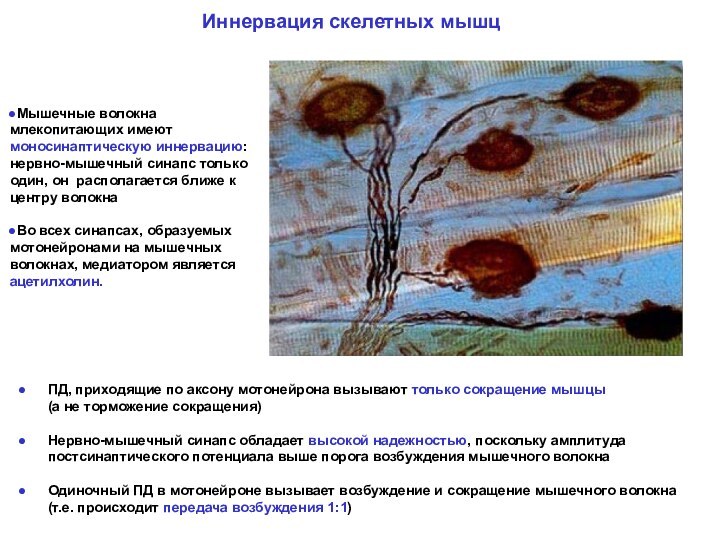
Мышечные волокна млекопитающих имеют моносинаптическую иннервацию: нервно-мышечный синапс только один, он располагается ближе к центру волокна
Во всех синапсах, образуемых мотонейронами на мышечных волокнах, медиатором является ацетилхолин.
Иннервация скелетных мышц
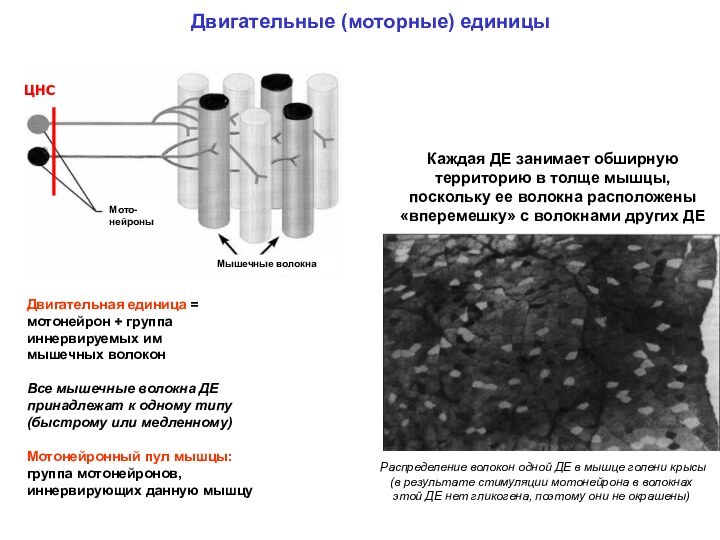
Мотонейронный пул мышцы: группа мотонейронов, иннервирующих данную мышцу
Каждая ДЕ занимает обширную территорию в толще мышцы, поскольку ее волокна расположены «вперемешку» с волокнами других ДЕ
Распределение волокон одной ДЕ в мышце голени крысы (в результате стимуляции мотонейрона в волокнах этой ДЕ нет гликогена, поэтому они не окрашены)
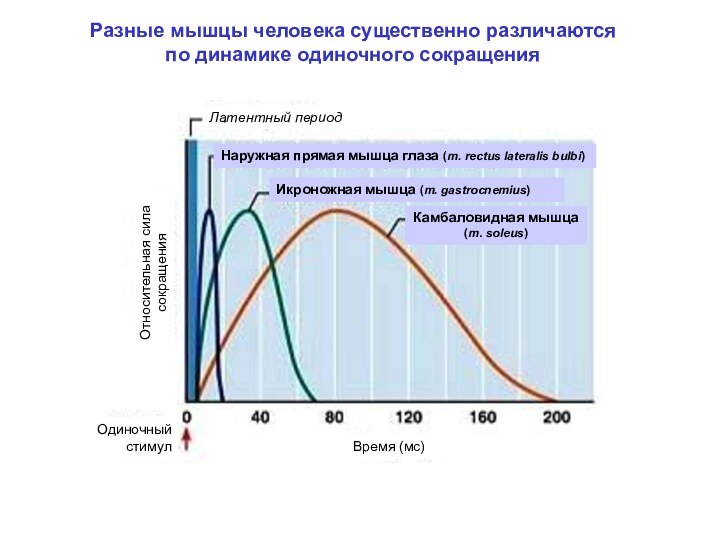
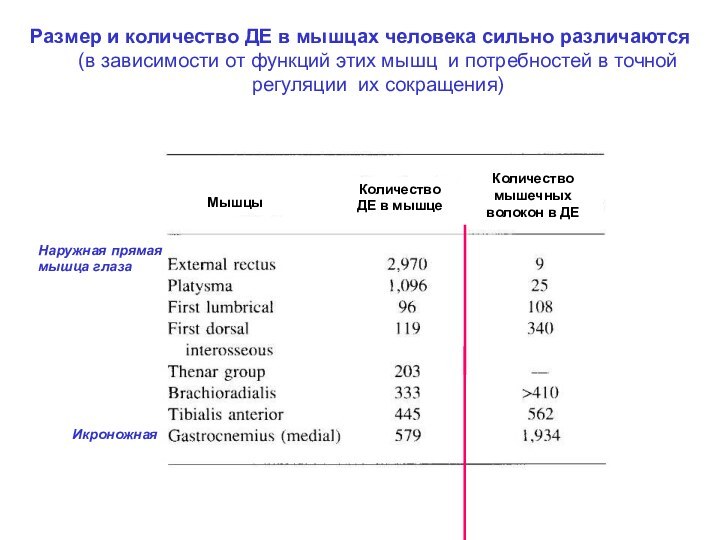
Наружная прямая мышца глаза
Икроножная
Мышцы
Количество ДЕ в мышце
Количество мышечных волокон в ДЕ
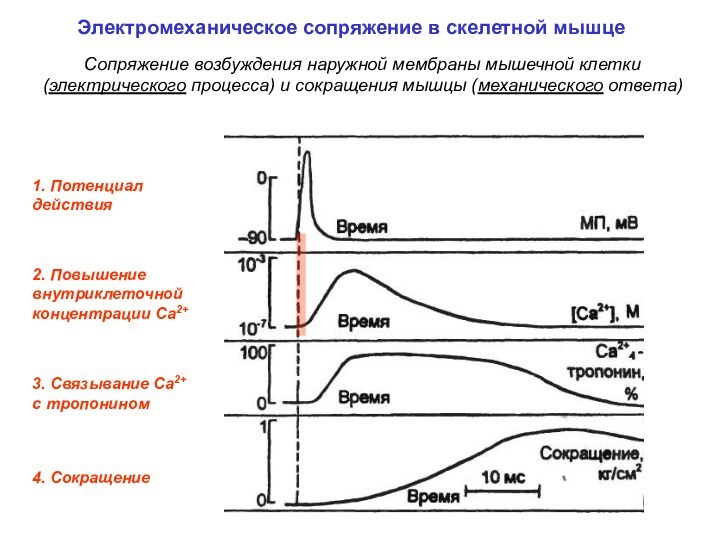
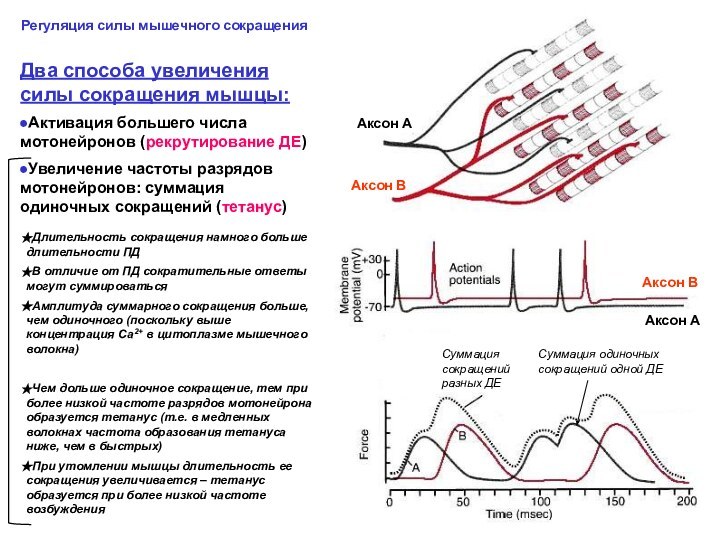
Регуляция силы мышечного сокращения
Длительность сокращения намного больше длительности ПД
В отличие от ПД сократительные ответы могут суммироваться
Амплитуда суммарного сокращения больше, чем одиночного (поскольку выше концентрация Са2+ в цитоплазме мышечного волокна)
Чем дольше одиночное сокращение, тем при более низкой частоте разрядов мотонейрона образуется тетанус (т.е. в медленных волокнах частота образования тетануса ниже, чем в быстрых)
При утомлении мышцы длительность ее сокращения увеличивается – тетанус образуется при более низкой частоте возбуждения
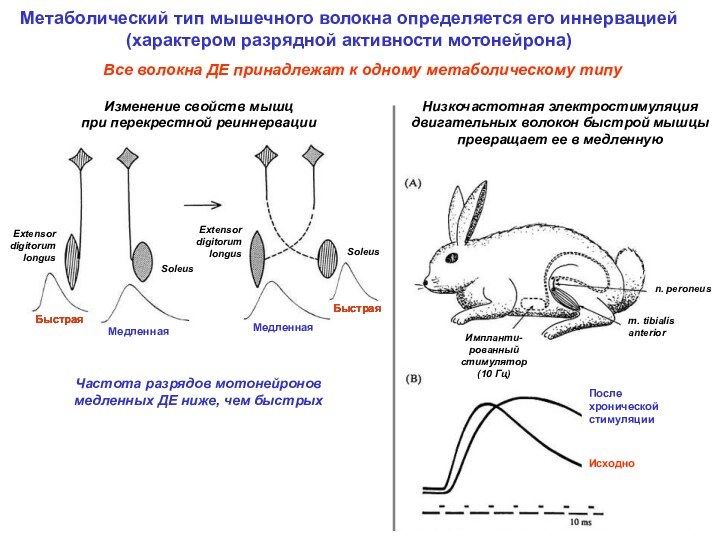
Частота разрядов мотонейронов медленных ДЕ ниже, чем быстрых
Все волокна ДЕ принадлежат к одному метаболическому типу
С: окрашивание на активность сукцинатдегидрогеназы
D: окрашивание на активность глицерофосфатдегидрогеназы