Слайд 2
Класифікація мінливості
Фенотипова мінливість організмів складається із спадкової і
неспадкової. До спадкової відносять таку мінливість, в основі якої
лежать зміни генетичного матеріалу, що передається нащадкам. В протилежність цьому, неспадкова мінливість не пов'язана з істотними змінами генотипу, а є лише виявом його здатності реагувати на умови зовнішнього середовища в межах так званої норми реакції. Отже, за спадкової мінливості зміни фенотипу є наслідком стійких змін генотипу, а за неспадкової мінливості змінюється лише фенотип. Тому неспадкова мінливість, яку ще називають модифікаційною, не передається наступним поколінням.
Спадкову мінливість поділяють на комбінаційну і мутаційну.
Слайд 3
Комбінаційна мінливість є наслідком двох добре відомих явищ:

незалежного розподілу хромосом у мейозі і випадкового поєднання їх
у зиготі, що створює розмаїття гібридних форм;
процесів генетичної рекомбінації, за яких у хромосомах утворюються нові комбінації наявних генів вихідних батьківських форм.
За даного типу мінливості структура хромосом і дискретних одиниць спадковості — генів — не змінюється, варіюють лише комбінації генів та взаємодія останніх у геномі. Тому комбінаційну мінливість розглядають як вторинне явище, а первинними вважають мутаційні процеси.
Мутаційна мінливість — це результат виникнення нових алелів генів і навіть більш істотних перебудов у генетичному апараті клітин. Ці перебудови можуть здійснюватися на рівні хромосом та інших носіїв генетичної інформації. В усіх випадках вони мусять бути незворотними і передаватись із покоління у покоління Саме такі особливості властиві мутаціям — відносно стійким структурним змінам генетичних нуклеїнових кислот, що призводять до появи нових генотипів і фенотипів.
Розрізняють також так звану онтогенетичну мінливість, що властива одному і тому ж організмові на різних стадіях його онтогенетичного розвитку. Фактично це реалізація генетичної програми розвитку, тобто реалізація норми реакції даного генотипу в часі. За цим критерієм онтогенетична мінливість відноситься до неспадкової. Однак є безперечні докази того, що за індивідуального розвитку можливі деякі незворотні зміни генетичного матеріалу.
Слайд 4
Мутації і модифікації, їх відмінності
Автор мутаційної теорії Г.
де Фріз визначив мутації як стрибкоподібні, переривчасті зміни спадкових
ознак. Це чітке, хоч і недосконале, визначення дійсне і сьогодні.
На деякі найважливіші відмінності мутацій і модифікацій слід звернути особливу увагу. Ч. Дарвін називав мутаційну мінливість невизначеною, враховуючи те, що у відповідь на дію одного фактора можуть виникати зовсім різні спадкові зміни ознак і, навпаки, різні фактори зовнішнього середовища можуть призводити до однакових спадкових змін фенотипу. Що ж до модифікаційної мінливості, то Ч. Дарвін її називав визначеною, бо в цьому випадку характер фенотипових змін можна заздалегідь прогнозувати, знаючи, який фактор діятиме.
Слайд 5
Основні відмінності мутацій і модифікацій
Слайд 6
Класифікація мутацій
В основі класифікацій, ідо використовуються, лежать різні

принципи. В сучасній генетиці залежно від принципів класифікації мутації
поділяють на такі:
1. Залежно від змін генотипу:
а) генні або точкові мутації — зміни структури ДНК у межах гена;
б) хромосомні мутації або хромосомні перебудови — порушення структури хромосом;
в) геномні мутації — випадкові зміни кількості окремих хромосом або кількості хромосомних наборів.
2. Залежно від способу виникнення мутацій:
а) спонтанні, що постійно виникають у природі без очевидних причин і з певною частотою;
б) індуковані мутації, що виникають у відповідь на дію різноманітних факторів середовища.
3. За виявом у гетерозиготи:
а) домінантні мутації;
б) рецесивні мутації.
4. За відношенням до норми або так званого дикого типу:
а) прямі мутації, за яких гени дикого типу перетворюються в алельні форми;
б) супресорні і зворотні мутації, за яких відновлюється дикий фенотип. Повернення мутанта до дикого фенотипу (тобто реверсія) найчастіше є результатом супресії, тобто іншої мутації. Зворотні мутації, за яких ушкоджений ген повністю відновлює свою будову і перетворюється у вихідний ген дикого типу, бувають рідко.
Слайд 7
5.3а локалізації в еукаріотній клітині:
а) ядерні, якщо мутації

відбуваються в ДНК ядра;
б) цитоплазматичні, якщо мутації відбуваються в
ДНК цитоплазми.
6. В залежності від типу клітин, в яких виникають мутації:
а) генеративні — виникають у статевих клітинах та їх попередниках;
б) соматичні — виникають у соматичних клітинах і розповсюджуються за їх мітотичного поділу.
7. За фенотиповим виявом:
а) морфологічні — мутації, що проявляються тими чи іншими змінами будови клітин та організмів, структури колоній прокаріотів тощо;
б) фізіологічні — супроводжуються порушенням фізіологічних функцій;
в) біохімічні — мутації, для яких встановлена суть основних порушень обміну речовин, в першу чергу на рівні білкових молекул.
8.3а впливом на адаптивну здатність клітин і організмів:
а) корисні мутації — за фенотиповим проявом імітують адаптивні модифікації і тому сприяють збереженню виду за даних умов;
б) нейтральні мутації — не впливають на життєздатність клітин і організмів;
в) субівлетальні мутації — знижують життєвість генотипів на 50—90%;
г) летальні — призводять до загибелі 100% генотипів, що мають таку мутацію;
д) умовно-летальні мутації — проявляються лише за певних умов.
З наведених класифікацій найглибше генетичне підґрунтя має класифікація, що основана на характері змін у генотипі. На жаль, не для всіх мутацій відома суть генотипових порушень. Тому поруч з класифікацією, що ґрунтується на врахуванні змін у генетичному апараті, широко використовується найбільш еклетична класифікація, яка основана на особливостях змін фенотипу, а також інші класифікації.
Слайд 8
Загальна характеристика деяких типів мутацій
СПОНТАННІ ТА ІНДУКОВАНІ МУТАЦІЇ
Спонтанні

або природні мутації виникають з певною частотою (1 *
10-5— 1 * 10-9) без будь-яких видимих причин. З'ясовано, що частота цих мутацій дуже залежить від генотипу. Так, у дрозофіли частота появи летальних мутацій у Х-хромосомі в середньому складає 0,15%, однак у природі зустрічаються лінії із спадково обумовленою здатністю до високої мутабільності — 1% мутацій на покоління.
Поруч з генами, які мутують із звичайною частотою (10-5— 10-8 і рідше), описано гени, що відрізняються значно вищою мутабельністю. Є т.з. “гарячі точки” де частота мутацій може бути на 2 порядки вище. Високомутабельні гени знайдено у цілого ряду рослин — кукурудзи, дельфініума та ін. Соматичні мутації таких генів є причиною виникнення строкатого забарвлення листя, пелюсток та інших частин рослини.
Крім того, є гени, які можуть як збільшувати частоту мутацій інших генів (гени-мутатори), так і зменшувати її (гени-антимутатори). Так, за наявності гена mutT частота деяких генних мутацій (трансверсій) у кишкової палички зростає в 10 000 разів, а наявність гена mutL збільшує кількість мутацій (транспозицій і порушень рамки зчитування) у 100 разів.
Однією з причин високої частоти соматичних мутацій виявились інсерції — вставки в різні місця хромосом мобільних генетичних елементів (транспозонів, ретропозонів і т. п.). Це показано для кукурудзи (Б. Мак-Клінток), для дрозофіли (Г. Б. Георгієв) та інших об'єктів. Для багатьох локусів дрозофіли, на думку М. Д. Голубовського, вставка мобільного генетичного елемента є головною причиною мутагенезу.
Природні мутанти виникають досить рідко. Збільшити частоту мутацій можна шляхом індукованого мутагенезу.
Слайд 9
У 1927 р. Г. Меллер виявив мутаційний вплив

рентгенівського опромінення на дрозофілу. В наступні роки і десятиліття
мутагенна дія іонізуючих та ультрафіолетових опромінень була досліджена на численних об'єктах — рослинах, тваринах, прокаріотах.
Був відкритий також і хімічний мутагенез: В. В. Сахаров (1932), М. Ю.Лобашов і Ф. А. Смирнов (1939) показали, що деякі хімічні сполуки індукують рецесивні леталі в Х-хромосомі дрозофіли. В 1939 р. С. М. Гершензон вперше виявив сильну мутагенну дію екзогенної ДНК та окремих продуктів її розпаду.
Дуже важливою віхою в розвитку генетики було відкриття над-мутагенів (супермутагенів) — хімічних сполук, що індукують мутації з високою частотою — до 100%. Це було зроблено в 1946 р., коли І. А. Рапопорт сповістив про високу мутагенну активність етиленіміну, а Ш. Ауербах і Дж. Робсон — азотистого іприту, до супермутагенів також відноситьсзя звичайний NO2.
Згодом були відкриті речовини-антимутагени, що ослаблюють дію хімічних та фізичних факторів на ДНК і за рахунок цього або інших захисних механізмів зменшують частоту мутацій.
Індукований мутагенез став сьогодні одним із основних шляхів отримання нових вихідних форм для селекції у сільському господарстві та пошуку антибіотиків.
Слайд 10
Таким чином за природою мутагенів можна виділити наступні
їх групи
Фізичні мутагени — рентгенівське та УФ опромінення
Хімічні мутагени
— різноманітні хімічні сполуки
Біологічні мутагени — віруси
Слайд 11
Хімічні мутагени
Перші хімічні мутагени були відкриті в 30-х
рр. XX ст. В. В. Сахаровим, М. Ю. Лобашовим
і С. М. Гершензоном, а через деякий час ці дослідження досягли широкого розмаху завдяки дослідженням І. А. Рапопорта (СРСР) і Ш. Ауербах (Великобританія), які вперше виявили 100-процентний мутагенний ефект у окремих хімічних сполук — супермутагенів.
За механізмами мутагенної дії хімічні сполуки можна віднести до таких основних груп:
Хімічні агенти, що модифікують азотисті основи нуклеїнових кислот.
Аналоги азотистих основ, що можуть залучатися до складу полінуклеотидів.
Речовини-інтеркалятори, що здатні вбудовуватися між двома сусідніми азотистими основами полінуклеотидного ланцюга ДНК.
Сполуки з комбінованою мутагенною дією.
Слайд 12
Вставка молекули акридину (чорний диск) між нуклеотідами у
спіралі ДНК
Слайд 13
Механізм мутаційної дії 5-бромурацила (по Г. Сгенту, 1974,
з доповненнями). А — спаринание 5-бромурацила (BU) з адснином
і Б — з гуаніном (унизу — два механізми індукції транзиций); В — помилка реплікації, що складає в тім, що BU включається при реплікації (/) на місце Т, а потім спаровується, перебуваючи в рідкої енольной формі, з G (2); у третьому циклі реплікації (3) G нормально спаровується із С, і в такий спосіб завершується перехід AT ? ? GC. Г — помилка включення, що складає в тім, що BU у рідкої енольной формі спаровується з G(/), a потім у звичайної кетоформе спаровується з А (2); у третьому циклі реплікації (3) А нормально спаровується з Т, і в такий спосіб завершується перехід GC ? ? AT
Слайд 14
Схема виникнення транзицій у результаті окисного дезамінування основ
ДНК азотистою кислотою (по Дж. Уотсону, 1978, з доповненнями
з Г. Стента, 1974). А — аденін дезамінується до гіпоксантину, що спаровується із цитозіном; Б — цитозін дезамінується до урацила, що спаровується з аденином; В — гуанін дезамінується до ксантина, що продовжує, як і гуанін, спаровуватися із цитозіном.
Таким чином, дезамінування гуаніну не спричиняє мутацій. Праворуч - послідовні стадії спарюванні основ при репликаціях ДНК, яка оброблена азотистою кислотою
Слайд 15
Є певні гени, які контролюють ДНК полімеразну активність
та репараційну-екзонуклеазну активність. Всі ДНК полімерази мають дві активності
— 5’-3’ полімеразної та 3’ 5’ – екзонуклеазної, яка виконує функції корекції при реплікації ДНК.
ДНК полімераза в 3’-5’ напрямку відщеплює помилкові основи, що включені до ДНК. Таким чином частота помилок реплікації залежить від співвідношення полімеразної та екзонуклеазної активності ДНК полімерази. Мутаторна та антимутаторна активність є в алелях інших генів, що контролюють реплікацію. Гени, які кодують ДНК лігазу, ДНК-з’вязуючі білки.
Слайд 16
Точкова або генна мутація — це зміна структури
молекули генетичної ДНК або РНК на вузькій ділянці одного
гена. Такі мутації виникають внаслідок перестановки, випадіння (делеції), вставки (інсерції) або заміни окремих нуклеотидів у полінуклеотидному ланцюгу. В усіх цих випадках спостерігаються ті чи інші зміни в первинній структурі відповідних поліпептидів. Можлива заміна одної амінокислоти на іншу; втрата якої-небудь амінокислоти або додаткове включення зайвої; повне спотворення послідовності амінокислот у певному місці або майже по всій довжині поліпептиду; врешті повноцінний синтез останнього може взагалі не відбутися, якщо він обривається в місці розташування одного із нонсенс-кодонів, які випадково виникають внаслідок точкових мутацій. Генні мутації — це наслідок “трьох Р” — репарації, рекомбінації, реплікації. Мутації, які спостерігаються, це те, що залишається коли все інше виправлено.
Слайд 17
Точкова або генна мутація — це зміна структури
молекули генетичної ДНК або РНК на вузькій ділянці одного
гена. Такі мутації виникають внаслідок перестановки, випадіння (делеції), вставки (інсерції) або заміни окремих нуклеотидів у полінуклео-тидному ланцюгу. В усіх цих випадках спостерігаються ті чи інші зміни в первинній структурі відповідних поліпептидів. Можлива заміна одної амінокислоти на іншу; втрата якої-небудь амінокислоти або додаткове включення зайвої; повне спотворення послідовності амінокислот у певному місці або майже по всій довжині поліпептиду; врешті повноцінний синтез останнього може взагалі не відбутися, якщо він обривається в місці розташування одного із нон-сенс-кодонів, які випадково виникають внаслідок точкових мутацій.
Слайд 18
По характеру змін у послідовності нуклеотидів генні мутації
поділяють на такі:
1. Транзиції — заміна одної пуринової основи
на іншу пуринову, або піримідинової— на іншу піримідинову (А ?? G; Т ?? С);
2. Трансверсії — заміна в полінуклеотидному ланцюгу пуринової основи на піримідинову чи навпаки (А ?? Т; G ?? С; А ?? С; G ?? Т).
3. Вставки (інсерції) одного або декількох зайвих нуклеотидів;
4. Випадіння (делеції) одного або декількох нуклеотидів;
5. Перестановки сусідніх нуклеотидів.
Заміни одного нуклеотиду на інший в триплеті можна поділити на нейтральні, місенс-мутації і нонсенс-мутації. У випадку нейтральних мутацій смислове значення кодону не змінюється в зв'язку з виродженістю коду; завдяки йому одна і та ж амінокислота може кодуватися двома або й більшим числом триплетів.
Слайд 19
Точкові мутації: А – транзиції, Б - трансверсії
Слайд 20
Нонсенс-мутації виникають тоді, коли заміна одного нуклеотиду в

кодоні перетворює цей кодон в один із трьох можливих
термінуючих (або нонсенс) триплетів.
Прикладом місенс-мутацій, за яких амінокислотні заміни частково порушують функцію, але ці порушення сумісні з життєдіяльністю, є деякі форми гемоглобінопатій — спадкових захворювань, причиною яких є зміна структури молекули гемоглобіну (Hb). Більшу частину мутантних варіантів гемоглобіну людини складають поодинокі заміни амінокислот, в основі яких лежать заміни окремої азотистої основи іншою у складі триплету відповідного гена.
Такі ж заміни (транзиції чи трансверсії) можуть бути причиною низки ензимопатій — спадкових порушень функцій окремих ферментів.
Інші типи генних мутацій — вставки (інсерції) та випадіння (делеції) можуть призвести до зсуву рамки зчитування, внаслідок чого праворуч мутантного сайта змінюється зміст усіх кодонів. Це буває в тих випадках, коли кількість нуклеотидів, що додатково вставляються в певний сайт, або втрачаються в ньому, не є кратною трьом
Слайд 21
Репарація ДНК
Дивовижна стабільність генетичного матеріалу — ДНК зв'язана
аж ніяк не з її консервативністю, а з існуванням
у клітинах всіх живих організмів спеціальних систем репарації, що усувають із ДНК виникаючі в ній ушкодження.
Явище репарації, або відновлення життєздатності клітини, після дії на неї γ- і рентгеновых променів було відкрито в 1958 р. В. И. Корогодиним у диплоїдных дріжджів. Ушкодження ДНК, що виникають при дії випромінювань і хімічних агентів, в остаточному підсумку приводять до порушення регулярної Уотсон-Криковскої структури, що виражається в локальній денатурації молекули й приводять до часткового або повного блокування реплікації. Саме такі порушення конформації, а не конкретні зміни мономерів служать мішенню для більшості систем репарації ДНК.
У цей час виявлені три основних механізми репарації ДНК: фотореактивація, ексцизійна репарація й пострепликативна репарація. Останні два типи називають також темновою репарацією.
Слайд 22
Основні типи ушкоджень, виявлені у ДНК, екстрагованої
із клітин, опромінених ультрафіолетовим світлом (по К.Смиту, Ф. Хэнеуолту,
1972): С - цукор, Ф - фосфат
Слайд 23
Локальна денатурація (розрив водневих зв'язків) ДНК бактеріофага Л,
підданої ультрафіолетовому опроміненню (R. S. Stafford, D. P. Allison,
R. О. Rahn, 1975)
Слайд 24
Механізми репарації ушкодженої ДНК
Крім помилок, що виникають у

процесі реплікації, ДНК може нести ушкодження, що виникають спонтанно
або під дією певних чинників незалежно від роботи реплікаційних ДНК-полімераз. Такі ушкодження можуть полягати в будь-яких відхиленнях від звичайної структури ДНК — від точкових уражень до більш глибоких перебудов. Наявність у ДНК внутрішньоланцюгових поперечно зчеплених структур або міжланцюгових зшивок може бути серйозною завадою для реплікації і транскрипції. Такі ушкодження сприяють виникненню мутацій, якщо вони не будуть вилучені до початку наступного циклу реплікації. Усунення зазначених ушкоджень в ДНК здійснюється за допомогою систем репарації, які за своєю складністю часто не поступаються реплікаційному апаратові.
Одні репараційні системи відносно специфічні у відношенні певних ушкоджень, інші реагують на будь-які відхилення в структурі ДНК.
У найбільш вивченого об'єкта — кишкової палички — відомо чимало механізмів репарації ДНК, серед яких розрізняють механізми прямої реактивації і темнової репарації ДНК- До прямої реакти-вації відноситься світлова репарація (або фотореактивація) ДНК та деякі інші. Темнова репарація включає ексцизійну, рекомбінаційну та ряд індуцибельних репаративних систем.
Слайд 25
Типи репарації
ФОТОРЕАКТИВАЦІЯ
Явище фотореактивації полягає у відновлень біологічної

активності кліток або молекул ДНК, ушкоджених ультрафіолетовим випромінюванням у
результаті наступного впливу видимого світла.
Фотореактивація при дії видимого світла (300—400 нм — найбільш активна частина спектра) була виявлена в 1949 р. у декількох лабораторіях. Механізм цього явища був розкритий на початку 60-х років нашого століття після виділення К. Рупертом із клітин мікроорганізмів ферменту фотореактивації — дезоксірибопиримідинфотоліази. Екстракти дріжджів виявилися здатними відновлювати активність, що трансформує, ДНК Haemophyllus influenzae на світлі.
Субстратом ферменту фотореактивації служать димеры пиримідинових основ, з якими він утворить комплекс у темряві (з неушкодженої ДНК фермент не зв'язується). На світлі комплекс розпадається, при цьому відбувається мономеризация димерів. У клітці еукаріот фермент локалізований у ядрі, у прокаріот — у безпосередній близькості до нуклеоїду. Зокрема, він не виявляється в безнуклеоїдних мініклітинах, які утворять деякі мутанти Е. coli.
Відомий мутант phr E. coli, у якого блокована фотореактивація. При опроміненні видимим світлом у цього мутанта не зникають тимінові димери із ДНК.
Фермент фотореактивації широко розповсюджений у природі й виявлений навіть у таких примітивних вільноіснуючих мікроорганізмів, як мікоплазми, знайдений він у клітках багатьох вищих рослин і тварин.
Слайд 26
Схема механізмів репарації на прикладі пострадіаційного (УФ) відновлення
структури ДНК (по P. Hanawalt, 1975, Е. Witkin, 1976):
А — фотореактивація; Б — ексцизійна репарація; В — постреплікативна репарація
Слайд 27
Пряма реактивація ушкоджених молекул ДНК
Деякі ушкодження ДНК усуваються

шляхом прямої реактивації.
У бактерій існує спеціальний фермент метилтрансфераза, який
переносить метильну або етильну групу з основи, що була алкілована хімічними сполуками, на один із власних цистеїнових залишків. При цьому метилтрансфераза інактивується, але в такому стані може стимулювати активність власного гена і деяких інших, що призводить до включення індуцибельної системи репарації у відповідь на дію алкілуючих сполук.
У багатьох організмів виявлена так звана світлова репарація, завдяки якій в умовах видимого світла (особливо 300—400 нм) розриваються ковалентні зв'язки між сусідніми піримідиновими основами, які утворюються в умовах ультрафіолетового опромінення (220—320 нм). Саме так ліквідуються найчастіше виникаючі внутрішньоланцюгові тимінові димери.
Світлова репарація тимінових димерів здійснюється фотореак-тивуючим ферментом або фотоліазою. У Е. соlі цей фермент кодується одним геном (phr) і являє собою поліпептид з молекулярною масою 35 кДа, який міцно зв'язаний з олігорибонуклеотидом (10— 15 основ). Фотоліаза приєднується до ДНК у місці знаходження піримідинового димера і в умовах освітлення (300—600 нм) ліквідує ковалентний зв'язок між основами, що утворюють димер.
Піримідинові димери усуваються також і іншими механізмами, які відносяться до систем темнової репарації. Наявність таких систем дуже важлива, бо фоторепарація може усувати до 90% ушкоджень, індукованих ультрафіолетовим опроміненням, але ніколи не буває повною.
Слайд 28
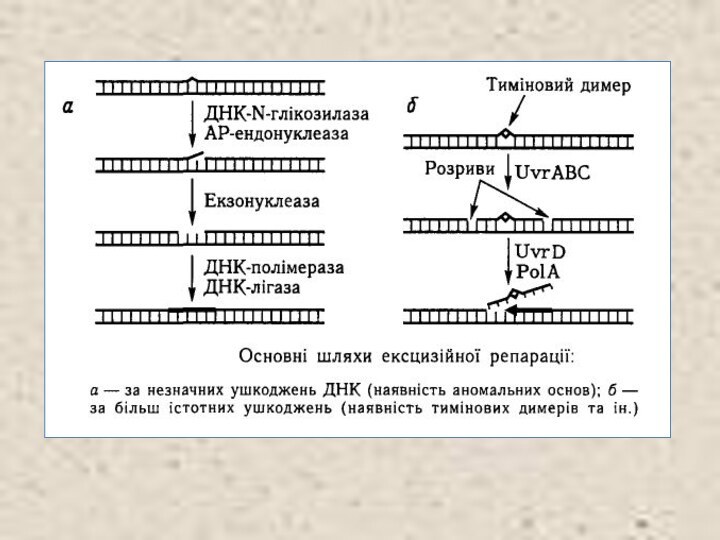
Ексцизійна репарація
Якщо неможлива пряма реактивація, то працюють механізми

ексцизійної репарації. Остання здійснюється шляхом вирізування ушкоджених ділянок ДНК
і наступного забудовування утворених виломів новими нуклеотидами на матриці комплементарного неушкодженого ланцюга. Таку систему репарації іноді називають системою «вирізай і латай». Процес ексцизійної репарації складається із таких етапів:
1) розпізнавання ушкодження;
2) розрізання (інцизії) спотвореного ланцюга поблизу ушкодження;
3) вилучення (ексцизії) ушкодженої ділянки відповідного ланцюга;
4) репараційного синтезу ДНК на місці вилому;
5) відновлення неперервності репарованого ланцюга шляхом лі-газної реакції.
Ферментативна система ексцизійної репарації добре вивчена у Е. соlі. Виявлені та картовані відповідні гени, мутації в яких порушують репарацію і стимулюють мутаційний процес.
Репарація таких ушкоджень, які істотно порушують структуру ДНК, наприклад тимінових димерів, здійснюється за участю спеціального ферменту — ендонуклеази UvrABC або УФ-ендонуклеази (гени uvrA, uvrB, uvrC). Ця ендонуклеаза розпізнає тиміновий ди-мер (або інші спотворення ланцюга ДНК) і здійснює два однолан-цюгові розтини ДНК з 5'- і З'-боків від ушкодження. Відстань між цими двома інцизіями — 12—ІЗ пуклеотидів. В інших випадках ексцизія дефектних фрагментів здійснюється за допомогою так званої ексцизійної нуклеази або ексцинуклеази.
Слайд 30
ПОСТРЕПЛІКАТИВНА РЕПАРАЦІЯ
Цей тип репарації був відкритий у клітинах

мутантів Е. coli, не здатних вилущувати тимінові димери. У
таких клітинах після ультрафіолетового опромінення відбувається реплікація ДНК, хоча й повільніше, ніж у клітинах дикого типу. У. Рапп і П. Говард-Фландерс показали, що в клітинах мутантів uvr А після дії ультрафіолетового світла синтезується ДНК із однонитковими пробілами, або проломами, причому довжина знову синтезованих фрагментів відповідає середній відстані між виниклими в батьківської ДНК тиміновими димерами. Таким чином, після реплікації нерепарованій ДНК проти тимінових димерів утворяться проломи, які, як виявилося, зникають при наступній інкубації клітин у живильному . Цей тип репарації не відбувається в клітинах rес-мутантів, дефектних по рекомбінації. Тому пострепликативну репарацію називають також рекомбінаційною репарацією.
Механізм пострепликативної репарації найменш специфічний, тому що тут відсутній етап дізнавання ушкодження. Подання про цей тип репарації зв'язані зі знанням механізму рекомбінації. Рекомбінаційна пострепликативна репарація — це швидкий спосіб відновлення нативної структури принаймні частини дочірніх молекул ДНК. При цьому тимінові димери залишаються у вихідних батьківських нитках. Ця репарація відбувається вже в перші мінути після опромінення.
Існує й інший різновид — повільна пострепликативна репарація, для здійснення якої потрібно декілька годин. Її проводить система ферментів, яких немає в неопромінених клітинах і яку індукує опромінення. Цей механізм одержав найменування SOS-репарації. Його характерна риса — неточність відновлення первинної структури ДНК, в зв'язку із чим він одержав також назву репарації, схильної до помилок. При цьому, на думку ряду авторів, можливий ріпаративний синтез ДНК «в обхід» тимінових димерів, або, точніше за рахунок використання як матриця ланцюга ДНК, що містить димери.
Пострепликативна репарація існує не тільки в бактерій, але й у клітинах еукаріот. Вона виявлена й у ссавців, для яких отримані дані про те, що пострепликативні проломи можуть заповнюватися не за рахунок рекомбінації, а за рахунок синтезу ДНК de novo.
Слайд 32
Схема досліду Д. Петтіджона й Ф. Хєнеуолта, що
доводить існування репаративного синтезу ДНК у клітках Е. coli,
опромінених ультрафіолетовим світлом (по К.Смиту, Ф. Хенеуолту, 1972): А — реплікативний синтез ДНК; Б — репаративний синтез ДНК
Слайд 33
Методи вивчення мутацій
Дослідження мутаційного процесу як частина генетичного

аналізу ставить два зв'язані завдання: вивчення механізмів спонтанного й
індукованого мутагенезу й одержання мутантів для маркірування генетичного матеріалу або для одержання корисних форм організмів. Частота мутаційного процесу служить також критерієм присутності в навколишнім середовищі генетично активних факторів.
Основний метод вивчення мутаційного процесу - визначення його частоти. При цьому експериментатори додержуються правил, які були сформульовані Н. В. Тимофєєвим-Ресовським (1934):
Робота можлива тільки з генетично чистим матеріалом, тобто інбредними або чистими лініями, гомозиготними по досліджуваних генах.
Необхідно оперувати досить більшими кількостями як у контролі, так і в обробленому мутагенами матеріалі.
Для реєстрації виникаючих мутацій варто застосовувати зручні генетичні методи,
Аналізувати будь-які отримані зміни, для того щоб установити чи спадкові вони (цитоплазматичні або ядерні, хромосомні або генні).
Потрібне знання способу дії мутагену на зародкові клітини обробленого організму.
Слайд 34
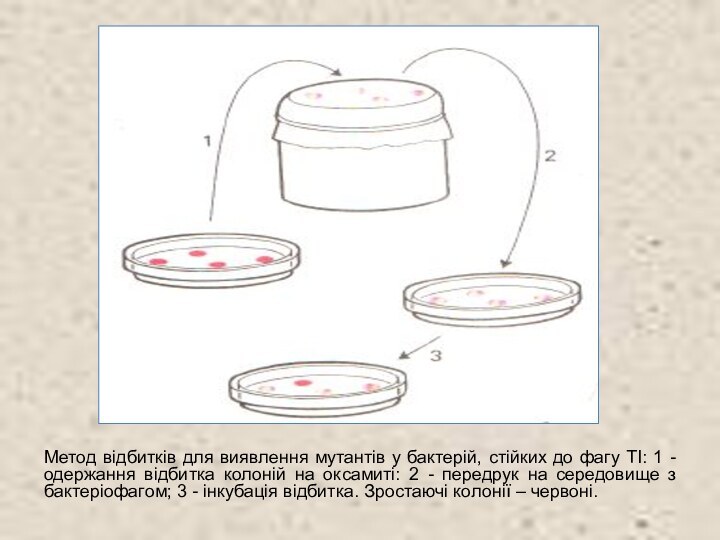
Метод відбитків для виявлення мутантів у бактерій, стійких
до фагу TI: 1 - одержання відбитка колоній на
оксамиті: 2 - передрук на середовище з бактеріофагом; 3 - інкубація відбитка. Зростаючі колонії – червоні.
Слайд 35
Облік частоти мутантів E. coli стійких до бактеріофага,
методом прямого розсіву
Слайд 36
Визначення частоти спонтанного мутування Ade ? Ade+ у
штаму дріжджів, мутантного по гену ade2. A — загальна
схема експерименту. Після інкубації відбитка на середовищі, напівзбагаченої аденіном, виростають червоні колонії. На деякі з них білі «бородавки» - колонії вторинного росту — мутанти; Б — загальний вид чашки Петрі із середовищем, напівзбагаченої аденіном, на якій виросли колонії (упорядкований посів) Ade — (видні «бородавки» — мутантні колонії вторинного росту — білі); В — збільшений фрагмент тої ж чашки (але Н. Н. Хромову-Борисову)
Слайд 37
Передмутаційні зміни генетичного матеріалу
Ще на початку 20-х років

А. Стертевант, а потім Н. И. Шапіро, на основі
досліджень D. melanogaster запропонували розглядати мутабільність як адаптивну ознаку виду. Дійсно, знаючи про існування генів-мутаторів і антимутаторів, що підвищують і знижують спонтанну частоту мутацій, характерну для організмів дикого типу, варто прийняти, що частота мутацій у природі оптимізована на якомусь певному рівні.
Так, Дж. Дрейк звернув увагу на те, що в різних мікроорганізмів - бактерій, бактеріофагів, грибів - загальна частота спонтанного мутування в перерахуванні на реплікацію геному приблизно однакова - близько 1 %. Оскільки величина геному мікроорганізмів варіює більш ніж в 1000 разів, і середня мутабільність у перерахуванні на пари нуклеотидов або на один ген середнього розміру повинна варіювати назад пропорційно розміру генома, тобто більш ніж в 1000 разів. Поки невідомо, яким образом вирівнюється частота мутацій у перерахуванні на гаплоїдный геном і чому в диплоїдных організмів ця величина, за деяким даними, зростає майже до 100% на геном за статеве покоління.
Яка природа предмутаційних, або потенційних, змін генетичного матеріалу і яка їхня подальша доля? З матеріалу цієї глави стає очевидним, що лише невелика частина ушкоджень генетичного матеріалу перетворюється потім у мутаційні зміни. Більша частина їх усувається системами репарації. Один зі способів виявлення потенційних змін генів був запропонаваний М. Е. Лобашевым. Це послідовна дія двох факторів — мутагенного, наприклад рентгеновых променів, і немутагенного — підвищеної температури. М. М. Тихомирова й К. В. Ватті застосували цей підхід до дослідження мутаційного процесу в дрозофили. Виявилося, що значна частка потенційних змін, викликуваних рентгеновыми променями, усувається звичайно репарацією, може бути перетворена в мутації при наступній дії підвищеної температури. Це явище одержало назву ефекту післядії.
Слайд 38
Хромосомні мутації
Зміни кількості, розміру і організації хромосом називають
хромосомними мутаціями, хромосомними перебудовами або абераціями.
Всі хромосомні аберації поділяють
на внутрішньохромосомні, міжхромосомні та геномні. Під останніми розуміють зміни каріотипу, що полягають у збільшенні чи зменшенні кількості окремих хромосом або у кратній зміні кількості хромосомних наборів. Чітко розмежувати внутрішньохромосомні, міжхромосомні і геномні мутації не завжди вдається, бо деякі хромосомні перебудови можуть займати як одну, так і декілька хромосом, і нерідко це супроводжується змінами їх чисельності.
Слайд 39
Всі хромосомні мутації можна класифікувати таким чином:
1. Перебудови

хромосом, що впливають на кількість інформації в геномі:
а) делецІЇ
або нестачі. Втрачається певна ділянка хромосоми;
б) дуплікації. Одна із ділянок хромосоми представлена у вигляді двох або значно більшої кількості копій.
2. Перебудови хромосом, що змінюють локалізацію генів:
а) інверсії. В одній із ділянок хромосоми гени розташовані в зворотній послідовності;
б) транслокації .— обмін генетичним матеріалом між негомо-логічними хромосомами;
в) транспозиції .— зміни положення ділянок хромосом без реци-прокних обмінів
3. Зміни кількості хромосом (геномні мутації):
а) центричне злиття Дві негомологічні хромосоми зливаються в одну;
б) центричний поділ Одна хромосома поділяється на дві, при цьому обов'язково виникає одна нова центромера;
в) анеуплоїдія В хромосомному наборі відсутня одна чи декілька хромосом, або ж, навпаки, появляється одна або декілька додаткових;
г) поліплоїдія —збільшення в клітині кількості хромосом, кратне гаплоїдному наборові;
д) гаплоїдія (моноплоїдія) може вважатися геномною мутацією лише для організмів більш високої плоїдності.
Серед організмів, що в нормі моноплоїдні або поліплоідні, мутантними слід вважати лише такі, у яких зміна плоїдності здійснюється випадково в зв'язку з тими чи іншими обставинами і призводить до стійкого відхилення від нормальної (ортоплоїдної) чисельності хромосомних наборів.
Слайд 40
Делеції
Делеції — це перебудови, які спричиняють втрату ділянки

хромосоми з утворенням центричного {що містить центромеру) і ацентричного
(безцентромерного) фрагментів. Делеції бувають :
кінцеві (дефішенсі або нестачі), коли втрачається теломер-а частина хромосоми разом із ділянкою, що прилягає до неї;
інтерстиційні, які утворюються шляхом випетлювання та втрати внутрішньої' ділянки хромосоми.
Втрати незначної кількості нуклеотидів називають мікроделеціями. Цитологічно вони не завжди можуть бути виявлені.
За вилучення фрагмента хромосоми без центромери він, як правило, губиться і не передається нащадкам Фрагмент, що містить центромеру, реплікується, і його копії нормально розподіляються серед дочірніх клітин.
Розриви іноді здійснюються одночасно в обох плечах хромосоми, внаслідок чого елімінуються обидва теломерні фрагменти. Відкриті кінці хромосоми можуть з’єднатися, утворюючи в мейозі кільцеву хромосому.
Якщо внутрішня делеція незначна і не супроводжується летальним ефектом, то вона передається нащадкам, як правило, в гетерозиготному стані. У таких гетерозигот проявляються рецесивні алелі, локалізовані в гомологічній хромосомі напроти існуючої делеції. Це явище відоме під назвою псевдодомІнантності.
Слайд 42
Класичним прикладом делецій слугує домінантна мутація Notch у
дрозофіли, яка в гетерозиготному стані спричиняє неглибокі вирізки на
крилах мух. Мутація успадковується зчепно зі статтю, бо локалізована на лівому кінці Х-хромосоми. Для самців, у яких ця мутація знаходиться в гемізиготному стані, вона є летальною. Генетичний аналіз показав, що мутації Notch властиве явище псевдо-домінантності. За схрещування червоноокої (w+) самки Notch з білооким (w) самцем у половини дочок Notch виявляється ознака білоокості, хоч ген цієї ознаки є рецесивним. За цих умов експресується також група інших рецесивних генів, що локалізована в гомологічній Х-хромосомі напроти делеції Notch. Отже, зазначена мутація полягає у втраті цілої групи нормальних алелів в одній із Х-хромосом, що й призводить до псевдодомінування рецесивних генів гомологічної хромосоми.
Слайд 43
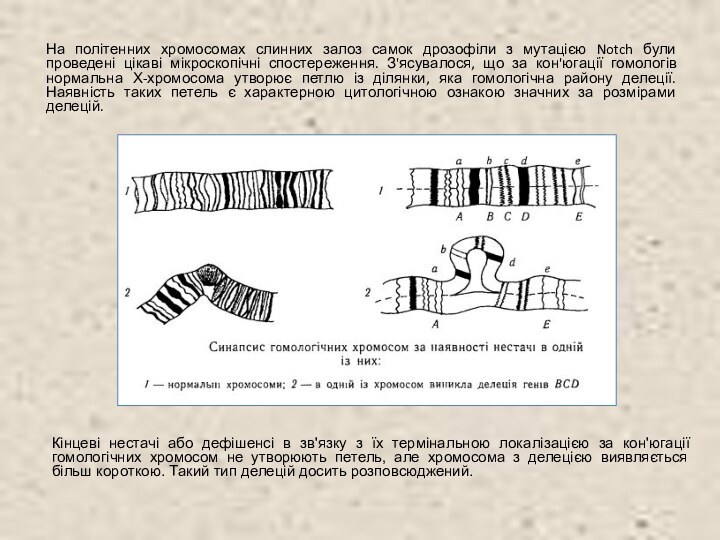
На політенних хромосомах слинних залоз самок дрозофіли з
мутацією Notch були проведені цікаві мікроскопічні спостереження. З'ясувалося, що
за кон'югації гомологів нормальна Х-хромосома утворює петлю із ділянки, яка гомологічна району делеції. Наявність таких петель є характерною цитологічною ознакою значних за розмірами делецій.
Кінцеві нестачі або дефішенсі в зв'язку з їх термінальною локалізацією за кон'югації гомологічних хромосом не утворюють петель, але хромосома з делецією виявляється більш короткою. Такий тип делецій досить розповсюджений.
Слайд 44
Дуплікації
Прямою протилежністю нестачам слугують дуплікації окремих ділянок хромосом.
Слово «дуплікація» буквально означає подвоєння, однак відомі випадки багаторазових
повторів певної послідовності в одній хромосомі або в різних хромосомах. Це явище іноді називають мультиплікаціями або ампліфікаціями. Дупліковані ділянки часто утворюють тандем, тобто розташовуються одна за одною. Бувають обернені (або інвертовані) дуплікації, в цьому випадку послідовності нуклеотидів у сусідніх ділянках хромосоми прямо протилежні. Якщо дуплікація розташована на кінці хромосоми, то її називають кінцевою або термінальним повтором.
Слайд 45
Класичним прикладом дуплікацій з фенотиповим виявом можна вважати

мутацію Ваг (В) в хромосомі D. melanogaster. Ця мутація
виявляє неповне домінування, зменшуючи кількість фасеток ока. У самок, гетерозиготних по Ваг, очі маленькі і щілевидної форми, у гомозигот і гемізигот по цій мутації очі ще менших розмірів. Мутація Ваг виникає внаслідок дуплікації невеликого сегмента (57,0 сМ від кінця) Х-хромосоми. Якщо цей сегмент (16 А) потроєно, то відповідне порушення називають Double Bar (подвійний Ваг) або ультрабар.
На цитологічних препаратах гетерозиготність по дуплікаціях виявляється завдяки виникненню петель, аналогічних таким за делецій. Зайві ділянки хромосоми, що утворюються внаслідок дуплікацій і не знаходять собі комплементарних ділянок у гомологічній хромосомі, за кон'югації випетлюються, що добре видно під час мейозу або в політенних хромосомах.
Дуплікації та інші повтори звичайно виявляють менш виразний негативний вплив на життєздатність особин у порівнянні з делеціями. Тому ідентичні або дуже подібні послідовності нуклеотидів можна знайти в хромосомах особин різних видів.
Слайд 46
Ділянки з високою і помірною повторністю нуклеотидів існують

у генотипах багатьох представників тваринного і рослинного світу.
Як відомо,
у еукаріотів деякі структурні гени представлені в генотипі двома або й більшим числом однакових копій. Інші структурні гени виникли шляхом дуплікацій від спільного предкового гена, але в процесі еволюції накопичили деякі структурні відмінності і сьогодні кодують споріднені білки з різними функціями. Такі гени відносять до одного сімейства генів; прикладом можуть бути гени сімейства імуноглобулінів і глобінів. Отже, дуплікації грають істотну роль в еволюції геномів, бо вони причетні до створення додаткових ділянок генетичного апарату, функція яких може бути змінена мутаційним процесом і природним добором. Іншими словами, дуплікації та ампліфікації генетичного матеріалу — це один із шляхів еволюції генів. Шляхи еволюції деяких структурних генів у загальних рисах простежені.
Зважаючи на дуже важливу роль дуплікацій у молекулярній еволюції, дуже актуальним є питання про можливі механізми дуплікацій та ампліфікацій генетичного матеріалу.
Чимало дуплікацій, як і делецій, виникає після локальних розривів хромосом. Причиною розривів можуть бути іонізуючі опромінення, дія деяких хімічних сполук та вірусів. Чимале значення при цьому мають деякі особливості будови і функціонування хромосом.
Слайд 48
Гемоглобін Лепоре є наслідком нерівного кросинговеру між поруч

розташованими в хромосомі 11 генами для δ- і р-ланцюгів.
Продукт новоутвореного гена — глобін з N-термінальною частиною δ - і С-термінальною частиною Р-глобіну. Реципрокним продуктом такої помилкової рекомбінації вважають знайдений у деяких хворих гемоглобін анти-Лепоре. Ще одним способом збільшення кількості генних повторів у хромосомах вважають вибіркову локальну реплікацію певних ділянок ДНК, що являються окремими репліконами.
Деякі повтори генів можуть виникати за межами ДНК хромосом. Суть явища полягає у тому, що частина генів вилучається із хромосоми в ядерний сік, замикається в кільце, і продовжує автономно реплікуватися по типу кільця, що котиться. Саме такий спосіб ампліфікації вперше був виявлений для генів рРНК ооцитів жаб, у яких кількість рибосом в яйцеклітині дуже велика — біля 1012. У подальшому така позахромосомна ампліфікація рДНК була виявлена не тільки у земноводних, але й у двостулкових молюсків, комах, в регенеруючих тканинах тварин, в клітинах ростучої ацетабулярії тощо.
Слайд 49
Перебудови хромосом, що змінюють локалізацію генів
Зміни фенотипу, що

виникають у відповідь на зміну генного оточення кодуючого гена,
називають ефектом положення. Останній Істотно впливає на вияви взаємодії генів, наприклад, на явище домінування.
Ефект положення може бути стабільним і нестабільним або мозаїчним. Якщо, наприклад, у дрозофіли нормальний алель w+ із Х-хромосоми перенести в гетерохроматинну ділянку іншої хромосоми, то у гетерозигот w+/w алель w+ проявляється не в усіх фасетках І очі стають мозаїчними.
До стабільного ефекту положення підносять такий ефект, за якого нормальний алель у зміненому генному оточенні стабільно зберігає свій зовнішній вияв. Прикладом може бути зміна домінування гена сі (cubitus interruptus), який знаходиться в 4-й хромосомі дрозофіли. Рецесивний алель цього гена в гомозиготному стані викликає переривчастість кубітальної жилки крила. Якщо ж у 4-й хромосомі безпосередньо біля нормального домінантного алеля сі+ здійснюється розрив і обмін фрагментами з іншою хромосомою (транслокація), то цей домінантний алель не спрацьовує, і асі гетерозиготи сі+/сі мають рецесивний фенотип (перервану кубітальну жилку). Підвищену мутабільність деяких генів можна пояснити особливостями їх локалізації у хромосомі. Доведено, що чимало мутантних фенотипіа, у тому числі І людини, є наслідком незначних хромосомних порушень (мікроінверсій. мікроделецій. мікродуплікацій), які відбуваються поруч з відповідним нормальним геном. Ще більш виразним ефект положення може бути за більш серйозних хромосомних перебудов — інверсій, транслокацій і транспозицій.
Слайд 51
Інверсії
Інверсії—це перебудови хромосом, в основі яких лежить утворення

петлі з наступним її поворотом на 180° і з
відповідною зміною порядку розташування генів. При цьому ні кількість хромосом, ні кількість генів у кожній хромосомі не змінюються. Якщо послідовність генів у вихідній хромосомі позначити як ABCDEF, то після інверсії сегмента BCD у тій же хромосомі гени будуть розташовані в порядку ADCBEF. Коли в Інвертовану послідовність входить центромера, то таку інверсію називають перицентричною, якщо ж центромера не входить в інвертовану ділянку, то це — парацентрична інверсія. Для позначення інверсій у дрозофіли прийнята певна номенклатура, наприклад: Іп(І)ВЕ, що означає: In-інверсія. (1) — в першій хромосомі, BE — інвертована ділянка.
У випадку парацентричної інверсії за одиночного кросинговеру в мейозі утворюється чотири хроматиди, із яких одна буде з двома центромерами (дицентрик), одна — зовсім без центромери (фрагмент), а дві будуть батьківськими — це ті, яких кросинговер не зачепив.
Хроматидний дицентрик або випадає з анафази мейозу, або одночасно розтягується до протилежних полюсів (клітинних цент рів), утворюючи характерну цитологічну структуру — «міст», якиі врешті решт розривається. Шматки розірваного дицентрика попадають у дочірні ядра і разом з усім* Іншими хромосомами репродукуються З'ясувалося, що увесь цей час місш розривів дицентрика зберігають злат ність до воз'єднання з іншими фрагмен тами. Тому в дочірніх клітинах післї подвоєння хромосом ці неповноцінн сестринські хроматиди можуть об'єд нуватнсь і утворювати новий дицент рик. а в подальшому — «міст».
Інший реципрокний продукт рекомбінації — безцентромерний фрагмент — у процесі мейозу втрачається
В результаті із чотирьох хроматид повноцінними будуть лише дві — ті. що не вступали в рекомбінацію.
Слайд 53
До іншого результату одиночний кросинговер приводить у випадку

гетерозигот по перицентричній інверсії. У цьому випадку із чотирьох
хромосом, що виникають внаслідок мейотичних поділів, дві також можуть залишитися поза кросинговером, а дві Інші містити делеціі одних генів і дуплікації Інших. В протилежність парацентричним інверсіям перицентричні ніколи не дають ди-центромерних та ацентромерних хромосом, а, отже, мостів і фрагментів. Зате перицентричні інверсії спричиняють утворення хрома-тид з дуплікаціями і нестачами. Отже, особини, гетерозиготні з парацентричних чи з перицентричних інверсій, повноцінних реком-бінантних хромосом не утворюють. Виняток з цього складають випадки з подвійними кросоверами, бо якщо в середині інвертованої ділянки трапляється подвійний обмін, то в дочірніх хромосомах зберігається повний набір генів без делецій І дуплікацій. Життєздатність гамет і виникаючих Із них зигот може зберігатись І тоді, коли втрачені або дупліковані під час кросинговеру ділянки хромосом дуже малі і не грають життєво важливої ролі.
Слайд 57
Транслокації
Крім розглянутих внутрішньохромосомних перебудов, існують І такі, що

одночасно охоплюють дві або й більшу кількість не-гомологічних хромосом.
До таких перебудов відносяться трансло-кації— переважно реципрокні обміни між не гомологічними хромосомами. В результаті такого обміну у гомозигот по трансло-каціях у порівнянні з вихідними хромосомами змінюється структура хромосоми; гени, що були у вихідних хромосомах зчепленими, виявляються незчепленими І навпаки.
Залежно від того, які за будовою хромосоми вступають у рецн-прокні обміни і якими ділянками вони обмінюються, розрізняють дві найбільш типові різновидності транслокацій:
1. Симетричні, за яких центромерна ділянка однієї хромосоми з'єднується з ацентромерною ділянкою іншої. В цьому випадку кожна транслокована хромосома утримує одну ценгромеру і новий варіант зчеплених генів.
2. Асиметричні, коли з'єднуються центромерні або ацентромерні ділянки негомологічних хромосом, внаслідок чого утворюються дицентрики, трицентрики тошо, а також ацентромерні фрагменти, які згодом елімінуються.
Слайд 58
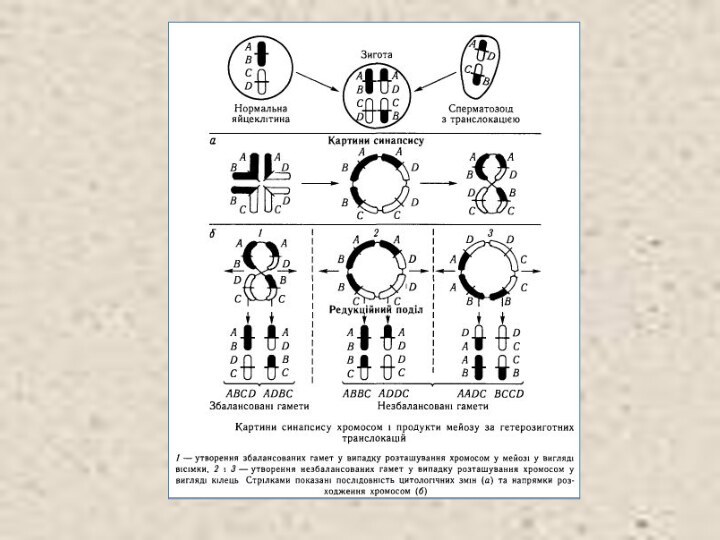
На цитологічних препаратах у гетерозигот по транслокаціях у
профазі І мейозу можна спостерігати характерну структуру — хрест.
її поява пов'язана з тим, що гомологічні ділянки трансло-кованих хромосом взаємно притягуються в зиготені. Замість бівалентів, тобто пари кон'югуючих хромосом, виникають квадриваленти. що складаються з чотирьох частково гомологічних хромосом — двох незмінених і двох транслокованих. В діакінезі хіазми «сповзають» від центромер до кінців хромосом і хрест перетворюється в кільце. Іноді кільце перекручується І виникає фігура типу вісімки. Саме такий тип розташування хромосом сприяє утворенню життєздатних збалансованих гамет, бо в цьому випадку до одного полюса відходять або обидві змінені хромосоми, або обидві незмінені.
Слайд 60
Слід зазначити, що гетерозиготи по транслокаціях серед тварин
зустрічаються не часто, проте вони дуже розповсюджені у рослинному
світі, для багатьох представників якого вони є нормою.
У кукурудзи орієнтація хромосом у вигляді вісімок трапляється з частотою біля 50%, що забезпечує утворення 50% фертильних гамет. Ще більш висока фертильність гетерозигот по транслокаціях у дурману, пшениці, ячменю, томатів.
Слайд 61
Транспозиції. Загальна характеристика
Транспозицією називається нереципрокне переміщення генетичного матеріалу
в межах однієї хромосоми або між хромосомами. Транспозиції можуть
бути спрямованими, за яких переміщення генетичного матеріалу здійснюється лише в певні місця геному, і неспрямованими. коли такі переміщення можливі в будь-які за будовою ділянки хромосом. Неспрямовані транспозиції відбуваються з участю особливих мобільних (транспозибельних) або мігруючих генетичних елементів (МГЕ), здатних змінювати свою локалізацію в геномі. Однак бувають і такі транспозиції, які не пов'язані з функцією МГЕ. Роль мобільних елементів можуть виконувати деякі віруси — у цьому випадку можливе переміщення послідовностей ДНК не тільки в межах генетичного матеріалу однієї клітини, але й між клітинами.
Слайд 63
Транспозиції відбуваються як у прокаріотів, так і у

еукаріотів. У бактерій можливі транспозиції з будь-якому напрямку: в
межах хромосоми бактерії, із хромосоми в плазміду. Із плазміди в геном фага, із останнього в хромосому бактерії, Із плазміди в плазміду тощо. Саме так переносяться гени стійкості до різних антибіотиків і токсикантів. У еукаріотів можливі транспозиції від одних хромосом до інших; є докази того, що в геном еукаріотів можуть вбудовуватися ДНК-копії РНК деяких вірусів, а також інші продукти зворотної транскрипції. Розміри нуклеотидних послідовностей МГЕ коливаються в досить широких межах, але загалом вони не дуже великі і утримують від одного до декількох генів.
Транспозиція МГЕ не вимагає гомології в послідовностях до-норних і реципієнтних ДНК. тому переміщення МГЕ називають ще незаконною рекомбінацією. Остання практично не залежить від генів RecABC, але потребує участі особливого ферменту — транспозази.
Частота транспозицій окремих МГЕ дуже різна І коливається в межах частот спонтанних мутацій (від 10-4 до 10-7 на покоління). Такі переміщення нерідко супроводжуються вставками (інсерціями) МГЕ в середину гена, що виключає його транскрипцію або трансляцію відповідного продукту. Крім того, такі інсерції можуть виявляти полярний ефект, тобто впливати на функцію розташованих за вставкою генів. Це може бути наслідком функціонування привнесених інсерцією нових промоторів, енхансерів. термінаторів та інших регуляторних елементів геному, появою нонсенс-триплетів і т. Ін. Порушення структури і функцій генів, визвані інсерціями МГЕ. являють собою мутації, реверсія яких до дикого типу здійснюється лише одним способом —делецією вбудованого матеріалу. Цим транспозиції Істотно відрізняються від точкових мутацій гена. Переміщення МГЕ може супроводжуватися численними перебудовами хромосом — інверсіями, розривами, делеціями сегментів, транслокаціями. актами рекомбінацій у сайтах розташування гомологічних МГЕ тощо. Саме такі численні порушення відбуваються під час «мутаційного вибуху», що характеризує гібридний дисгенез у дрозофіли.
Слайд 64
Існує багато типів транспозібельних елементів як у прокаріотів,

так і у еукаріотів. однак певні риси будови і
поведінки для них є спільними. Серед них:
1. Більшість МГЕ являє собою автономні генетичні одиниці, які кодують білки, необхідні для транспозиції (фермент транспозазу та ін.). Деякі з МГЕ (наприклад, складні транспозони бактерій) можуть містити також гени резистентності до антибіотиків та інші гени.
2. На кінцях кожного МГЕ локалізовані короткі (у прокаріотів) або більш значні (у еукаріотів) інвертовані або прямі нуклеотидні повтори, що мають повну або часткову гомологію. Завдяки останній, деякі МГЕ, принаймні у еукаріотів, здатні переміщуватись за допомогою рекомбінаційних механізмів.
3. МГЕ можуть містити по декілька сигналів початку і кінця транскрипції і трансляції, що призводить до синтезу декількох транскриптів і поліпептидів. Функція останніх не завжди з'ясована
4. Кожний МГЕ зліва і справа обмежений (фланкований) невеликим прямим повтором від 4 до 9 п. н. Ця дуплікація не є частиною транспозибельного елемента, а являє собою повтор сайта-мі-шені, в який вбудовується цей елемент.
5. Більшість МГЕ мають декілька або безліч сайтів-мішеней в геномі. Деякі віддають перевагу так званим «гарячим» точкам. Хоч сайти Інсерцій можуть вибиратися випадково, все ж є ділянки геному, в які МГЕ вбудовуються частіше. Ця регіональна специфічність ще не знайшла переконливого пояснення Важливо, що на молекулярному рівні вибір мішені, як правило, не залежить від нуклеотид-ної послідовності.
Наявність рухливих генетичних елементів є загальною властивістю всіх організмів. Виникає питання, чи можуть вони виконувати корисні для організмів функції. Одна із гіпотез полягає в тому, що принаймні деякі МГЕ представляють «егоїстичну» ДНК, яка забезпечує лише своє власне розмноження без будь-якої корисної функції для свого носія. Однак є чимало даних, що рухливі генетичні елементи сприяють залученню в геном нових генів.
Слайд 65
Розміри Is-елементів можуть варіювати від 200 до 5700

п.н. Усі IS-елементи характеризуються наступними структурними особливостями:
1. На кінцях
IS-елементи несуть недосконалі, тобто неідентичні інвертовані повтори нуклеотидної послідовності розміром від декількох пар до декількох десятків пар нуклеотидів.
2. Більшість Is-елементів містить ген для ферменту транспозази, відповідальної за їхнє переміщення.
3. IS-елементи можуть містити по декілька сигналів початку й кінця трансляції, а також комбінація нуклеотидів, подібні із сигналами терминації транскрипції.
4. У крапці впровадження кожного Is-елемента, на його флангах завжди виявляється дуплікація (у прямої орієнтації) розміром від 4 до 9 п.н. Ця дуплікація не є частиною Is-елемента, а являє собою результат повторень сайту-мішені, у який впроваджується елемент.
Звичайно хромосома Е. coli має декілька Is-елементів, наприклад 8 копій IS 1, 5 копій IS 2 і т.д. Вони переміщаються по хромосомі із частотою близько 1*10–6— 1*10–8 на клітинний поділ. Is-елементи локалізовані також в F-Факторові Е. coli: два IS3, один IS2 і ще один елемент, позначуваний γδ. Саме по цих мігруючих елементах і відбувається рекомбінація, коли F-фактор інтегрує із хромосомою Е. coli, утворюючи Hfr-штами. На це вказують результати вивчення ДНК F'-Факторів, у яких ділянка ДНК бактеріальної хромосоми, включений в F-фактор, виявляється відділеним від ДНК F-фактора по обом кінцям однієї і тієї же послідовністю Is-елемента. Is-елементи F-фактора та такі ж послідовності, розкидані по бактеріальній хромосомі, створюють умови для утвору Hfr-донорів з різними початками й напрямками переносу бактеріальної хромосоми.
Міграція Is-елементів, мабуть, пов'язана з рекомбінацією, однак її механізм відмінний від класичної гомологичної рекомбінації. На це вказує можливість транспозицій навіть у клітинах бактерій, що несуть мутацію rec A, що блокує загальну гомологичну рекомбінацію в Е. coli.
Слайд 66
Будова Ac та Bc елементів кукурудзи. Показані два
гена (світлі), які відповідають та трансопзицію, та послідовності інвертованих
недосконалих повторів на кінціях.
Слайд 67
Надалі в бактерій були виявлені більш складні мігруючі

елементи — транспозони, які відрізняються від Is-елементів тим, що
в них включені деякі гени, що не мають відносин до самого процесу транспозиції. Відомі транспозони, що включають гени стійкості до антибіотиків, іонів важких металів та іншим інгібіторам. Транспозони звичайно фланковані довгими прямими або інвертованими повторами, у ролі яких часто виступають Is-елементи. Подібно влаштовані транспозони еукариотів, наприклад Ту I-Елемент Sacck. cerevisiae розміром 5700 п. н., що викликає дуплікації 5 п.н. у точках інтеграції із ДНК хромосом. Подібну будову мають і множинні диспергійовані гени D. melanogaster (МДГ), і ДНК-копії ретровірусів.
Вивчення нуклеотидної послідовності дуплікуємих сайтів-мішеней на кінцях мігруючих елементів показало, що вони, як правило, неоднакові як в елементів, що різняться, так і в того самого елемента, локалізованого в різних місцях. Отже елементи, що мігрують, впроваджуються в ті або інші точки генома незалежно від їхньої структури. Правда, перевага в багатьох випадках віддається АТ-багатим районам.
Деякі мігруючі елементи, залишаючи точку своєї локалізації, перетерплюють внутрішньохромосомну гомологичну рекомбінацію по фланкуючих їхніх довгих кінцевих повторах. У результаті цього транспозон залишає після себе одну копію свого кінцевого повтору, як це показане, наприклад, для дріжджового транспозона Ту I, що залишає після себе одну копію δ-повтору. Очевидно, подібно можуть поводитися і МДГ D. melanogaster. Цим пояснюється повторна поява деяких мігруючих елементів у залишених ними сайтах — за рахунок гомологичної рекомбінації з кінцевим елементом, що залишився.
Слайд 68
Щодо механізмів переміщення різних типів МГЕ по хромосомах,

то можливі такі варіанти:
Ексцизія попереднього транспозона з переносом на
нове місце — нереплікативна транспозиція.
Реплікація ДНК транспозона з наступною транспозицією — реплікативна транспозиція.
Зворотна транскрипція РНК-копії транспозона й переміщення ДНК-копії на нове місце — РНК-опосередкована транспозиція.
Як уже згадувалося раніше, звичайно переміщення мігруючих елементів не спрямовані й досить рідкі. Вони відбуваються із частотою близько 1*10–5— 1*10–8, про що можна судити по частоті ревертування мутантів, що виникли в результаті впровадження цих елементів у безпосередній близькості від генів або усередину конкретних генів. У той же час можна створити такі експериментальні ситуації, при яких частота транспозицій різко зростає, а переміщення транспозонів перестають бути випадковими. Так, у роботі В. А. Гвоздьова й Л. З. Кайданова було показано, що в лініях дрозофіли, тривалий час (більш 500 поколінь) селектированих на зниження полової активності самців і загальної життєздатності, відбирається невипадковий малюнок розташування МДГ у хромосомах. Про це можна судити по гібридизації клонованих і радіоактивних копій МДГ із ДНК гігантських хромосом D. теlanogaster in situ, тобто безпосередньо на цитологічних препаратах слинних залоз личинок дрозофіли. Як тільки селекція в негативну сторону припинялася, відбувалося швидке (протягом декількох поколінь) переміщення копій МДГ, що різко змінювало картину їх розташування на хромосомах. Це вказує на те, що міграція транспозонів чуйно відбиває напрямок селекції й пов'язана з адаптивною цінністю організму.
У цьому зв'язку можна нагадати приклад, що вже приводився, появи бактеріальних епісом — факторів стійкості, «що зібрали» по декілька генів, що забезпечували виживання бактерій у період масової терапії антибіотиками
Ексцизія (вырезание) транспозона дріжждів Ту 1 за рахунок рекомбінації між термінальними повторами лементами дельта.
Слайд 69
Ретротранспозони та ретропозони
Один із способів переміщення елементів з

довгими кінцевими повторами — не зворотна транскрипція на матрицях
їх процесованих транскриптів, тобто зрілих РНК- Внаслідок цього процесу відтворюються ДНК-копії зазначених мігруючих елементів, які потім вбудовуються в геномну ДНК і стають їх складовою (інтегральною) частиною. Як відомо, вперше подібний механізм інтеграції був описаний для ретровірусів. в геномі яких є ген, що кодує зворотну транскриптазу (ревертазу). Вбудована в геном клітини-хазяїна ДІІК-копія ретровірусу отримала назву проретровірусу. Вважають, що її інтеграція з хромосомою інфікованої клітини відбувається шляхом транспозиції.
Оскільки мігруючі елементи еукаріотів, що мають довгі кінцеві повтори, теж здатні використовувати зворотну транскрипцію як проміжний етап транспозиції, то їх часто називають ретротранспозонами. Останні транскрибуються за допомогою РНК-полІмерази II. Сигнали ініціації (промотори), поліаденілювання і термінації транскрипції розташовані в довгих кінцевих повторах — в лівому або правому. Елементи, що кодують білки «ретропозиції», тобто ревертазу та Інші, здатні забезпечувати переміщення Інших подібних елементів цього сімейства, які втратили власну Інформацію про білки «ретротранспозиції».
Ретропозони — це продукти зворотної транскрипції клітинних РНК еукаріотів.
Слайд 70
Рекомбінаційний механізм хромосомних перебудов
Було замічено також, що точки

розривів при транслокаціях у дрозофили переважно локалізуються в районах
ектопічного спарювання, тобто в районах негомологичних хромосом, час від часу сінаптуючих на препаратах слинних залоз. Це вказувало на існування в негомологичных хромосомах ділянок часткової гомології й дозволяло шукати рекомбінаційний механізм хромосомних перебудов. Безсумнівний успіх у цьому напрямку був досягнутий тільки з відкриттям мигруючих елементів геному й у зв'язку із застосуванням техніки рекомбинантної ДНК для їхнього виділення й вивчення.
З найбільш інтригуючих моментів, пов'язаних з вивченням мігруючих елементів, є виявлення частих хромосомних перебудов поблизу точок включення IS-елементів і транспозонів. Це справедливо як для бактерій так і для одноклітинних і багатоклітинних еукариот. У теперішній час із урахуванням переміщення мігруючих елементів і механізма звичайної — гомологичної рекомбінації, а також рекомбінації між IS-елементами вдається пояснити її типи відомих хромосомних перебудов.
Делеції й дуплікації можуть відбуватися, якщо два мігруючі елементи в одній і тій же хромосомі однаково орієнтовані. Тоді рекомбінація по гомології між цими елементами після реплікації між сестриними хроматидами або гомологичными хромосомами приведе до дуплікації (трипликации) і делеції в якості реципрокних продуктів рекомбінації . Інверсії виникають у випадку протилежної орієнтації двох гомологичных елементів в одній хромосомі.
Транслокації можуть бути результатом рекомбінації двох копій того самого елемента, інтегрованих у різні хромосоми й розташованих однаково в напрямку від центромери або до центромери.
Мости й фрагменти, які часто спостерігаються в анафазі при індукції хромосомних аберацій іонізуючими випромінюваннями — результат рекомбінації, — копій того самого мігруючого елемента в негомологичних хромосомах і по-різному орієнтованих до центромери; в одній хромосомі від центромери, в іншій — до центромери.
Слайд 71
Мігруючі елементи здатні захоплювати й переносити на нове

місце гени, поруч із якими вони розташовуються. По образному
вислові Р. Б. Хесина, «потрапивши в погану компанію, гени з «добропорядних» перетворюються в «бродяг». Тим самим здійснюється дуплікація окремих генів, необхідна для дивергенції генетичного матеріалу, тобто виникнення генів з новими функціями. Крім того, повтори однакових або подібних ділянок генетичного матеріалу самі по собі створюють умови для рекомбінації по гомології між генами, що розташовуються в негомологичних ділянках генетичного матеріалу.
Розглянуті тут способи виникнення повторів у геномі при участі мігруючих елементів варто назвати первинними дуплікаціями, тобто дуплікаціями, що виникають de novo. Очевидно, існує більша група так званих вторинних дуплікацій, прикладами яких можуть бути повтори, що виникають внаслідок кроссинговеру в гетерозиготних інверсіях і транслокаціях, а також внаслідок нерозходження хромосом і полиплоидии.
Події, що змінюють структуру хромосом у геномі, завжди традиційно зв'язували з еволюційними перетвореннями генетичного матеріалу. Дуплікації поставляють матеріал для творення нових генів у процесі природного добору. Інверсії й транслокації сприяють генетичній ізоляції нових форм у процесі їхньої внутрішньовидової дивергенції. У той же час механізм виникнення хромосомних перебудов довгий час не був відомий і аберації хромосом уважалися нерегулярними подіями, про що говорить сам термін «аберація», тобто відхилення від норми. Розкриття механізму рекомбінації як основного джерела перебудов хромосом змушує по-новому побачити проблему співвідношення стабільності й лабільності генетичного матеріалу.
Хромосомні перебудови, традиційно розглянуті як один з типів мутацій, виявилися пов'язаними із процесами рекомбінації. Це пояснює, чому їхнє обговорення виділене в окрему главу. Бути може, у майбутньому перебудови хромосом зовсім варто виключити з категорії мутацій?
Подальше вивчення механізму перебудов хромосом дозволить перетворити цей розділ генетики в область спрямованої перебудови геномів, що по праву одержить найменування хромосомної інженерії.
Слайд 72
Механізм виникнення хромосомних перебудов, опосредкованих мігруючими елементами. А
— делеції і дуплікації: Б —делеції без дуплікацій; В
— інверсії; Г - транслокації; Д — утваорення мостів і фрагментів в анафазі I: 1 – похідна копія мигруючого елемента, 2 — копія мигруючого елемента, який перемістився на нове місце
Слайд 73
Перебудови, що змінюють кількість хромосом
Нерозходження хромосом трапляється як

у соматичних, так і в статевих клітинах. Не розходження
всіх хромосом у мітозі спричиняє поліплоїдію відповідного клону клітин, Інші клони за кількістю хромосом можуть бути нормальними. Якщо ж повне нерозходження хромосом трапиться у мейозі, то це може призвести до утворення гамет з нередукованою кількістю хромрсом. Такі мети містять подвоєну кількість хромосомних наборів, І участь їх у заплідненні може спричинити появу організмів з трьома або чотирма наборами хромосом. Виникнення поліплоїдних зигот внаслідок злиття нередукованих гамет або нередукованих гамет з нормальними М. Ю. Лобашов назвав мейотичною поліплоїдією.
Злиття та поділи хромосом
Центричне злиття хромосом супроводжується втратою однієї центромери і з'єднанням двох негомологічних акроцентричних хромосом в одну мета- або субметацентричну. Протилежне явище — центричний поділ, за якого одна хромосома поділяється на дві, кожна з яких має свою центромеру.
Центричне злиття ще називають робертсонівськнми перебудовами за Ім'ям Вільнма Робертсона. який злиттям хромосом спробував пояснити зменшення їх числа в хромосомних наборах деяких видів.
Слайд 74
Анеуплоїдія
Анеуплоїдія або гетероплоїдія — це зміна числа хромосом,

але не кратна гаплоїдному наборові. Кількість хромосом певної пари
або декількох пар може бути зменшена або, навпаки, збільшена в порівнянні з їх нормальною кількістю. У диплоїдних організмів загальна кількість хромосом у наборі — 2n. Якщо обидві хромосоми якоїсь пари втрачаються, то загальна кількість хромосом у такого організму (нулІсомнка) складе 2n — 2. У моносомиків відсутня одна Із хромосом пари, і загальна їх кількість — 2n — 1. У полІсо.чикІв одна із хромосом представлена трьома (трисомики). Чотирма (тетрасомики) або й більшою кількістю екземплярів. Загальна кількість хромосом у трисомиків — 2л + 1, у тетрасомиків — 2n+ 2 і т. ін.
Анеуплоїдія може виникати внаслідок неправильного розходження хромосом у мейозі. Вперше анеуплоїдія була виявлена К. Бріджесом у 1916 р.. коли він відкрив нерозходження хромосом у дрозофіли. У деяких (виключних) самок було виявлено дві хромосоми X і ще одна Y. а у деяких самців була відсутня Y-хромосома.
Моносомики. а тим більше нулісомики, часто нежиттєздатні, але серед поліплоїдних рослин вони зустрічаються. Наприклад, рослини звичайного тютюну Nicotiana tabacum — це тетраплоїди з 24 парами хромосом; існують фенотипово відмінні всі 24 варіанти моносомиків.
Слайд 75
Поліплоїдія
ПолІплоїди поділяють на автополіплоїди, у яких декілька разів

повторюється один І той же набір хромосом, і алополіплоїди,
які виникають внаслідок міжвидових схрещувань і тому містять повтори двох (або більшої кількості) різних геномів. Залежно від алель-ного складу досліджуваного локусу автополіплоїди поділяють на гомозиготні та гетерозиготні. Так. наприклад, автотетраплоїди АААА або аааа є гомозиготними, а наявність у генотипах водночас домінантних {А) і рецесивних (а) алелей властиве гетерозиготним формам. Залежно від кількості домінантних алелів у тетраплоїда їх називають; АААА — квадриплекс, АААа — триплекс, ААаа — дуплекс, Аааа — симплекс, аааа — нуліплекс. ПолІплоїди з парним числом хромосомних наборів називаються збалансованими. У них під час мейозу гомологічні хромосоми кон'югують. утворюючи або з'єднані пари (біваленти) або поліваленти (якщо кон'югує відразу декілька хромосом). У незбалансованих поліплоїдів, тобто таких, що мають непарну кількість наборів, мейоз завжди дуже порушений, тому що за кон'югації непарної кількості гомологічних партнерів їх розподіл між дочірніми клітинами здійснюється випадково і нерівномірно. Поліплоїдія завжди знижує фертильність, тому що гамети можуть бути незбалансовані АААА може дати ААА гамету, або АА, А гамети. При заплідненні тільки в одному випадку дасть фертильний організм.
Слайд 76
Поліплоїдія рідко зустрічається у тварин, але досить розповсюджена

у рослинному світі. У тварин поліплоїди відомі головним чином
серед гермафродитів, наприклад, у земляних черв'яків, і у видів з апоміктичнич типом розмноження, за якого організми розвиваються із статевих клітин, але без акту запліднення (партоге-нез, андрогенез, гіногенез І т. ін.). Партеногенетичні самки (тобто самки, що дають життєздатних нащадків без запліднення) і поліплоідні форми відомі у деяких жуків, метеликів, клопів, риб, саламандр, раковидних. Біля 47% усіх квіткових рослин — це поліплоїди. Бувають поліплоїди серед людських ембіонів, але вони швидко елімінуються, а якщо народжуються то дуже швидко гинуть. Доля поліплоїдних видів зростає з півдня на північ, що можна пояснити більш значною в порівнянні з диплоїдами генетичною мінливістю і кращою адаптивністю поліплоїдів.
Внаслідок спонтанної поліплоїдизації соматичних клітин (соматичної поліплоїдизації) можуть виникати мозаїки або химери — організми, що утримують як нормальні диплоїдні клітини, так І клітини іншої плоїдності. Такі організми називають міксоплоїдами. Вегетативним розмноженням поліплоїдних частин рослини-мозаїка можна отримувати поліплоідні організми, чим часто користуються в селекції.
Слайд 80
Автополіплоїдія
АвтополІплоїдія, тобто надмірне повторення в клітині одного і
того ж геному, нерівномірно розповсюджена у природі і найчастіше
буває у покритонасінних рослин. Відомі поліплоїдні еукаріотні мікроорганізми — гриби І водорості; високий ступінь плоїдності властивий макронуклеусам більшості найпростіших. У тварин часто зустрічається ендополІплоїдія деяких тканин, наприклад печінки у ссавців, а також кишечника, слинних залоз, мальпігісвих судин у цілого ряду комах. Ступінь розповсюдження поліплоїдів серед різних груп організмів певною мірою можна пов'язати з тими обмеженнями, які створюються, особливо у тварин, хромосомним механізмом визначення статі, бо за поліплоїдії може істотно порушуватися баланс між генами аутосом І статевих хромосом.
У природних умовах автополіплоїди виникають серед рослин з будь-яким способом розмноження, але краще зберігаються у самозапильних рослин, а також за умов безстатевого (вегетативного) розмноження.
Слайд 81
Практичний інтерес до поліплоїдів. особливо збалансованих, пояснюється тим.

іцо вони нерідко відрізняються від своїх диплоїдних попередників більшою
могутністю: мають крупніші листя, квіти, насіння, більш могутні стебла і т. д. Клітини І їх ядра у поліплоїдів теж більші за розмірами, хоч їх менше на одиницю маси тканини. Це явище, відоме під назвою гігантизму, властиве не всім поліплоїдам. У самозапильних рослин, наприклад у томатів, гігантизму не буває. Гігантизм супроводжується зміною ряду фізіологічних і біохімічних властивостей клітин, що забезпечує більш високу стійкість поліплоїдів до несприятливих умов, захворювань тощо. Стійкість поліплоїдів до негативних впливів середовища пояснюється тим, що в їх клітинах кожен ген має декілька копій і тому ймовірність прояву рецесивних мутацій значно менша, ніж у диплоїдів. Крім того, поліплоїдам у переважній більшості властива гетерозиготність, яка забезпечує високу адаптивну здатність. Можливо, саме тому деякі реліктові рослини (представники древніх рослинних груп), як правило, поліплоїдні.
Автополіплоїдію можна штучно спровокувати і у деяких тварин, а саме у амфібій. Якщо щойно запліднені яйця тритона піддати впливу високої або низької температури, то іноді з них розвиваються триплоїдні організми, які, щоправда, досить рано гинуть. Полі-плоїдні форми шовкопряда Bombix morі отримав Б. Л. Астауров. Після дії високої температури на яйця шовкопряда останні отримують здатність до партеногенетичного розвитку. При цьому інколи виникають тетраплоїдні самки.
Слайд 82
Алополіплоїдія
Алополіплоїди виникають внаслідок схрещувань різних видів і об'єднують

різні геноми. Міжвидові гібриди, які мають суму наборів хромосом
батьківських форм. М. С. Навашнн назвав амфідиплоїдами. Отже, якщо міжвидовий гібрид поєднує геноми А І В в одиничних копіях (АВ), то це амфІгаплоїд (алодиплоїд), а гібрид з подвоєними геномами (ААВВ) — амфідиплоїд (алотетраплоїд). Не-збалансований набір геномів різних видів типу ABB або ААВ називають сесквіполІплоїдоч. Гібриди від схрещувань різних видів і родів називають віддаленими гібридами.
Кон'югація в мейозі гомеологічних хромосом (алосиндез) свідчить про тс, що геноми, поєднані у складі алополіплоїда, в далекому минулому могли мати спільного предка. Іноді кон'югація хромосом і утворення бівалентів трапляється навіть у межах гаплоїдного набору хромосом. Алосиндез може істотно впливати на хід мейозу, порушуючи нормальну кон'югацію гомологічних хромосом, тобто автосиндез. Це може бути серйозною причиною генетичної нестабільності деяких штучно отриманих алополіплоїдів, наприклад тритикале.
Слайд 83
Гібриди F1 від схрещування двох різних видів виявляються

безплідними (гібриди жита з пшеницею, редьки з капустою, кобили
з ослом тошо). Причиною цього явища є неможливість нормального мейозу із-за відсутності нормальних гомологів у амфігаплоїда. Так, наприклад, амфігаплоїд редьки (Raphanus sativus) і капусти (Brassica oleracea) містить лише по одному набору хромосом цих батьків. Однак у наборі хромосом капусти немає гомологів для хромосом редьки і навпаки, тому кожна із хромосом поводить себе в мейозі цілком незалежно — як унівалент. В анафазі редукційного поділу ці уніваленти (у гибриду їх всього 18) розходяться до полюсів неупорядковано, випадково, і утворюються гамети з різною кількістю хромосом — від 0 до 18. Отже, у такого гібриду нормального розвитку гамет не відбувається, і він є стерильним. Лише деяка частина гамет випадково отримає всі 18 хромосом гібриду (9 хромосом редьки і 9 хромосом капусти). Злиття таких нередуко-ваннх гамет забезпечує наявність у зиготи подвоєних наборів хромосом редьки (2R) і капусти (2S). Це створює умови для нормального мейозу, бо кожна хромосома може кон'югувати із своїм гомологом, а рівномірне розходження хромосом в анафазі мейозу забезпечує утворення фертильних гамет.
Як за внутрішньовидових, так і за міжвидових схрещувань можна вивести лінії з заміщеними хромосомами. Створення таких та доповнених по хромосомах ліній має велике значення для селекції і для наукових досліджень.
Слайд 85
Поліплоїдія і еволюція
Є чимало груп споріднених видів рослин,

які відрізняються один від одного кратним збільшенням так званого
основного числа хромосом, яке, можливо, складало геном спільного для всіх цих видів предка. Групу таких споріднених видів називають поліплоїд-ним рядом. Основне число хромосом х — це найменше гаплоїдне число в поліплоїдному ряду. Відомі роди рослин з одним або кількома поліплоїднимн рядами видів. Наприклад, рід роза (Rosa) складається із багатьох видів, що мають відповідно 14, 21, 28, 42 і 56 хромосом. Основним числом цього ряду є 7 хромосом. Рід вика (Vicea) має два поліплоїдних ряди. Основне число хромосом у різних поліплоїдних рядів неоднакове, що залежить від гаплоїдного числа хромосом у вихідного виду або його предка.
Щодо тварин, у яких поліплоїдія зустрічається рідко, то полі-плоїдні ряди видів відомі лише у аскарид, земляних черв'яків, амфібій і деяких Інших, які є або гермафродитами, або розмножуються партеногенетично. Найчастіше поліплоїдні ряди у тварин є двочленними (2n і 4n). Вони знайдені у деяких комах і амфібій. Отримано чимало автополіплоїдннх форм тутового шовкопряда, тритона І навіть деяких ссавців (миша, кролик). У автотетраплоїдів шовкопряда Bombix тогі самки плодючі, а самці стерильні.
В протилежність тваринам, багато рослин являють собою авто-поліплоіди або алополіплоі'ди. Згідно з теорією О. Вінге (1917), алополіплоїдні ряди у природі виникають шляхом гібридизації видів і наступного подвоєння обох батьківських хромосомних наборів. Влискуче підтвердження ця теорія знайшла в роботах шведського генетика А. Мюнтцінга та інших авторів. Схрещуючи дна види жабрію (у кожного 2п= 16), Мюнтцінг спершу отримай амфігаплоїд (&4 + 8S), а потім із нього — амфідиплоїд з 2л** 32. Останній виявився майже Ідентичним третьому виду цієї рослини, що реально існує в природі і має назву жабрій звичайний (Galeopsis tetrahit).
Сьогодні немає сумнівів у тому, що численні види рослин являють собою алополіплоїди. Немало серед них і культурних рослин, які виникли внаслідок міжвидової гібридизації з наступним подвоєнням хромосомного складу гібридів. Пшениця-однозернянка Triticum топососсит має геном (n = 7), який позначається буквою А. Геномна формула цієї диплоїдної пшениці — АА (2n=14). Схрещування цієї пшениці з диким злаком Aegilops speltoides (ВВ, 2/1=14) з наступним подвоєнням хромосом у гібриду привело до виникнення нового виду — твердої пшениці. її геномна формула — ААВВ (2n = 28), тобто вона є алотетраплоїдом. Гібридизація твердої пшениці з іншим диким злаком Aegilops squarrosa (геномна формула DD, 2n =14) призвела до утворення алогексаплоїдного виду — м'якої пшениці (геномна формула—AABBDD, 2n = 42). Цей шлях еволюції пшениць був підтверджений штучним ресинте-зом їх методом відповідних схрещувань.
Слайд 86
Модифікації
Серед різних типів мінливості виділена неспадкоємна мінливість, яку

називають також модифікаційної. Загальні закономірності мінливості відомі значно гірше,
чим закони спадкування. Особливо слабкі знання в області модифікаційної мінливості, або модифікацій.
Модифікації — ненаслідувані зміни
Зовнішні впливи можуть викликати в особини або групи особин зміни, які бувають для них шкідливими, байдужними або корисними, тобто пристосувальними.
Як відомо, еволюційна теорія, розроблена Ж. Б. Ламарком (1744-1829), ґрунтувалася на помилковому постулаті про спадкування змін, що здобуваються протягом життя, тобто про спадкування модифікації. Сама по собі вистава Ж. Б. Ламарка про еволюцію органічних форм було, безсумнівно, прогресивним для свого часу, але його пояснення механізму еволюційного процесу було невірним і відбивала розповсюджена омана, характерне для біологів XVIII сторіччя. Із цією оманою можна зустрітися серед неспеціалістів, небіологів і в наші дні.
Ч. Дарвін (1809—1882) у своєму «Походженні видів...» розділив мінливість на певну й невизначену. Ця класифікація в загальному відповідає нинішньому розподілу мінливості на неспадкоємну й спадкоємну. Ч. Дарвін, сцформулювавший науковий принцип еволюційних перетворень, заснований на механізмі природного добору найбільш пристосованих форм, проте допускав спадкування придбаних властивостей, тобто спадкування модифікацій.
Одним з перших дослідників, що вивчали модифікаційну мінливість, був К. Нэгели (1865), який повідомив, що якщо альпійські форми рослин, наприклад ястребинки, переністи на багатий ґрунт Мюнхенського ботанічного саду, то в них виявляється збільшення потужності, рясне цвітіння, а деякі рослини змінюються до невпізнанності. Якщо ці ж форми знову перенести на бідні кам'янисті ґрунти, то вони вертаються до вихідної форми. Незважаючи на отримані результати, К. Нэгели залишався прихильником спадкування придбаних властивостей.
Уперше строгий кількісний підхід до дослідження модифікаційної мінливості з позицій генетики застосував В. Иоганнсен. Він вивчав спадкування маси й розміру насінь квасолі — ознак, у значній мірі мінливих як під впливом генетичних факторів, так і умов вирощування рослин.
Слайд 87
Маса насінь одного сорту квасолі варіювала в межах

від 150 до 750 мг при середній масі близько
500 мг. Насіння масою від 250 до 350 мг минулого висіяні окремо від насінь масою від 550 до 650 мг, і з вирослих рослин шляхом самозапилення знову були отримані насіння. Середня маса насінь, зібранных з рослин, що виросли з легких насінь, склала 443,4 мг, а з рослин, що виросли з важких насінь, — 518,7 мг. При цьому в обох випадках спостерігалося варіювання маси насінь, що добре відповідало нормальному розподілу. Наступне самозапилення й добір найважчих і найлегших насінь у межах самопильних ліній протягом шести поколінь не привели до успіху.
Таким чином, було показано, що досліджений сорт квасолі (самопильну рослину) не був ге-нптипически однорідним і при самозапиленні був розкладений на чисті лінії, тобто повністю гомозиготні лінії, у межах яких подальший добір не ефективний. Очевидно, в останньому випадку варіювання маси насінь було пов'язане з модіфікаційной мінливісттю.
Переконаним супротивником ідеї спадкування властивостей, придбаних в онтогенезі, був А. Вейсман (1833—1914). Послідовно відстоюючи дарвінівський принцип природного добору як рушійну силу еволюції, він запропонував розділити поняття соматогенных і бластогенных зміні, тобто зміни властивостей соматичних клітин і органів, з одного боку, і зміни властивостей генеративних клітин — з іншої. А. Вейсман указав на неможливість наявності механізму, який передавав би зміни соматичних клітин половим таким чином, щоб у наступнім поколінні організми змінювалися адекватно тем модифікаціям, які перетерпіли батьки під час свого онтогенезу.
Ілюструючи це положення, А. Вейсман поставив наступний експеримент, що доводив неспадкування придбаних ознак. Протягом 22 поколінь він відрубував білим мишам хвости й схрещував їх між собою. У цілому він обстежив 1592 особини й жодного разу не виявив укорочення хвоста в новонароджених мишенят. У подібному експерименті, результати якого були опубліковані в 1913 р., у сутності не було необхідності. «Результати навмисних ушкоджень у людини, зроблені з ритуальних або «естетичних» міркувань, — обрізання, протикання вух, губів, носової перегородки, видалення зубів, нівечення ступень, черепа і т.д., як відомо, не успадковуються» .
У підсумку дискусій і експериментів в області проблеми спадкування придбаних ознак на початку XX в. була сформульована точка зору, свого роду закон неспадкування змін, придбаних у ході онтогенеж. У наш час цей закон знайшов підтвердження у вигляді центральної догми молекулярної біології, згідно з якою перенос інформації можливий тільки від генетичного матеріалу (нуклеїнових кислот) до білок — генним продуктам, але не у зворотному напрямку.
Слайд 89
Модифікації — зміни організму в межах норми реакції
Існує
безліч прикладів модифікацій, викликуваних різними факторами зовнішнього середовища. Один
з найбільш вражаючих прикладів — визначення статі після запліднення в деяких нижчих тварин. У морського хробака Bonellia самці й самки мають однаковий генотип. Якщо молодих хробаків, що тільки що вилупилися з яєць, ізолювати й вирощувати окремо, то всі вони розвиваються в самок. Якщо тварин, що ж вилупилися, випустити поблизу дорослої самки, то деякі з них проникають у хоботок дорослої особини й розвиваються в мікроскопічних самців, які зрештою мігрують у полові шляхи самки. Тут вони живуть як паразити, виконуючи свою єдину функцію — запліднення яйцеклітин.
Слайд 90
У деяких хребетних тварин можливо фенотипове (гормональне) перевизначення

статі, яке, як, наприклад, у деяких риб, виявляється повним.
Проте в цих випадках подальше розщеплення по підлозі відповідає хромосомному механізму його визначення.
Відомо, що підводні й надводні листи деяких водяних рослин різняться за формою. Так, у водяного жовтцю (Batrachium) листи, занурені у воду, значно більш розсічені, чому надводні. В іншої водяної рослини — стрілолиста (Sagittaria) різняться за формою підводн надводні листи, що плавають на поверхні й. Примула (Primula sinensis), що несе домінантну аллель Р, утворює рожеві квітки при 15—20, а при 30—35°С квітки виявляються білими. Нагадаємо, що в гомозиготи по рецессивній аллелі (рр) квітки будуть білими при тих і інших температурах.
Яскравий приклад модифікаційної зміни у тварин — фарбування вовни гімалайського кролика. Звичайно при 20°С у цієї породи вовна біла, за винятком чорних вух» лабетів і плями навколо носа. При 30°С такі кролики виростають суцільно білими. Якщо ж гімалайському кроликові виголюють ділянка спини й прохолоджують його, наприклад прив'язуючи міхур з льодом, то в цій області виростає чорна вовна.
Для кожної області тіла є свій поріг температури, вище якого виростає біла вовна, а нижче — чорна.
Отже, прояв аллели, сh по якій гомозиготний гімалайський кролик, залежить від температури. Подібний досвід не може дати позитивного результату з білим кроликом альбіносом (caca).
В D. melanogaster відома мутація abnormal abdomen (A). Мухи, що несуть цю мутацію, відрізняються аномаліями розвитку черевця, але тільки якщо личинок вирощувати на перезволоженому кормі. На сухому кормі розвиваються нормальні мухи.
Кілька наведених прикладів показують, що певні типи модифікації виникають тільки в організмів певного генотипу. Отже, здатність до модифікацій успадковується й характеризує генетично задану норму реакції. Таким чином, було б невірно розглядати неспадкоємну мінливість — модифікації — у відриві від спадкоємної мінливості. Можливість модифікації визначається генотипом і реалізується при відповідних змінах зовнішнього середовища.
Слайд 92
Типи модифікаційних змін
Прийнято розглядати кілька типів модифікаційних змін.

Найбільш відомі адаптивні модифікації, тобто ненаслідувані зміни, корисні для
організму й сприятливі його виживанню при умовах, що змінилися. Так, у рослин, що живуть і умовах затемнення, збільшуються листові пластинки й тим самим активізується фотосинтез. У хутрових звірів при зниженні температури густіє мех. Засмага на шкірі людини являє собою адаптивна зміна, що сприяє більшої стійкості до опромінення сонячним світлом і т.д.
Приклад широко розповсюджених адаптивних модифікацій — реакція клітини на дію випромінювань і хімічних мутагенів. Наприклад, збереження в ДНК клітини циклобутанових димерів і інших продуктів дії ультрафіолетового випромінювання, що не усуваються конститутивними системами репарації при більших дозах опромінення, индукує систему репарації. Так само слід розглядати й реакцію адаптивної відповіді, коли попередня обробка клітин помірними дозами мутагену робить їх стійкіше до дії високих доз того ж мутагену.
Адаптивні модифікації — це реакція клітин і організму на зміни умов середовища, які неодноразово діяли на організм у ході еволюції. Усі вони — у межах норми реакції, заданої генотипом.
Невірно вважати, що .усі модифікації адаптивні. При інтенсивній дії багатьох агентів спостерігаються ненаслідувані зміни, випадкові ( по своєму прояву) стосовно впливу. Такі зміни називають морфозами. Дуже часто вони нагадують фенотиповий прояв відомих мутацій. Тоді їх називають фенокопиями цих мутацій. Наприкінці 30-х — початку 40-х років І. А. Рапопорт досліджував дію на дрозофілу багатьох хімічних з'єднань, показавши, що, наприклад, з'єднання ртуті викликають фенокопію Minute (тонкі щетинки); з'єднання сурми — brown (коричневі очі); мышьяковистая кислота й деякі інші з'єднання — зміни крил, пігментації тіла; з'єднання бору — eyeless (безглазие), arislo-pedia (перетворення арист у ноги), з'єднання срібла — yellow (жовте тіло) і т.д. При цьому деякі морфозы при впливі на певну стадію розвитку индукувались із вискою частотою ( до 100 %). Відзначене, що ступінь виразності морфоза підсилюється при збільшенні дози діючого з'єднання, що закономірно відрізняє індукцію морфозів і мутацій. Як відомо, ступінь прояву мутантного гена не залежить від дози мутагену, що викликав мутацію.
Відомі морфози, що виникають у рослин при недоліку або надлишку мікроелементів у ґрунті. Найчастіше морфози виражені у формі тих або інших каліцтв — відхилень від стандартного фенотипу, однак можливі й фенокопіі норми в різних мутантних ліній. Так, при підвищенні температури збільшується довжина крил у дрозофіли, мутантної по гену vestigial (зародкові крила).
Явище фенокопирования норми широко досліджується в мікроорганізмів. Це явище одержало також назву фепотипиче-ской супрессии. На відміну від генетичної супресії фенотипова не успадковується й проявляється тільки в умовах, які її викликають. Один з перших прикладів такого роду був отриманий
Слайд 93
С. Бензером і С. Чеймпом. Вирощуючи амбер-мутанти по

генах rll фага Т4 (див. гл. 15) у присутності
5-фторулацилау ці дослідники виявили, що деякі мутанти здобувають здатність лизировать клітини Е. соli ДО (А). Виявилося, що 5-фторурацил заміщає в іРНК урацил і може утворювати пари з гуаніном, а не з аденином. Тим самим индуцировались помилки трансляції, що приводили до нормалізації фенотипу деяких мутантів rii Фенотипову супрессію нонсенс-аллелей у бактерій викликають аминогликозидные антибіотики, зокрема, стрептоміцин. Як показав в 60-х роках Л. Горини, ці антибіотики зв'язуються з рибосомами й порушують точність зчитування генетичного коду.
Приклад фенотипової супрессії — відновлення життєздатності умовно летальних мутантів ( температурочувстви-тельных, чутливих до підвищеного осмотичному тиску, рН і т.д.) у пермиссивпых умовах. Явище фенотипової супресії використовують при вивченні дії гена. Це перспективний підхід до розшифрування молекулярного механізму модифи-кационных змін.
У більшості випадків модифікації не стійки й зникають, як тільки припиняється дія их агента, що викликав. Це не ставиться до морфозам і фенокопіям, про вражаючим втручання зовнішніх факторів у процеси реалізації ознаки на критичній стадії онтогенезу в момет закладки або дифференціювання досліджуваної органа. Такі модифікації зберігаються протягом усього особини життя. Необоротність подібних змін в онтогенезі пояснюється необоротністю індивідуального розвитку.
Складнішою є справа з деякими модифікаціями на клітинному рівні. Відомо кілька прикладів так званих тривалих модифікацій. Найбільш відомі експерименти В. Иоллоса, який уперше показав, що попередній вплив на парамецій невеликими дозами отрут підвищує стійкість цих інфузорій до наступних впливів тих же агентів. Стійкість зберігалася лише протягом ряду вегетативних розподілів парамецій і зникала після того, як відбувалася кон'югація, тобто полове розмноження. У цьому випадку тривала модифікація носила адаптивний характер.
Приклади тривалих модифікацій відомі й у багатоклітинних тварин. Так, у прісноводного рачка гіалодафнії залежно від харчування змінюється висота голови. При ряснім харчуванні й підвищеній температурі висота головного шолома збільшується, а при вбогім харчуванні й зниженій температурі — зменшується. Ці морфологічні особливості зберігаються при одержанні партеногенетиченого потомства й змісті варіантів, що різняться, в однакових умовах, однак відмінності поступово згладжуються й повністю зникають до третього партеногенетичномуу поколінню.
Подібні тривалі модифікації спостерігаються в культурах соматичних клітин і часто їх зв'язують із так званим епігеномним спадкуванням, тобто зі спадкуванням негенетичних змін. Механізм їх невідомий.
Слайд 94
Механізми модифікацій
Модифікаційні зміни традиційно протиставляють мутаціям. У цьому

протиставленні полягає глибокий зміст, оскільки мутації — це результат
порушення процесів відтворення генів, а модифікації — результат зміни дії генів.
З урахуванням цих особливостей модифікаційної мінливості при її вивченні необхідно дотримувати деяких загальних правил.
1. Вихідний матеріал повинен бути генотипічно однорідний.
2. Слід охарактеризувати норму реакції досліджуваної лінії, культури, клону на застосовувані впливи.
3. Необхідна статистична обробка матеріалу, при якій ураховується варіювання ознаки в контрольному й досвідченому варіантах і відтворюваність результатів при повторних досвідах.
4. Повинні бути проаналізовані спостережувані зміни: їх оборотність в онтогенезі, прояв у наступних поколіннях для розрізнення мутацій і модифікацій.
Недотримання цих правил приводить до неможливості інтерпретувати результати.
Причини модифікаційних змін, особливо адаптивних модифікацій, слід шукати в механізмах регуляції дії генів, про яких говорилося в попередній главі. Механізми регуляції краще досліджені в прикаріот і значно гірше в еукаріот. Очевидно, індукція адаптивних ферментів, регульованих по оперонной схемі в бактерій, представляє приклад адаптаційної модифікації. Дійсно, адаптація клітин Е. coli до лактози як до нового субстрату представляє модификлційна зміна в межах норми реакції клітини.
Уже згадувалося про індуцибельної системі репарації як прикладі широко розповсюдженого адаптивного модификацион-ного зміни на клітинному рівні. Ще один приклад універсального механізму адаптивних модифікацій — синдром, теплового шоку.
Як показав в 1962 г Ф. Ритосса, у гігантських хромосомах личинок дрозофіли в результаті реакції на різкі температурні впливи (37°С), а також на дію багатьох інших агентів, що ушкоджують, утворюється специфічний набір пуфів.
Цих пуфів небагато — від 5 до 10 у різних видів Drosophila. Вони виникають протягом першої хвилини після впливу на личинок або ізольовані слинні залози. Пуфи мають підвищену транскрипційну активність: до них направляються молекули РНК-Полімерази II і білки, що дестабілізують подвійну спіраль ДНК. У пуфах теплового шоку зменшується кількість гістону H1. Усе це узгодиться з виставами про те, що синдром теплового шоку торкається рівня транскрипції.
Через 30-40 хв величина пуфів зменшується. Якщо раніше понизити температуру, то цей процес прискорюється. Пуфи теплового шоку не вдається индукувати на ізольованих ядрах, і в той же час вони утворюються, якщо ядра з непрогрітих клітин слинних залоз инкубувати разом із цитоплазмою клітин, підданих тепловому шоку.
Слайд 95
Характерна риса реакції на тепловий шок — зменшення

пуфів, що наявні у політенних хромосомах до нагрівання. При
цьому припиняється синтез, що раніше синтезувалися іРНК, а транскрипція генів гистонов, рРНК, тРНК і генів мітохондрій зберігається на колишньому рівні. Правда, спостерігається порушення дозрівання 18S, 28S і 5S рРНК.
Трансляція в клітинах організму, підданого тепловому шоку, перемикається зі старих іРНК на нові й РНК, синтезовані в результаті реакції на вплив, що ушкоджує. Старі полісоми руйнуються й утворюються нові. Продуктами цих полісом в D. melanogaster служать вісім основних білків теплового шоку. Через 6-8 год послу початку прогрівання вони становлять до 10% усього білка клітини.
Якщо синтез білків теплового шоку придушити при підвищенні температури, то після зниження температури клітина не може повернутися до синтезу нормальних білків. Це вказує на адаптивний характер синдрому теплового шоку. Самі білки теплового шоку виявляють підвищена спорідненість до хроматину. Вони мігрують у ядро й зв'язуються із хромосомами переважно в районах розташування еухроматину.
Про важливу роль білків теплового шоку свідчить і високий рівень їх еволюційної консервативності. Так, ген дрозофіли, що кодує білок теплового шоку масою 70 000 Д, був клонований і виявив гомологію в досвідах по гібридизації із ДНК людину, миші, курки, ящірок, дріжджів і кукурудзи. У всіх цих організмів і ряду інших були виявлені білки теплового шоку, аналогічні таким D. melanogaster.
Зараз ще не ясні ті регуляторні механізми, які запускаються .у клітинах при підвищенні температури й інших впливах, що викликає «синдром теплового шоку», але очевидно, що виявлений ще один універсальний генетичний механізм -механізм неспецифічних адаптивних модифікацій.
Причини модифікацій, мабуть, не зводяться тільки до механізмів репресії й індукції ферментів. Очевидно, існують і деякі спонтанні порушення в дії генів, які можуть бути причинами морфозів і фенокопій. Уперше спробу дослідження таких «випадкових» модифікацій почав Б. Л. Астауров в 1927 р. Він досліджував відкриту їм мутацію tetraptera в D. melanogaster. Ця репресивна мутація приводить до перетворення галтер, або жужжалец, у другу пару крил. Б. Л. Астауров звернув увагу на сильне варіювання в прояві мутантної ознаки, навіть в умовах постійного середовища й гомозиготності по досліджуваної мутантної аллелі. Ознака tetraptera варіював не тільки від особини до особини: розмір додаткової пари крил був неоднаковий, але спостерігалася відмінність у його прояві на лівій і правої сторонах тіла дрозофіли. На основі отриманих результатів Б. Л. Астауров зробив висновок про закономірну нестійкість у дії гена, експресія якого може спонтанно варіювати, і, очевидно, ця непідвалина мінливість і є основою прояву модифікацій. Аналогічний приклад представляє вивчення мутантної ознаки Ваг в D. melanogaster. Число фасеток у левом і правом очах дрозофіли також може варіювати. Надалі це явище одержало назву «шуми індивідуального розвитку» (developmental noise).
Слайд 96
Причиною таких нерегулярних модифікацій може бути порушення експресії

генетичної інформації на різних стадіях; від транскрипції до ферментативної
реакції білка — генного продукту й далі порушення морфогенетичних процесів. Один з підходів до вивчення закономірної нестійкості в експресії генетичної інформації на рівні трансляції намітився в 60-х роках.
Л. Горі ні й інші досліджували явище фенотипової супрессії нонсенс-мутацій Е. сой при дії стрептоміцину. Цей антибіотик зв'язується з рибосомами бактерій, що приводить до порушень у зчитуванні генетичного коду. Результатом цього може бути фенокопії норми. Наприклад, деякі нонсенс-мутанти, що несуть нонсенс-кодоиы в гені, що контролює біосинтез аргініну, можуть рости на середовищі без аргініну, але в присутності сублетальних доз стрептоміцину. Різні мутації, що змінюють білки рибосом, сприяють підвищенню рівня фенотипової супрессії (білки S4, S5, L7/L12) або зниженню рівня фенотипової супрессії (S12, S17, L6).
Аналогічні результати отримані для дріжджів-сахаромицетів при дії аминогликозидного антибіотика паромомицина, що також приводить до фенотипової супрессії нонсенс-аллелей, що виникають у різних генах. У роботах співробітників кафедри генетики й селекції Ленінградського університету показане, що в дріжджів фенотипова супрессія мутацій-нонсенсів відбувається й при дії таких звичайних умов, як зниження температури з 30 до 20°С або при заміні глюкози на нееферментовані джерела вуглецю (гліцерин, етанол або галактоза).
Таким чином, помилки трансляції, що підсилюються при деяких зовнішніх впливах, характерні як для прокаріот, так і для еукаріот і можуть бути причиною модифікаційних змін — фенокопії норми.
Інший можливий механізм модифікацій — тимчасові ненаслідувані зміни генетичного матеріалу, що усуваються потім системами репарації. Так, М. Рєзник і Р. Хол-Лидэй (1971) досліджували синтез індукованого ферменту нітрат редуктази в гриба Ustilago maidis. Якщо цей фермент индуцировать в U. maidis безпосередньо після опромінення гриба ультрафіолетовим світлом, те ферментативна активність у порівнянні з нормою падає. При цьому в клітинах синтезується значна кількість білка, іммунологічно родинного нітратредуктазі, але, що не володіє ферментативною активністю. Якщо ж перед індукцією ферменту після опромінення в гечение деякого часу відбувається темнова (ексцизиійна) репарація, то активність ферменту знову підвищується.
Цей експеримент показує, що фотопродукти, що утворюються в ДНК, служать причиною зниження активності ферменту, появи його аномальних варіантів. Отже, подібні зміни виявляються ненаслідуваними, тобто модификаційними.
Подібні ненаслідувані порушення структури генетичного матеріалу, очевидно, проявляються в критичні періоди індивідуального розвитку організму, при детермінації клітин. Як відомо, більшість предмутационных змін ДНК усувається системами репарації. Тимчасові, ненаслідувані далі ушкодження генетичного матеріалу можуть стати причиною модифікацій типу морфозів і інших уроджених аномалій розвитку.
Слайд 97
Взаємозв'язок модифікаційної й спадкоємної мінливості
Неодноразово відзначалися відмінності модифікаційної

й спадкоємної мінливості. Проте між ними існує взаємозв'язок щонайменше
у двох відносинах.
По-перше, модифікації являють собою ненаслідувані зміни в межах норми реакцій, обумовленої генотипом. Це створює певні труднощі при вивченні модифікацій у природних популяціях, де немає чистих ліній. У цих випадках, як показав Н. В. Глотов для кількісних ознак, частка мінливості за рахунок взаємодії генотип-середовище може становити більш 50% від усієї спостережуваної мінливості. По-друге, ті самі фактори зовнішнього середовища можуть бути причиною як модифікаційних, так і спадкоємних змін, що виникають за рахунок мутацій і підвищення частоти рекомбінації. При цьому вплив середовища на мутаційний процес і рекомбінацію опосередковує модифікаціями — онтогенетичними адаптаціями організму, що розвивається.
М. М. Тихомирова шляхом добору одержала лінію Т Dr. melanogastery здатну жити й залишати потомство при температурі 32°С. Звичайно при цій температурі мухи розвиваються, але виявляються стерильними. Так поводиться, зокрема, стандартна лабораторна лінія Кантон-З. Спадкоємні відмінності цих двох ліній по теплотривкості виявляються при змісті їх при 36 °С: середня тривалість життя мух Кантон-З 6,5+0,1 год, а мух лінії т-Т— 16,4±0,3 ч. Однак цей результат залежить від температури попереднього розвитку лінії Т. Так, якщо лінія Т розвивалася при 32°С, те через 10 год при 36°С у ній залишається 82,3d=4,0% мух живими, а якщо вона розвивалася при 25°С, те за тих самих умов залишаються живими 29,2±6,6% мух. Таким чином, онтогенетичесна адаптація (модифікація), що розвивається на тлі генотипичної преадаптації, визначає реакцію дрозофіли на високу температуру. Більше того, вивчення мутагенної післядії високої температури, як виявилося, також залежить від онтогенетичної адаптації. Висока температура (33°С) після опромінення рентгенівськими променями викликає додаткове підвищення частоти втрат Х-Хромосом тільки в тому випадку, коли лінія Т була вирощена при 25°С, але не при 32°.
Різні стресові впливи на організм не тільки індукує системи адаптації, що підвищують стійкість організму, але й активно впливають на спадкоємну мінливість.
Д. К. Бєляєв і П. М. Бородін показали, що стрес у мишей підвищує частоту кроссинговеру, а Р. І. Цапыгина, С. Н. Новиков і інші виявили мутагенний ефект феромонального стресу в того ж об'єкта. В останньому випадку в якості стреора, або стресуючого агента, використовували захід дорослого самця, який підвищував частоту цитологічних порушень у сперматогенезі в молодих мишей, збільшував частоту аномальних сперматозоїдів і домінантних леталей після спарювання з интактными самками. Слід зазначити, що заходи — це нормальний спосіб комунікації в мишей, і при наступній адаптації, тобто при неоднорідних впливах такого стрессора, частота всіх показників генетичних аномалій верталася до норми.
Слайд 98
У зв'язку з модифікаціями й генотиповій мінливістю становлять
інтерес отримані в останні роки дані про те, що
ті самі впливи, що викликають стресову адаптивну реакцію організму, можуть активувати мігруючі елементи генома. Так, показане, що при температурному шоку в дрозофилы різко й значно підвищується кількість транскриптів мігруючого елемента copia. У довгих термінальних повторах цього елемента втримуються послідовності, гомологичні усередненій структурі промоторів генів теплового шоку. Ці дані відповідають тому, що температурні впливи активують переміщення мобільних елементів у кукурудзи, дрозофіли й дріжджів, а також дозволяють розглядати мігруючі елементи як мобільні промотори, що регулюють експресію прилеглих генів в екстремальних умовах.
Таким чином, розглянуті приклади показують, що вплив зовнішніх впливів на модифікаційну й спадкоємну мінливість залежить від попередньої онтогенетичної адаптації до них.
Слайд 99
Вплив феромонального стресу на
частоту хромосомних аберацій у мишей
(Р. І. Цапыгина, Е.В.Даев, С.Н.Новиков, 1981), Представлені дані про частоту аберацій у сперматогенезі:
1— без додаткового впливу, 2 — результат приміщення мишей 30-денного віку на чисту підстилку, 3, 4 — результат приміщення мишей того ж віку на підстилку після перебування на ній самців 3 -4--4-місячного віку ліній
С57В6 і СВА відповідно