Слайд 2
Протеолиз в желудке
Протеолиз начинается в желудке и заканчивается
в тонком кишечнике. В желудке белки перевариваются под воздействием
пепсина, который вырабатывается в виде пепсиногена главными клетками слизистой оболочки желудка. Под воздействием соляной кислоты, которая продуцируется в обкладочных клетках желудочных желез, от пепсиногена с N-конца отщепляется полипептид из 42 аминокислотных остатков, состоящий их остаточного пептида и ингибитора пепсина и он превращается в активный пепсин:
Hcl
пепсиноген пепсин + ингибитор пепсина + полипетид
Превращение пепсиногена в пепсин может происходить и аутокаталитически:
пепсиноген пепсин + ингибитор пепсина + полипептид
пепсин
Слайд 3
Кислотность желудочного сока
Одним из показателей функциональной активности желудочного
сока является кислотность, которая определяется титрованием желудочного сока 0,1М
раствором NаОН и выражается в условиях базальной секреции тремя константами в единицах кислотности.
В норме кислотность желудочного сока равна:
общая кислотность - 40-60 ед. кислотности
свободная НCl - 20-40 ед. кислотности
связанная HCl - 10-12 ед. кислотности
За единицу кислотности принимается количество миллилитров 0,1М раствора NаОН, которые расходуется для нейтрализации 100 мл желудочного сока.
Слайд 4
Пепсин, гастриксин
Пепсин, как фермент из класса гидролаз,
вызывает гидролиз внутренних пептидных связей в молекуле белка, образованных
карбоксильными группами ароматических аминокислот (фенилаланин, тирозин и триптофан).
В желудочном соке детей функцию пепсина выполняет гастриксин, имеющий оптимум рН около 3,5.
Гастриксин гидролизует пептидные связи, образованные дикарбоновыми аминокислотами.
У взрослого человека соотношение пепсин/гастриксин в желудочном соке 4:1.
При язвенной болезни оно меняется в пользу гастриксина. В
Слайд 5
Протеолиз в кишечнике
В кишечник из поджелудочной железы поступают

в неактивном виде, в виде проферментов: трипсиногена, химотрипсиногена, прокарбоксипептидаз
А и В, проэластазы.
Ключевым процессом активирования всех проферментов является образование трипсина из трипсиногена под воздействием кишечной энтерокиназы.
Механизм активирования трипсиногена заключается в гидролизе одной из N-концевой пептидной связи и отрыве гексапептида, называемого ингибитором трипсина.
Если произойдет активация трипсиногена непосредственно в поджелудочной железе, то это вызовет протеолиз белков поджелудочной железы, что приведет к панкреатиту.
В этих случаях для лечения следует использовать ингибиторы трипсина (трасисилол и др.).
Трипсин, разрывая пептидные связи в остальных проферментах, образует активные формы химотрипсина, карбоксипептидаз и эластазу.
Активный трипсин, как эндопептидаза, гидролизует пептидные связи в молекуле белка образованные главным образом карбоксильными группами лизина и аргинина.
Слайд 6
Химотрипсин, эластаза карбоксипетидазы и др.
Химотрипсин гидролизируют связи

образованные тирозином, фенилаланином и триптофаном и тем похож на
пепсин.
Эластаза гидролизует пептидные связи в полипептидах, где находится пролин.
Карбоксипетидазы (А и В), как экзопептидазы, отщепляют от полипептидных цепей С-концевые аминокислоты.
Аминопептидазы кишечного сока гидролизуют N-концевые пептидные связи, отщепляя N-концевые аминокислоты.
Аминонопептидазы активируются цинком или марганцем и цистеином.
Дипептидазы кишечного сока (активируются кобальтом, марганцем и цистеином) гидролизует дипептиды до свободных аминокислот.
Под воздействием всех протеолитических ферментов желудочно-кишечного тракта белки пищи разрушаются (перевариваются) до аминокислот.
Процесс переваривания белков регулируется системой гормоноподобных соединений, образующихся в клетках пищеварительного тракта.
Такими соединениями являются гистамин, гастрин, энтерогастрон и продуцируемые клетками тонкого кишечника секретин, панкреозимин, химоденин, энтерокринин и др.
Слайд 7
Всасывание аминокислот
Всасывание аминокислот активный, энергозависимый процесс и требует

необходимого градиента ионов натрия, создаваемого за счет Na+,K+-АТФ-азой.
Существует
не менее пяти специальных систем переносчиков аминокислот: для нейтральных алифатических, для циклических, для кислых, для основных и для иминокислот.
Считается, что существует также специальная гамма-глутаминилтрансферазная система транспорта всех аминокислот, кофактором которой служит глутатион.
В кишечнике возможно всасывание небольших количеств дипептидов. Всасываются они путем пиноцитоза и внутри клетки гидролизуются протеиназами лизосом.
У новорожденных вследствие низкой протеолитической активности ферментов пищеварительных соков и высокой проницаемости мембран клеток слизистой оболочки кишечника возможно всасывание нативных белковых молекул и их фрагментов, что может вызвать повышенную чувствительность к ним организма и явиться причиной пищевой аллергии.
Наиболее активно используют аминокислоты печень и почки и менее активно головной мозг. У новорожденных и детей раннего возраста клеточные барьеры более проходимы и поэтому даже в головной мозг аминокислоты поступают очень быстро.
Слайд 8
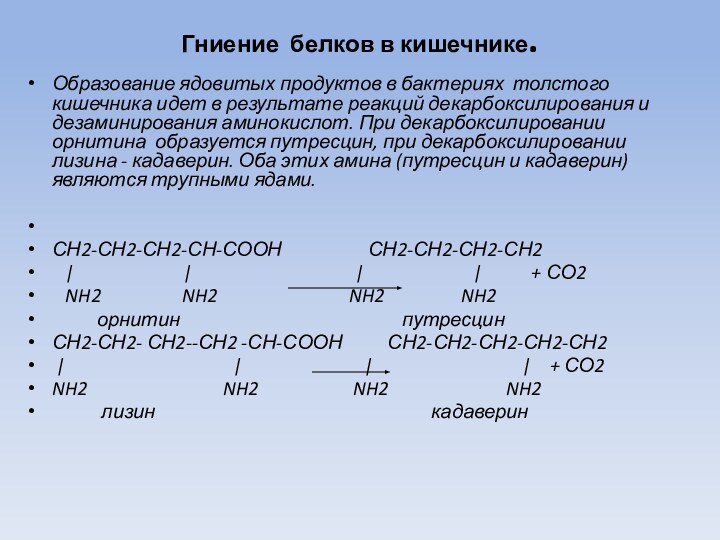
Гниение белков в кишечнике.
Образование ядовитых продуктов в
бактериях толстого кишечника идет в результате реакций декарбоксилирования и
дезаминирования аминокислот. При декарбоксилировании орнитина образуется путресцин, при декарбоксилировании лизина - кадаверин. Оба этих амина (путресцин и кадаверин) являются трупными ядами.
СН2-СН2-СН2-СН-СООН СН2-СН2-СН2-СН2
| | | | + СО2
NH2 NH2 NH2 NH2
орнитин путресцин
СН2-СН2- СН2--СН2 -СН-СООН СН2-СН2-СН2-СН2-СН2
| | | | + СО2
NH2 NH2 NH2 NH2
лизин кадаверин
Слайд 9
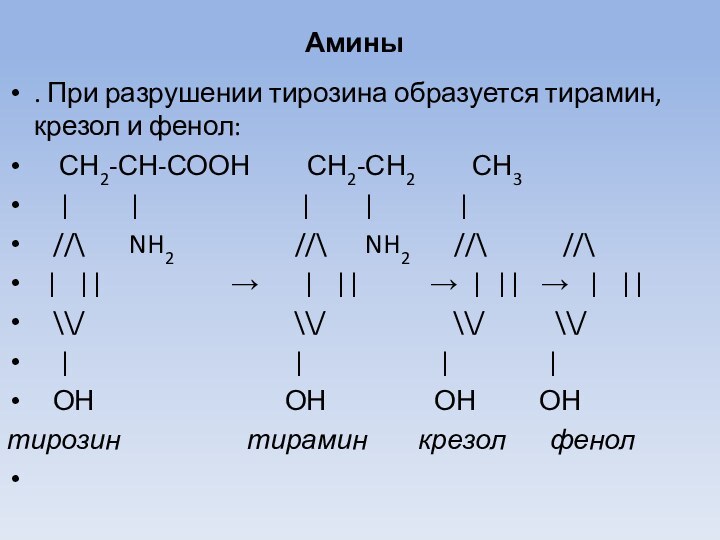
Амины
. При разрушении тирозина образуется тирамин, крезол и
фенол:
СН2-СН-СООН СН2-СН2
СН3
| | | | |
//\ NH2 //\ NH2 //\ //\
| || → | || → | || → | ||
\\/ \\/ \\/ \\/
| | | |
ОН ОН ОН ОН
тирозин тирамин крезол фенол
Слайд 10
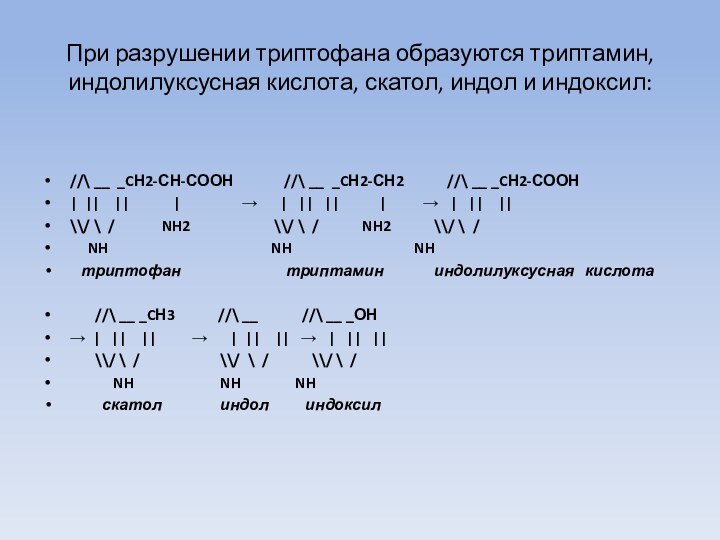
При разрушении триптофана образуются триптамин, индолилуксусная кислота, скатол,
индол и индоксил:
//\ __ _CН2-СН-СООН
//\ __ _CН2-СН2 //\ __ _CН2-СООН
| || || | → | || || | → | || ||
\\/ \ / NH2 \\/ \ / NH2 \\/ \ /
NH NH NH
триптофан триптамин индолилуксусная кислота
//\ __ _CН3 //\ __ //\ __ _ОН
→ | || || → | || || → | || ||
\\/ \ / \\/ \ / \\/ \ /
NH NH NH
скатол индол индоксил
Слайд 11
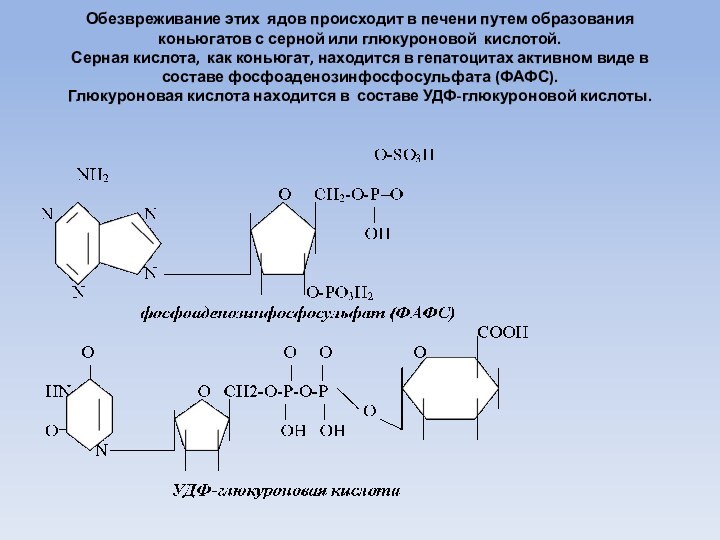
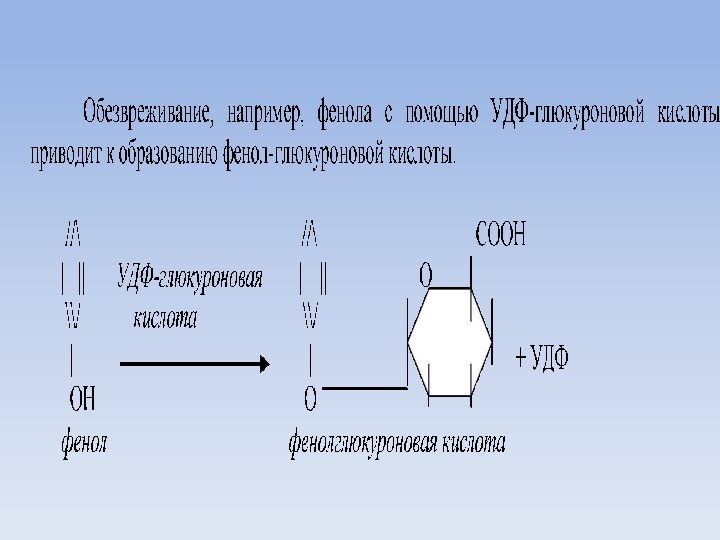
Обезвреживание этих ядов происходит в печени путем образования
коньюгатов с серной или глюкуроновой кислотой.
Серная кислота, как
коньюгат, находится в гепатоцитах активном виде в составе фосфоаденозинфосфосульфата (ФАФС).
Глюкуроновая кислота находится в составе УДФ-глюкуроновой кислоты.
Слайд 13
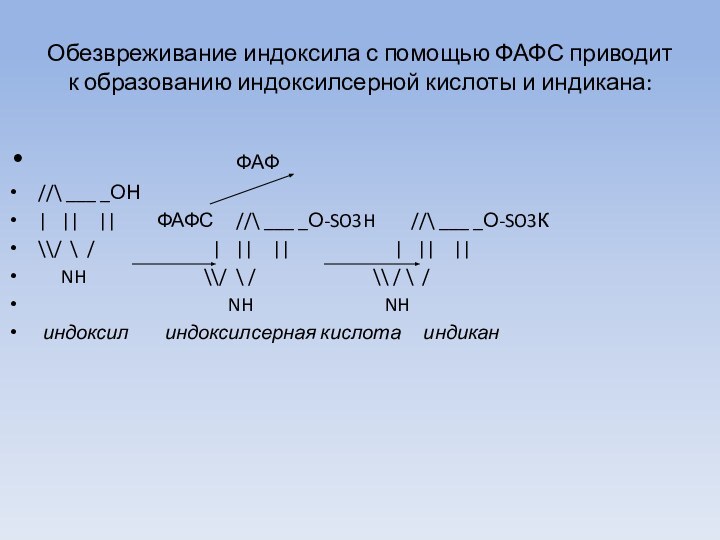
Обезвреживание индоксила с помощью ФАФС приводит к образованию
индоксилсерной кислоты и индикана:
ФАФ
//\ ___ _ОН
| || || ФАФС //\ ___ _О-SO3H //\ ___ _О-SO3К
\\/ \ / | || || | || ||
NH \\/ \ / \\ / \ /
NH NH
индоксил индоксилсерная кислота индикан
Слайд 14
Проба Квика.
С целью контроля за состоянием детоксикационной функции
печени пациенту предлагается выпить безвредный раствор бензойной кислоты и
затем в суточной моче определяется содержание образующейся из бензойной кислоты и гликокола гиппуровой кислоты.
По количеству выделенной гиппуровой кислоты судят об обезвреживающей функции печени:
___СООН ___СО-NH-CH2-COOH
//\ //\
| || + NH2-CH2-COOH → | || + НОН
\\/ гликокол \\/
бензойная гиппуровая кислота
кислота
Слайд 15
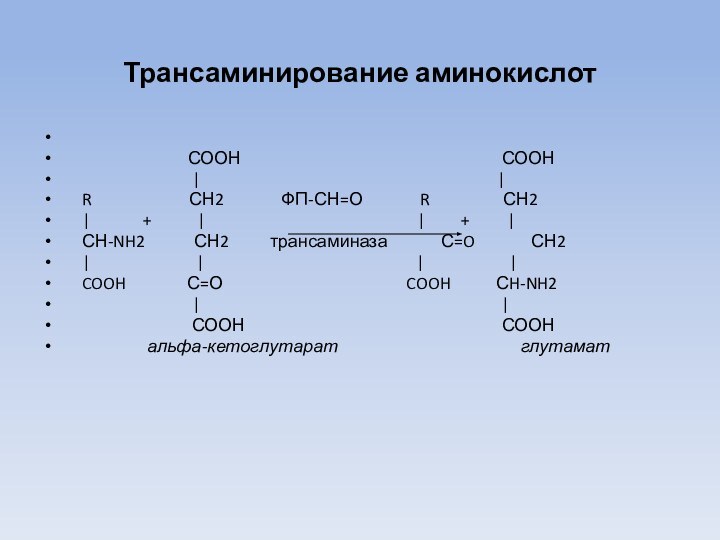
Трансаминирование аминокислот
СООН СООН
| |
R СН2 ФП-СН=О R СН2
| + | | + |
СН-NH2 СН2 трансаминаза С=O СН2
| | | |
COOH С=О COOH СH-NH2
| |
СООН СООН
альфа-кетоглутарат глутамат
Слайд 16
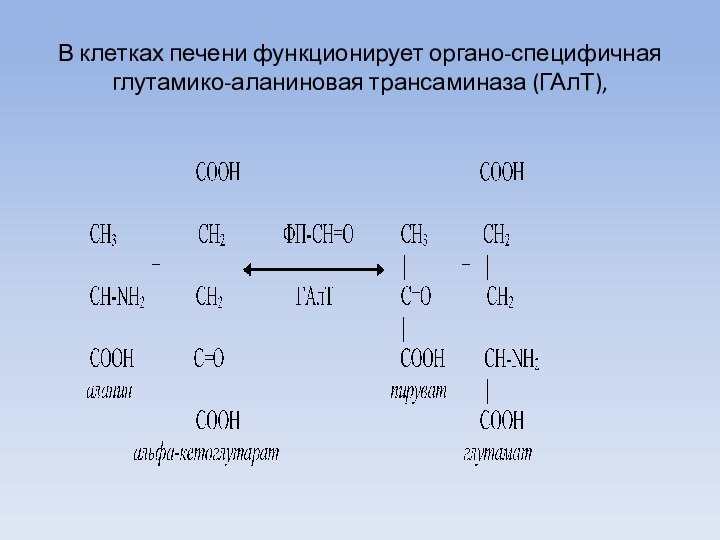
В клетках печени функционирует органо-специфичная глутамико-аланиновая трансаминаза (ГАлТ),
Слайд 17
В кардиомиоцитах - глутамико-аспарагиновая трансаминаза (ГлАсТ).
Слайд 18
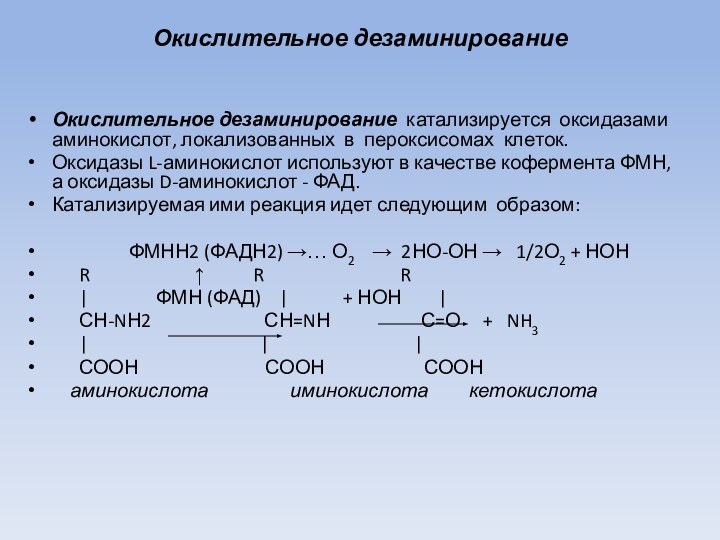
Окислительное дезаминирование
Окислительное дезаминирование катализируется оксидазами аминокислот, локализованных в
пероксисомах клеток.
Оксидазы L-аминокислот используют в качестве кофермента ФМН,
а оксидазы D-аминокислот - ФАД.
Катализируемая ими реакция идет следующим образом:
ФМНН2 (ФАДН2) →… О2 → 2НО-ОН → 1/2О2 + НОН
R ↑ R R
| ФМН (ФАД) | + НОН |
СН-NН2 СН=NН С=О + NH3
| | |
СООН СООН СООН
аминокислота иминокислота кетокислота
Слайд 19
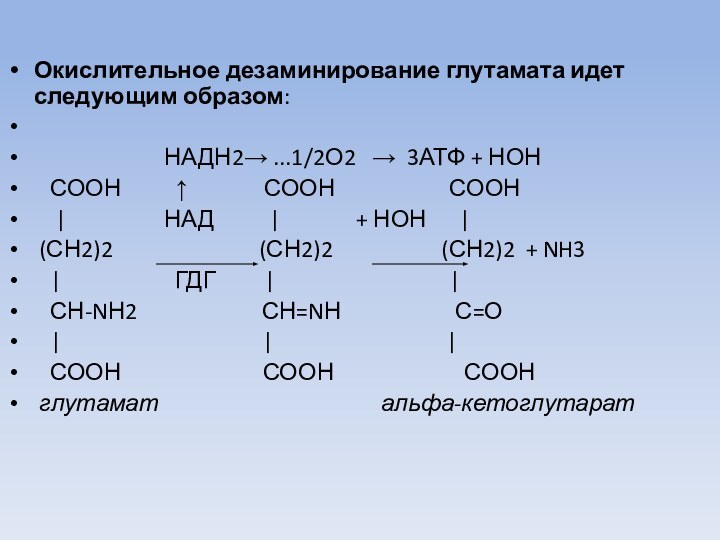
Окислительное дезаминирование глутамата идет следующим образом:
НАДН2→ ...1/2О2 → 3АТФ + НОН
СООН ↑ СООН СООН
| НАД | + НОН |
(СН2)2 (СН2)2 (СН2)2 + NH3
| ГДГ | |
СН-NН2 СН=NН С=О
| | |
СООН СООН СООН
глутамат альфа-кетоглутарат
Слайд 20
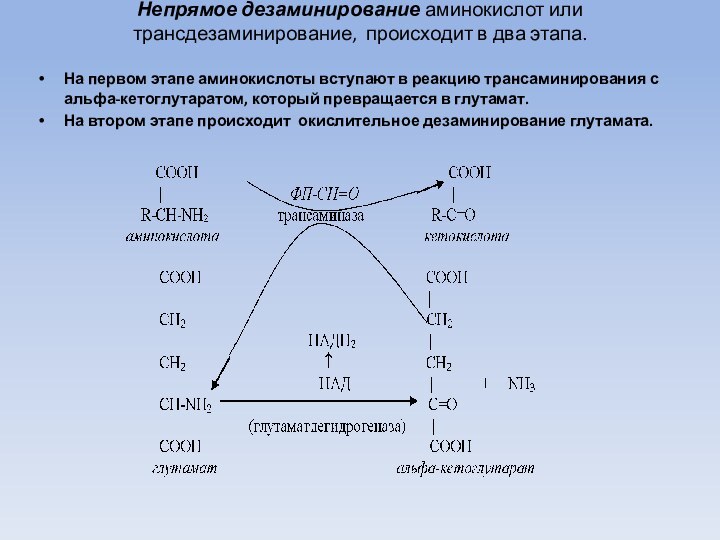
Непрямое дезаминирование аминокислот или трансдезаминирование, происходит в два
этапа.
На первом этапе аминокислоты вступают в реакцию трансаминирования с
альфа-кетоглутаратом, который превращается в глутамат.
На втором этапе происходит окислительное дезаминирование глутамата.
Слайд 21
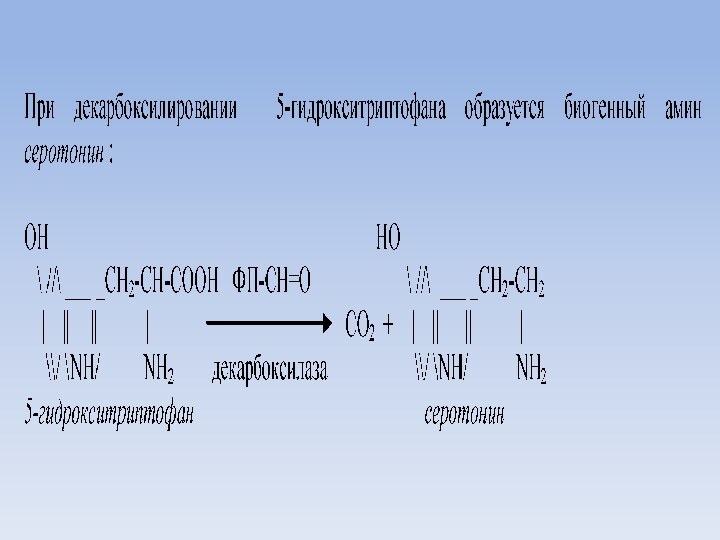
Декарбоксилирование аминокислот. Биогенные амины
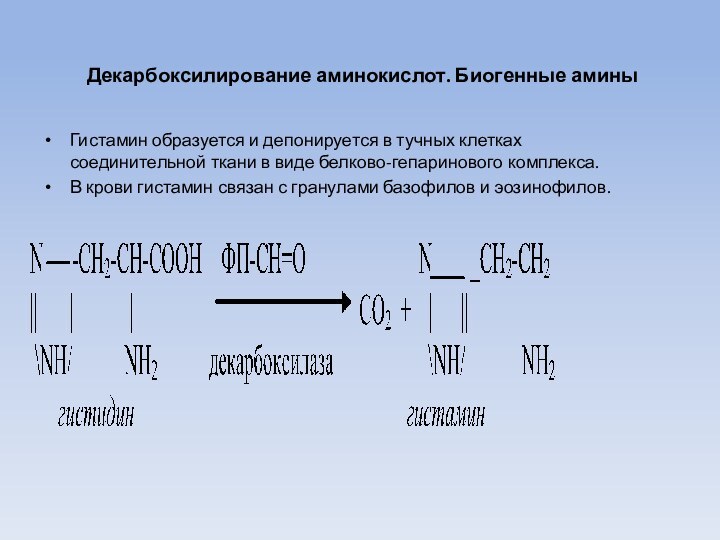
Гистамин образуется и
депонируется в тучных клетках соединительной ткани в виде белково-гепаринового
комплекса.
В крови гистамин связан с гранулами базофилов и эозинофилов.
Слайд 23
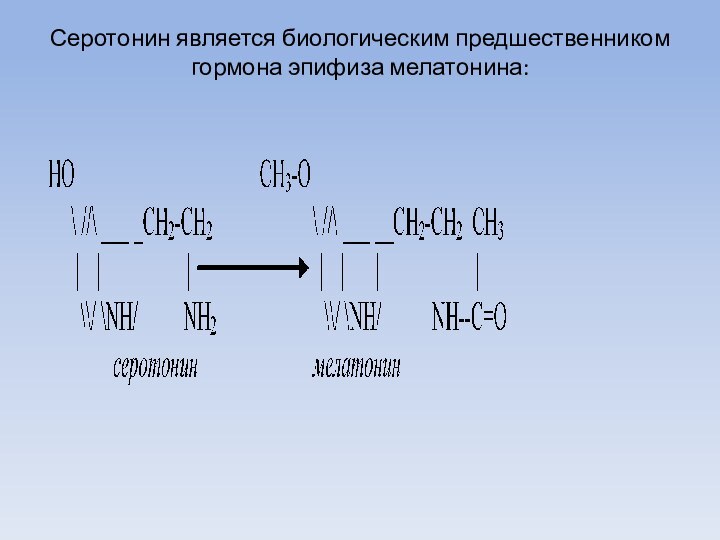
Серотонин является биологическим предшественником гормона эпифиза мелатонина:
Слайд 24
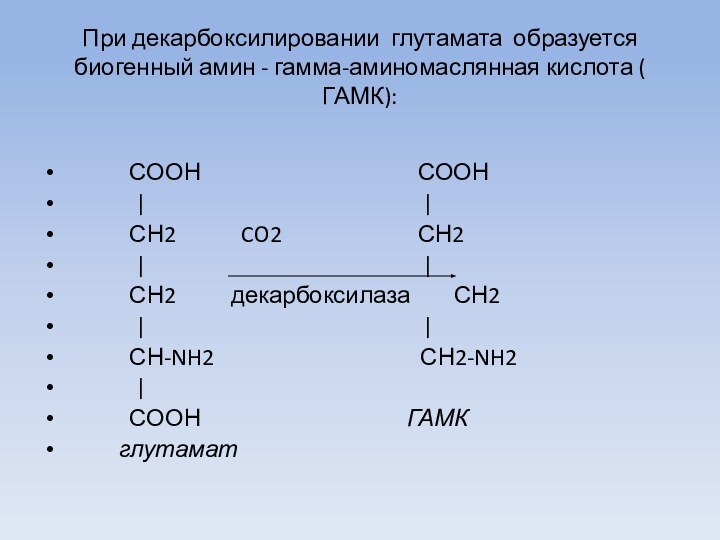
При декарбоксилировании глутамата образуется биогенный амин - гамма-аминомаслянная
кислота ( ГАМК):
СООН
СООН
| |
СН2 CO2 СН2
| |
СН2 декарбоксилаза СН2
| |
СН-NH2 СН2-NH2
|
СООН ГАМК
глутамат
Слайд 25
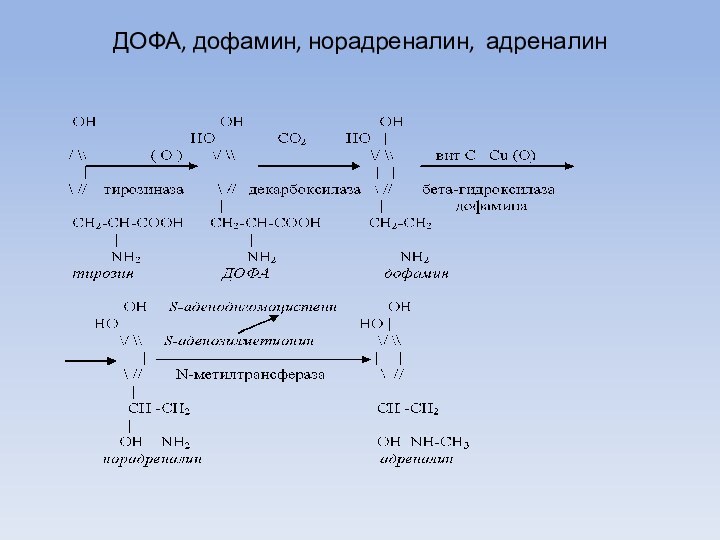
ДОФА, дофамин, норадреналин, адреналин
Слайд 26
Обезвреживание биогенных аминов осуществляется путем окислительного дезаминирования, путем
метилирования, путем реакций коньюгации.
Основной путь обезвреживания биогенных аминов, которым
относятся адреналин, норадреналин, гистамин и др. - это окислительное дезаминирование, катализируемое аминоксидазами:
H
( О ) |
R-СН2-NH2 R-С=О + NН3
амин аминоксидаза альдегид аммиак
Различают два типа аминоксидаз - моноаминоксидазы (МАО) и диаминоксидазы (ДАО). Коферментом МАО является ФАД, коферментом ДАО - фосфопиридоксаль.
МАО инактивирует первичные, вторичные и третичные амины, в т.ч. и катехоламины. ДАО - инактивирует гистамин, путресцин, кадаверин.
Слайд 27
Обезвреживание катехоламинов
Второй путь обезвреживания катехоламинов - О-метилирование под
воздействием фермента катехол-О метилтрансферазы.
Донатором метильных групп в этой
реакции служит S-аденозилметионин.
В клинической практике зачастую используются препараты, изменяющие метаболиз биогенных аминов.
В частности для лечения депрессивных состояний, шизофрении, гипертонической болезни используются ингибиторы МАО - ипразид, ипраниазид, гармин и др.
Слайд 28
Обезвреживание аммиака. Биосинтез мочевины.
Обезвреживание аммиака. Биосинтез мочевины.
Характерные для
аминокислот пути катаболизма, в конце концов, приводят к образованию
конечных продуктов азотистого обмена, образование которых идет из токсичного для клеток и в целом для организма аммиака и из без азотистых остатков аминокислот.
К конечным продуктам азотистого обмена относятся вода, углекислый газ, мочевина, аммонийные соли, креатинин, индикан, уробилин.
Аммиак образуется в ходе следующих катаболических реакций:
- при дезаминировании аминокислот,
- при дезаминировании биогенных аминов,
- при дезаминировании пуриновых оснований,
- при распаде пиримидиновых оснований