Слайд 2
План лекции
1. О сущности живого
2. Клетка – миниатюрная
биосистема
3. Поверхностный аппарат клетки
4. Метаболический аппарат клетки.
Этапы внутриклеточного транспорта
5. Ядерный аппарат клетки
Слайд 3
Сущность живого
Жизнь существует в форме нуклеопротеидных комплексов.
Это биосистемы
характеризующиеся 5 признаками:
открытые
самообновляющиеся
саморегулирующиеся
самовоспроизводящиеся
высокоупорядоченные
Слайд 5
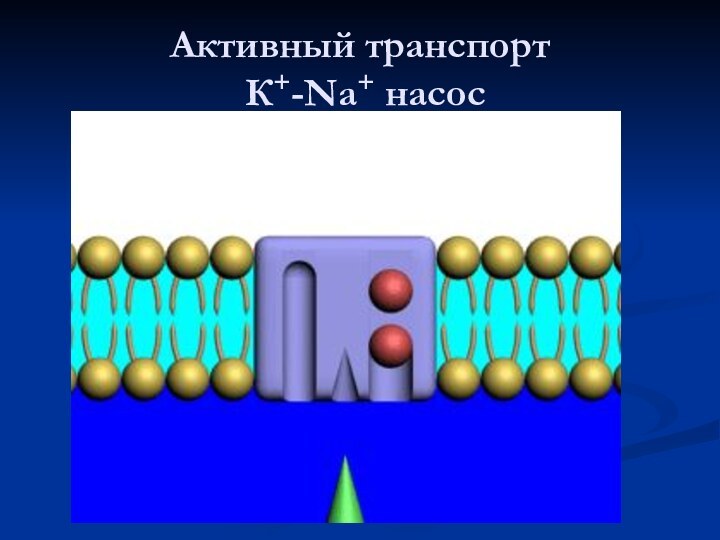
Активный транспорт
К+-Na+ насос
Слайд 6
Метаболический аппарат клетки
Современные представления о связи мембранных органелл
в клетке
В клетке есть постоянные компартменты,
связь между
ними
осуществляют т.с. клетки (транспортные пузырьки)
ЭР
АГ состоит из 3-х компартментов, 3 этапа перемещения в-в, на каждом особый набор ферментов
ТС
цис- часть АГ
ТС
средняя часть АГ
ТС
транс-часть АГ
ТС
ТС
поверхн. аппарат
клетки
лизосома
Слайд 7
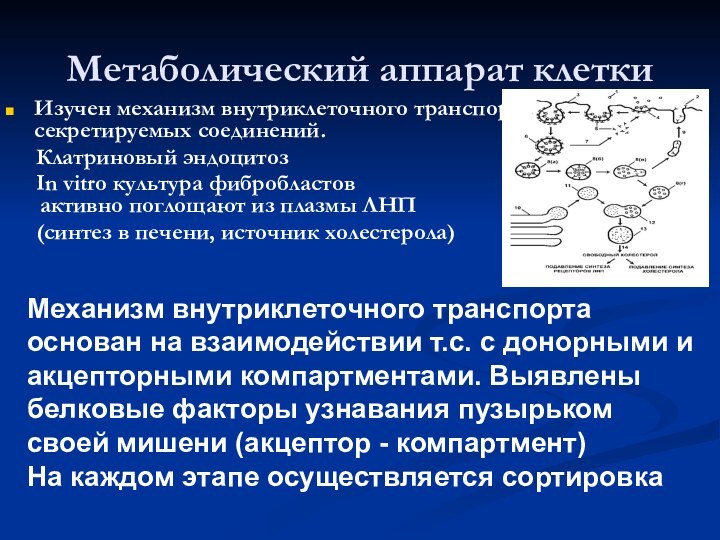
Метаболический аппарат клетки
Изучен механизм внутриклеточного транспорта секретируемых соединений.
Клатриновый эндоцитоз
In vitro
культура фибробластов
активно поглощают из плазмы ЛНП
(синтез в печени, источник холестерола)
Механизм внутриклеточного транспорта основан на взаимодействии т.с. с донорными и акцепторными компартментами. Выявлены белковые факторы узнавания пузырьком своей мишени (акцептор - компартмент)
На каждом этапе осуществляется сортировка
Слайд 8
Лекция 2
Межклеточная химическая сигнализация
План лекции:
Понятие о биомолекулярных
сигналах и рецепторах
Стратегии межклеточной химической сигнализации
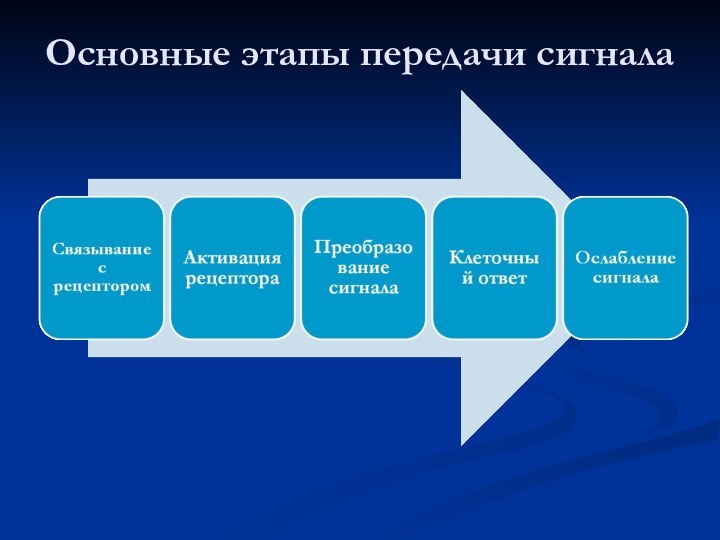
Основные этапы передачи сигнала
3.1
Связывание сигнальной молекулы с рецептором; рецепторная специфичность.
3.2 Активация рецептора
3.3 Преобразование сигнала и развитие клеточного ответа
Слайд 9
Внеклеточные регуляторные вещества – биомолекулярные сигналы:
нейромедиаторы и нейропептиды
гормоны
локальные
химические агенты , такие как тканевые гормоны, цитокины, липидные
медиаторы
антигены
По химической природе могут быть гидрофильными и гидрофобными.
Связываются с рецепторами клеток-мишеней.
Рецепторы
от лат. receptio – получение, прием – молекулы (обычно – белковые), расположенные на поверхности клетки, в цитоплазме или ядре, способные распознавать определенные химические группировки и специфически связывать различные вещества – лиганды
Межклеточная химическая сигнализация осуществляется посредством сигнальных молекул, воздействующих на молекулы рецепторов
Слайд 10
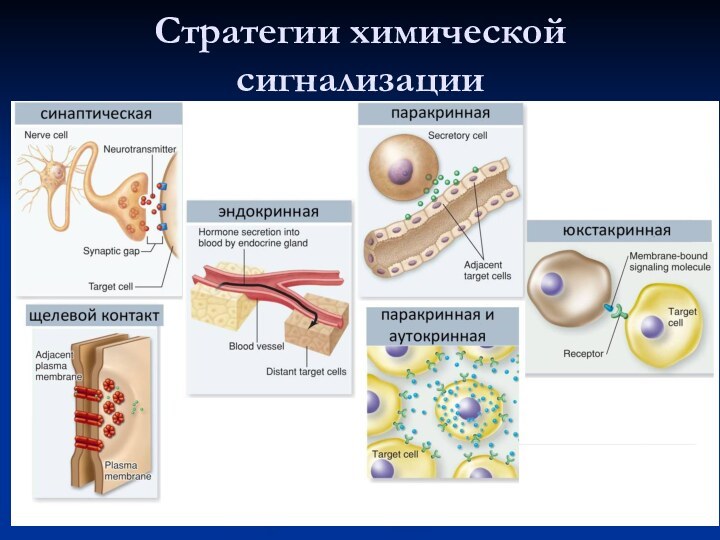
Стратегии химической сигнализации
Слайд 11
Основные этапы передачи сигнала
Слайд 12
Рецепторная специфичность
Каждая клетка синтезирует определенный набор рецепторов.
Набор рецепторов
клетки изменяется в процессе развития и дифференцировки.
Различные клетки по-разному
отвечают на одинаковые сигналы.
Ацетилхолин вызывает
сокращение скелетной мышцы, воздействуя на н-холинорецепторы
расслабление сердечной мышцы, воздействуя на м-холинорецепторы
Рецепторная специфичность не абсолютна – существуют природные или искусственно синтезированные вещества, способные связываться с рецепторами биомолекулярных сигналов (агонисты и антагонисты)
Слайд 13
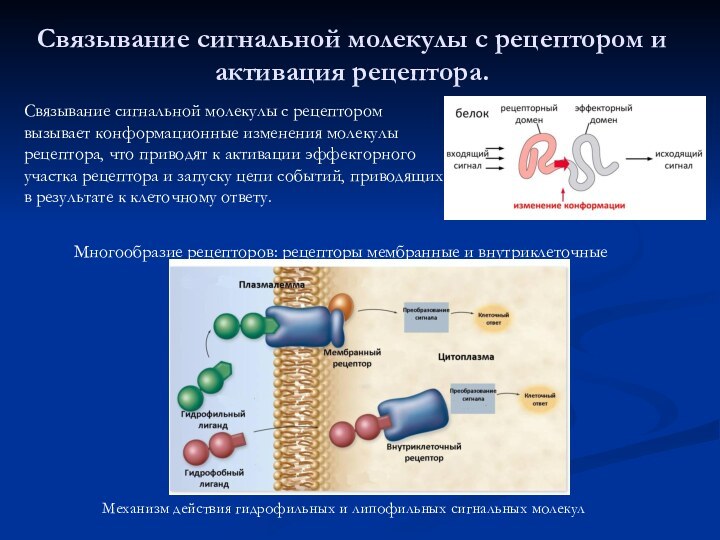
Связывание сигнальной молекулы с рецептором и активация рецептора.
Механизм
действия гидрофильных и липофильных сигнальных молекул
Многообразие рецепторов: рецепторы мембранные
и внутриклеточные
Связывание сигнальной молекулы с рецептором вызывает конформационные изменения молекулы рецептора, что приводят к активации эффекторного участка рецептора и запуску цепи событий, приводящих в результате к клеточному ответу.
Слайд 14
Семейство липофильных рецепторов
Лиганды:
стероиды
тироксин
ретиноиды
свободно проникают через плазмалемму
в цитозоль и активируют рецепторы в цитозоле и ядре.
рецепторы – активируемые факторы транскрипции. Молекула рецептора имеет область связывания лиганда, центральный домен для взаимодействия с ДНК и домен, который активирует транскрипцию.
вызывают продолжительный ответ
Слайд 15
Семейство рецепторов клеточной поверхности
Лиганды:
гидрофильные сигнальные молекулы (нейромедиаторы –
ацетилхолин,норадреналин и т.п., гормоны пептидной природы и др.)
некоторые липофильные
молекулярные сигналы (простагландины)
взаимодействуют с рецепторами на поверхности клетки (интегральными белками плазмалеммы).
вызывают относительно кратковременный ответ
3 основных класса белковых рецепторов клеточной поверхности по механизму передачи сигнала:
каналообразующие
каталитические
рецепторы, сопряженные с G-белками
Слайд 16
Механизмы преобразования сигнала в клетке
Изменение конформации белков
Изменение активности
путем фосфорилирования и дефосфорилирования белков
Преобразование сигнала с участием G-белков
(G-белки
– разновидность GTPаз, конформация и активность которых зависят от того, находятся ли они в ГТФ- или ГДФ-связанном состоянии)
Образование вторичных посредников (вторичные посредники – малые молекулы и ионы, внутриклеточная концентрация которых повышается в ответ на соединение рецептора с сигнальной молекулой)
Преобразование сигнала часто сопровождается его многократным усилением и приводит к интегративному клеточному ответу, который может включать активацию белков, изменение экспрессии генов, изменение проницаемости мембран , запуск процессов деления, дифференцировки, гибели клеткок и другие.
Слайд 17
Лекция 3 - 4
Поток энергии. Молекулярные механизмы преобразования
энергии в клетке.
План лекции
Понятие о потоке энергии.
Метаболизм. Пластический и
энергетический обмены.
Этапы энергетического обмена.
Фотосинтез. Связь фотосинтеза и клеточного дыхания.
Слайд 18
План лекции
Понятие о потоке энергии.
Метаболизм. Пластический и энергетический
обмены.
Этапы энергетического обмена.
Фотосинтез. Связь фотосинтеза и клеточного дыхания.
Слайд 20
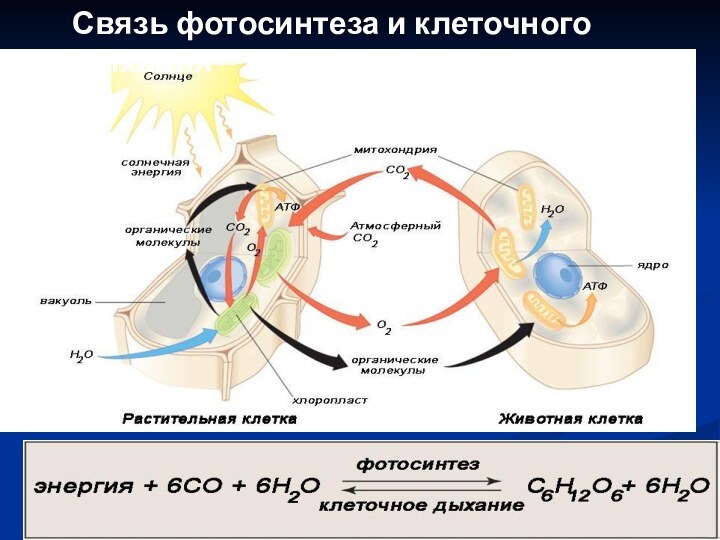
Растения в процессе фотосинтеза преобразуют солнечную энергию в
химическую.
Гетеротрофные организмы потребляют продукты фотосинтеза и расходуют заключенную в
них энергию на процессы жизнедеятельности.
На каждом этапе преобразования энергии часть ее рассевается в виде тепла.
Поток энергии
Слайд 21
Метаболизм – это совокупность пластического и энергетического обменов,
связанных с друг другом и внешней средой.
Пластический обмен (анаболизм)
– это совокупность реакций биосинтеза (ассимиляции).
Энергетический обмен (катаболизм) – это совокупность реакций расщепления (диссимиляции).
Слайд 22
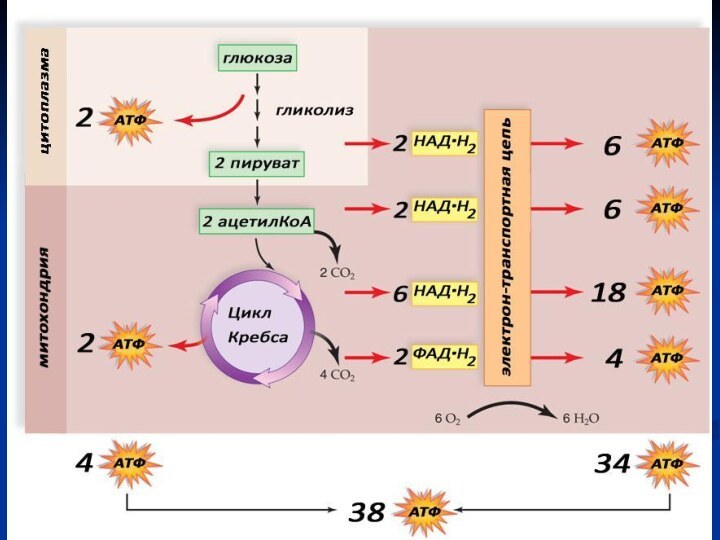
Этапы энергетического обмена
1. Подготовительный
2. Анаэробный (бескислородный, гликолиз)
3. Аэробный
(кислородный)
Слайд 23
Подготовительный этап
Протекает в
пищеварительном тракте человека и животных
лизосомах
Крупные
молекулы расщепляются на мелкие:
крахмал, гликоген → глюкоза
жиры → глицерин
+ жирные кислоты
белки → аминокислоты
нуклеиновые кислоты → нуклеотиды
Слайд 24
Анаэробный этап
Протекает в цитоплазме.
С6Н12О6+2АДФ+2Фн+2НАД→2С3Н4О3+2АТФ+2НАД.Н2
глюкоза
пируват
(пировиноградная
к-та, ПВК)
Энергия, которая выделяется
при расщеплении молекулы глюкозы на 2 молекулы пирувата, запасается
в виде
2 молекул АТФ и
2 молекул НАД.Н2 (восстановленного НАД)
Слайд 25
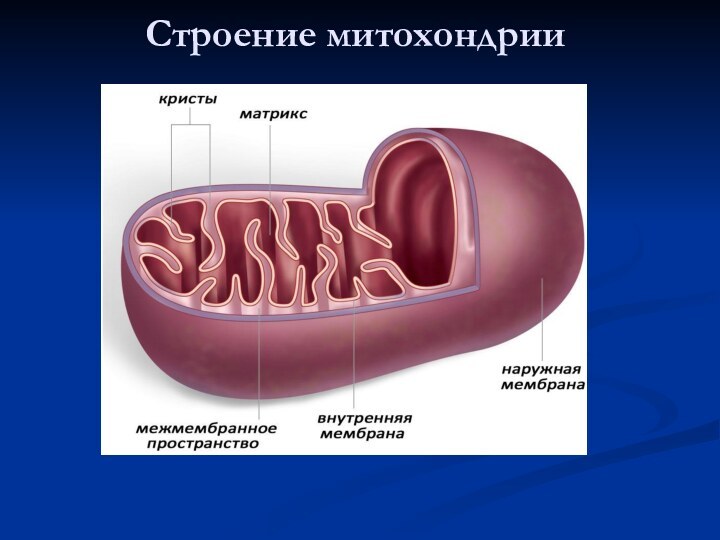
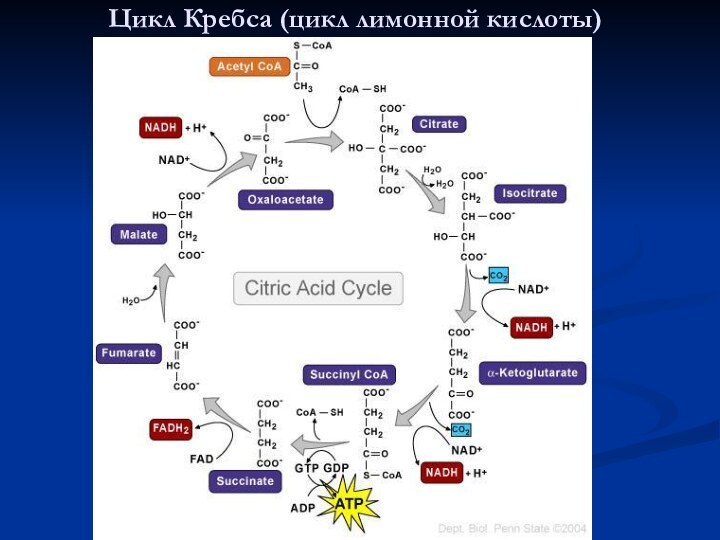
Аэробный этап
Необходим кислород.
Протекает в митохондриях:
в матриксе –
окисление пирувата и
цикл Кребса
на внутренней мембране –
окислительное фосфорилирование
Окислительное фосфорилирование - это синтез АТФ из АДФ и Фн за счет химической энергии, получаемой из пищи в процессе дыхания.
Слайд 27
Цикл Кребса (цикл лимонной кислоты)
Слайд 30
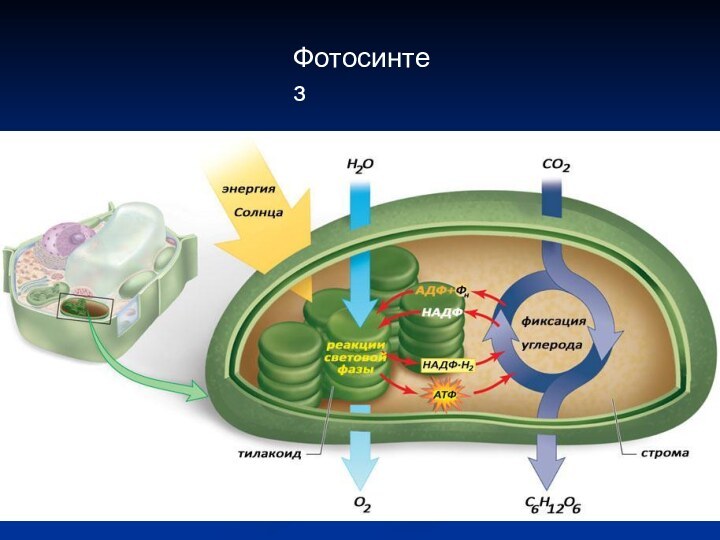
Фотосинтез
Световая фаза
Преобразование энергии Солнца в химическую энергию, которая
запасается в виде молекул АТФ и НАДФ.Н2 .
Фотофосфорилирование – синтез АТФ из АДФ и Фн за счет энергии света.
Темновая фаза
Фиксация атмосферного СО2, синтез органических соединений.
Слайд 31
Связь фотосинтеза и клеточного дыхания
Слайд 32
Гены и геномы (5-10)
План лекции
1. История изучения генов
2. Особенности генома прокариот
3. Регуляция экспрессии генов у
прокариот
4. Особенности генома эукариот
5. Регуляция экспрессии генов у
эукариот
Слайд 33
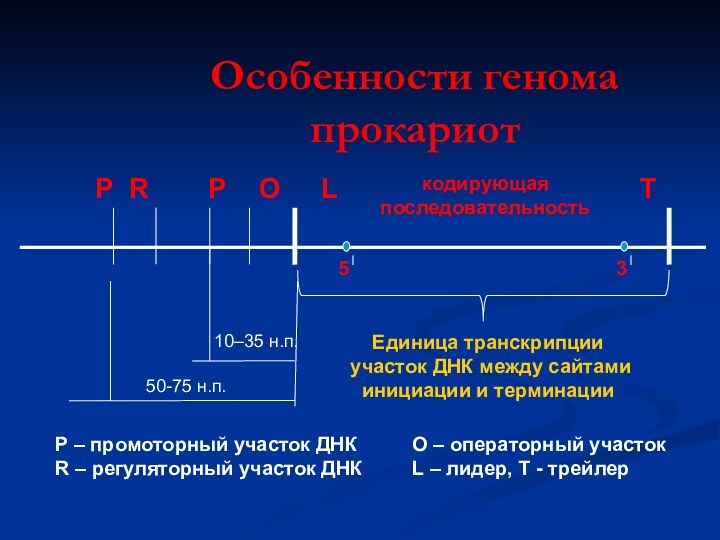
Особенности генома прокариот
Р
R
Р
О
L
5
кодирующая
последовательность
3
T
Единица транскрипции
участок ДНК между
сайтами
инициации и терминации
10–35 н.п.
50-75 н.п.
Р – промоторный участок
ДНК
R – регуляторный участок ДНК
О – операторный участок
L – лидер, Т - трейлер
Слайд 34
Особенности генома прокариот
1. Ген – экспрессируемая единица генома,
включающая единицу транскрипции и регуляторные участки
2. Гены прокариот непрерывны
3.
В процессе транскрипции участвует только один фермент РНК- полимераза
Слайд 35
Особенности генома прокариот
4. У прокариот 3 вида
регуляторных
участков ДНК:
- промоторный
для связи с РНК-
полимеразой, 10-35 н.п.
левее сайта инициации
- терминаторный отвечает за завершение
транскрипции и
высвобождение транскрипта
- операторный сцеплен с промотором
(или перекрывается с ним)
Слайд 36
Особенности генома прокариот
5. Принцип построения генома единый
для всех прокариот
6. Регуляция экспрессии генов
происходит, главным образом,
на этапе начала транскрипции,
но может быть и на других этапах
экспрессии генов
Слайд 37
Регуляция экспрессии генов прокариот
Регуляторные
участки – на расстоянии 50-75 н.п. левее сайта инициации
(иногда еще дальше) Их продукты регуляторные белки: репрессор при негативной, активатор при позитивной регуляции. Регуляторный белок связывается с операторным участком. При негативной регуляции эта связь помеха для РНК-полимеразы– экспрессии нет.
При позитивной регуляции активатор способствует экспрессии генов
Слайд 39
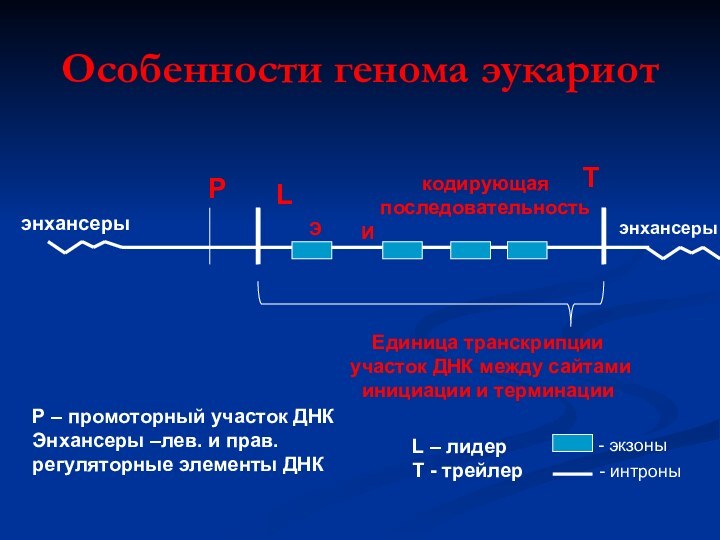
Особенности генома эукариот
Р
L
кодирующая
последовательность
T
Единица транскрипции
участок ДНК между
сайтами
инициации и терминации
Р – промоторный участок ДНК
Энхансеры –лев.
и прав.
регуляторные элементы ДНК
L – лидер
Т - трейлер
энхансеры
энхансеры
Э
И
- экзоны
- интроны
Слайд 40
Особенности генома эукариот
1. Ген – экспрессируемая единица генома,
включающая единицу транскрипции и регуляторные участки
2.Гены прерывистые (информативные участки
– экзоны и неинформативные участки - интроны)
3. Экспрессию генов обеспечивают три вида РНК – полимеразы I II III
Слайд 41
Особенности генома эукариот
4. Регуляторные участки обычно расположены левее
сайта инициации
- промоторный для связи
с РНК-
полимеразой, 100 н.п.
левее сайта инициации
- энхансеры могут быть за сотни
и даже тысячи н.п.
левее сайта инициации
Слайд 42
Особенности генома эукариот
5. Принцип построения генома эукариот –
три уровня
- генный
- хромосомный
- геномный
6. Регуляция экспрессии генов происходит
на
всех этапах экспрессии генов
Слайд 43
Регуляция экспрессии генов эукариот
Слайд 44
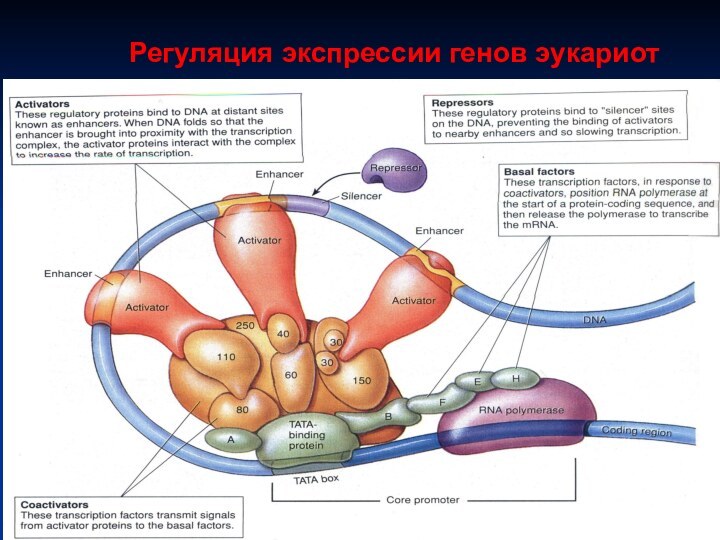
Регуляция экспрессии генов эукариот
Пример регуляция инициации транскрипции
• регуляторные белки
• Тепло, свет, металлы
• Регуляторные белки – факторы транскрипции БФТ
ТАТА фактор (один из них) – связывается с ДНК в области промотора, чтобы РНК-полимераза II узнала свой промотор; т.о.
ТАТА фактор способствует присоединению РНК-полимеразы II к Р
Другие регуляторные белки БФТ: активаторы и репрессоры
Слайд 45
Регуляция экспрессии генов эукариот
Регуляторные последовательности (участки) ДНК:
Промоторы ≈
100 н.п.левее сайта
инициации
Энхансеры от 100 до 20 тыс.
н.п.
слева, реже справа от сайта
инициации. Независимо от
расположения стимулируют
транскрипцию при
связывании с БФТ
Слайд 46
Регуляция экспрессии генов эукариот
• Механизм
Регуляторные белки связываются с
промотором и энхансером (активаторы и репрессоры), Р и Э
участки ДНК сближаются за счет петли ДНК, суммируется действие регуляторных белков.
Механизм настолько универсален, что факторы транскрипции из разных источников взаимозаменяемые
Слайд 47
План лекции
1. Международная программа
«Геном человека»
2. Организация генома человека
3. Понятие о геномике и новый взгляд на эволюцию
4. Классификация генов человека по структуре и функции
Слайд 48
Организация генома человека
Ядро – 95% ДНК Общая протяженность
ДНК ядра1,5 – 2 метра.
Разделена на 23фрагмента
Митохондрии – Около 1000 МТХ в одной
5% ДНК клетке. МТХ ДНК не содержит интронов
Физический размер генома человека
3*109 нуклеотидных пар. Только 3%-5% ДНК кодируют белки,95%-97% ДНК «отдыхает» («мусорная» или «эгоистическая» ДНК???)
«Издержка эволюции, плата за совершенство остальной части генома…» Ф. Крик
Слайд 49
Классификация генов
по структуре
Уники
один или несколько повторов
информация
о структуре
белков. Их мутации наиболее
опасны.
Умеренные десятки, сотни копий
кодируют rРНК, tРНК, iРНК,
гистонов, гены рибосом,
ALu повторы?
Слайд 50
Классификация генов
по структуре
Множественные повторы сотни тысяч, млн. копий
отрезков ДНК. Теломерные и центромерные участки хромосом,
ALu повторы
ПГЭ подвижные (мобильные) генетические
элементы дисперсно разбросаны по
геному (эндогенные вирусы)
Это чужеродные геномы вирусов,
молекулярные останки вирусов
(провирусы), которые когда-то
внедрились в геном и там остались
Слайд 51
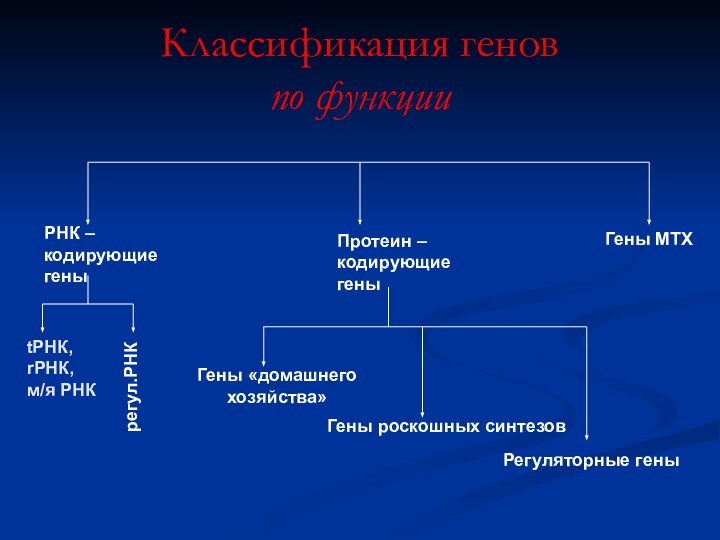
Классификация генов
по функции
РНК – кодирующие гены
Протеин –
кодирующие
гены
Гены
МТХ
tРНК,
rРНК,
м/я РНК
регул.РНК
Гены «домашнего хозяйства»
Гены роскошных синтезов
Регуляторные гены
Слайд 52
План лекции
1. Генетический полиморфизм и
разнообразие геномов
человека
2. Биохимическая уникальность человека
Гены предрасположенности
3.
Новый взгляд на эволюцию Homo sapiens
4. Мутации и болезни
5. Генная диагностика, генетическое тестирование,
генная терапия, клеточная терапия
6. О генетически модифицированных
продуктах
7. Гены и поведение
Слайд 53
Разнообразие геномов человека
Генетическая вариабельность, ограниченная одним видом (Homo
sapiens), получила название генетического полиморфизма – ГП (разнообразие геномов
в популяции)
ГП – наличие небольших отклонений в нуклеотидной последовательности ДНК, которые совместимы с нормальной функцией генома, но приводят к вариациям в структуре белков и т.о. формируют биохимический индивидуум каждой личности (биохимический фингерпринт)
Каждый геном уникален, но несовершенен
Слайд 54
Гены предрасположенности
Гены «внешней среды»
Гены триггеры
Гены рецепторов
Гены предрасположенности
10%-20% всего генома
Слайд 55
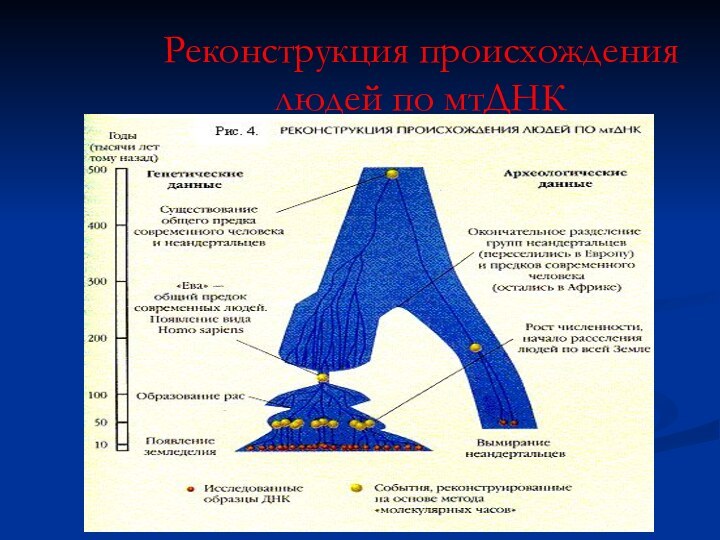
Реконструкция происхождения людей по мтДНК
Слайд 56
Мутации и болезни
Индуцированные
Возникают под действием мутагенных факторов (физические,
химические и биологические)
Классификация
точечные
хромосомные
динамические
геномные
Слайд 57
Биология развития (11-15)
План лекции
1. Периоды онтогенеза человека.
Пренатальное развитие
2. Метод экстракорпорального
оплодотворения (ЭКО)
3. Введение в тератологию.
Классификация тератогенов
Слайд 58
Критические периоды
Критические периоды в развитии зародыша – это
периоды наибольшей ранимости, чувствительности к действию различных повреждающих факторов
(мутагенных, тератогенных, канцерогенных). Эти различные понятия во многом перекликаются
Слайд 59
Классификация тератогенов
Мутагены агенты, вызывающие
мутации (ионизирующая
радиация,
лекарственные
препараты и др.)
Вирусы вирус краснухи (нем. корь),
цитомегаловирус, вирус
простого герпеса
Слайд 60
Классификация тератогенов
Микроорганизмы бактерии – Treponema
и простейшие
простейшиеToxoplasma
Лек.препараты * Veratrum californicum
прир. хим.соед
(алкалоиды)
иск.хим. соед. * хинин,алкоголь
*никотин, кофеин
*пестициды, орг. в-ва сод. ртуть
*ретиноевые к-ты – аналоги вит. А
*талидомид
*различные токсиканты
Слайд 61
План лекции
1. Эпигеномная изменчивость.
2. Молекулярные механизмы развития
зародыша. Метилирование ДНК.
3. Закономерности развития зародыша. Понятие
о морфогенах и гомеозисных генах (хокс-генах)
Слайд 62
Эпигеномная изменчивость.
Процессы, управляющие развертыванием программы развития в клетках
называют эпигенетическими (эпигеномная изменчивость)
Слайд 63
Молекулярные механизмы развития зародыша. Метилирование ДНК.
1. Регуляция экспрессии
генов основана на взаимодействии регуляторных участков ДНК с регуляторными
белками
2. Существует и другой механизм регуляции экспрессии генов
Изменение самого генетического материала химическая модификация ДНК
Слайд 64
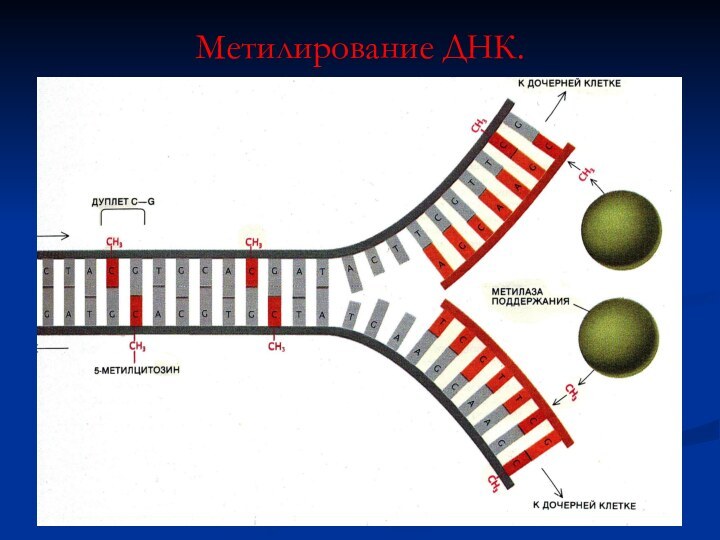
Метилирование ДНК.
Метилирование цитозина – важный элемент генной активности
(СН3- группы присоединяются к С в парах СG)
Установлено, что
экспрессия генов позвоночных коррелирует со степенью метилирования цитозина внутри регуляторных участков и вокруг них
Слайд 66
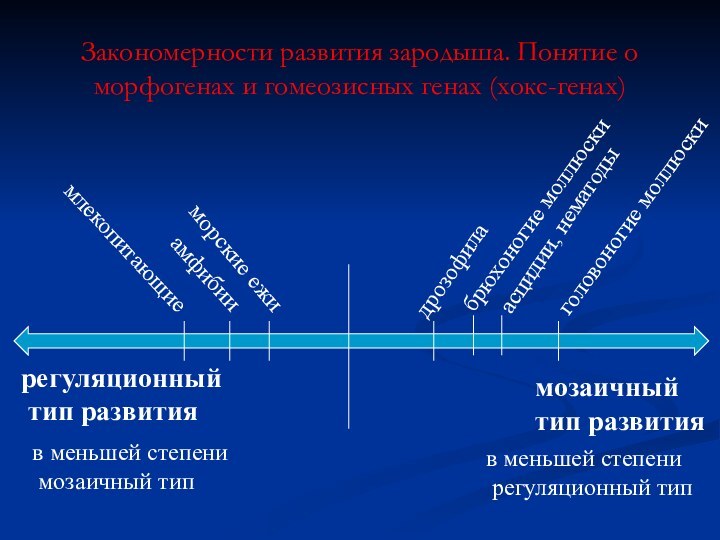
Закономерности развития зародыша. Понятие о морфогенах и гомеозисных
генах (хокс-генах)
Два способа детерминации эмбриональных клеток
Гены – морфогены
Мозаичный тип
развития
Гомеозисные гены
(хокс-гены)
регуляционный
тип развития
Слайд 67
Закономерности развития зародыша. Понятие о морфогенах и гомеозисных
генах (хокс-генах)
мозаичный
тип развития
регуляционный
тип развития
дрозофила
брюхоногие моллюски
асцидии, нематоды
головоногие моллюски
морские ежи
амфибии
млекопитающие
в
меньшей степени
регуляционный тип
в меньшей степени
мозаичный тип
Слайд 68
План лекции
1. Периоды постнатального развития.
2. «О любви
не говорят, о ней все
сказано…?»
3. Проблемы старения организма.
(факторы старения, долгожители,
преждевременное старение)
4. Современные представления о механизмах старения.
Слайд 69
Проблемы старения организма.
Максимальную продолжительность жизни нельзя увеличить, т.к.
это признак вида (90-100 лет)
Теоретически (библия) 500-600 лет.
По данным специалистов, последующее поколение - 125 – 126 лет
Средняя продолжительность жизни в благополучных популяциях (США) более 79 лет, острова в Японии около 100 лет, в СПб у ♂ около 56 лет.
Слайд 70
Проблемы старения организма.
Генетический контроль за продолжительностью жизни очевиден
(мутация 1 гена, синдром преждевременного старения – прогерия) Мутации
редки за 200 лет описано 100 случаев (24 г. – как у 70-летней, симптомы появились в 6 лет. Старение в 10 раз быстрее, остановить пока невозможно)
Слайд 71
Теории старения (механизмы)
Свободно-радикальная теория ( кол-ва свободных
радикалов с возрастом)
Укорачивание теломер при делении клеток (теломеразная теория)
Холестериновая
теория (накопление холестерина с возрастом)
Теория Гормезиса (антистарения )
Слайд 72
План лекции
1. Терапевтическое клонирование
2. Вопросы трансплантации.
Слайд 73
Терапевтическое клонирование и трансплантация
Согласно современным представлениям, регенерация
тканей взрослого организма и их репарация в случае повреждения
осуществляется при непосредственном участии стволовых клеток.
Стволовые клетки – это клетки, обладающие специфичной способностью к самообновлению и дифференцировке в специализированные типы клеток.
Слайд 74
Терапевтическое клонирование и трансплантация
Источники стволовых клеток:
Эмбриональные стволовые
клетки (бластоциста)
Фетальные стволовые клетки (абортивный материал на 9-12 недели
беременности)
Стволовые клетки пуповинной крови
Стволовые клетки взрослого человека (костный мозг, жировая ткань)
Слайд 75
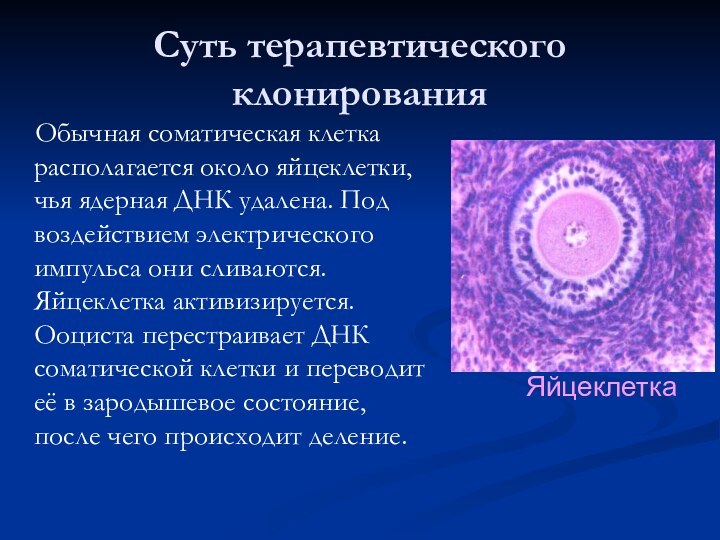
Суть терапевтического клонирования
Обычная соматическая клетка располагается
около яйцеклетки, чья ядерная ДНК удалена. Под воздействием электрического
импульса они сливаются. Яйцеклетка активизируется. Ооциста перестраивает ДНК соматической клетки и переводит её в зародышевое состояние, после чего происходит деление.
Яйцеклетка
Слайд 76
ТРАНСПЛАНТОЛОГИЯ – (греч. Trans – пере-, через; plantare
– сажать, выращивать; -logia - наука) – раздел медицины,
изучающий проблемы трансплантации.
Трансплантация – пересадка, приживление и функционирование клеток, тканей, органов или частей тела.
Трансплантология
Слайд 77
Трансплантология
Органная трансплантация.
Аутотрансплантация – трансплантат того же пациента.
Реплантация
– пересадка органов и тканей на свое же место
(оторванная конечность, скальпированная рана).
Имплантация – клетки и ткани специально пересаживают в другой участок.
Аллотрансплантация – пересадка органов и тканей от другого человека (донора) в т.ч. аллопланты.
Ксенотрансплантация – пересадка органов животных человеку.
Аллопластическая трансплантация – замена частей тела синтетическими материалами- металл, пластмасса
Слайд 78
Литература к лекциям I семестра
1) Мэтт Ридли
«Геном»,М.Эксмо,2008
2)С.Г. Инге-Вечтомов «Генетика с основами селекции»,СПб , изд-воНЛ, 2010.
3)
Горбунова В.Н. «Что вы знаете о своём геноме», СПб «Интермедика» 2001 г.
4) БарановВ.С и др.«Геном человека и гены«предрасположенности»,СПб «Интермедика»,2000.
5) Сингер М. , Берг П. «Гены и геномы»
В 2 тт,М. «Мир» 1998 .
6) Клеточные технологии для регенеративной медицины (под ред. Г.П. Пинаева и др.), Спб.: Изд-во Политехн. ун-та, 2011.
Слайд 79
Вопросы иммунитета
2 лекции
Доц. Косенкова Н.С..
Слайд 80
1798 — Э. Дженнер (Великобритания). Вакцинация.
1881 -
Луи Пастер (Франция). Эффективная иммунизация.
1890 — Э. фон Беринг
(Германия) Антитоксические сыворотки. 1901 г. -Нобелевская премия.
1891 Эрлих –теория гуморального иммунитета.
1883 — И. И. Мечников (Россия)- фагоцитарная теория иммунитета. 1908 —И.И. Мечников и Эрлих - Нобелевская премия.
……….
Ст.преподаватель Федюк К.А. Ст.преподаватель Федюк К.А.
Слайд 81
Система защиты генетической целостности и качественного постоянства организма.
Первая
линия обороны.
Физико-химические барьеры. Физиологические защитные механизмы. Микробный антагонизм.
Иммунная система.
Способность отличать «своё» от « чужого».
Врожденный иммунитет. Иммунные реакции - в отношении любого «чужого» патогена. Приобретенный иммунитет (адаптивный). Специфичность в отношении каждого конкретного возбудителя.
Слайд 82
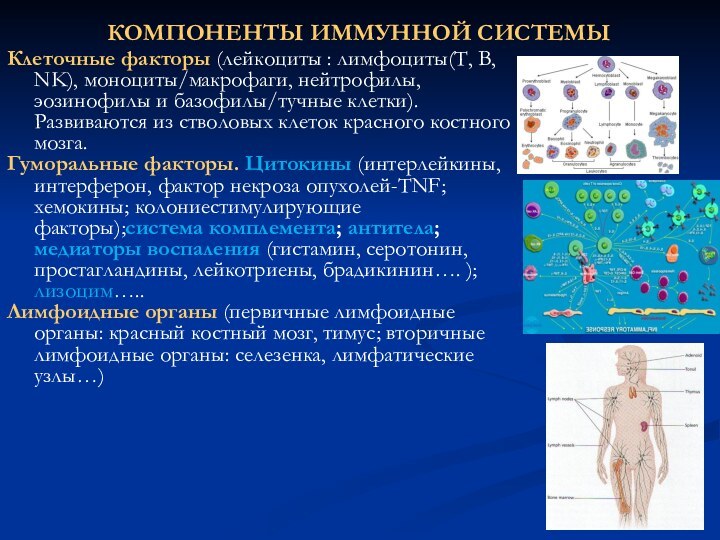
КОМПОНЕНТЫ ИММУННОЙ СИСТЕМЫ
Клеточные факторы (лейкоциты : лимфоциты(Т, В,
NK), моноциты/макрофаги, нейтрофилы, эозинофилы и базофилы/тучные клетки). Развиваются из
стволовых клеток красного костного мозга.
Гуморальные факторы. Цитокины (интерлейкины, интерферон, фактор некроза опухолей-TNF; хемокины; колониестимулирующие факторы);cистема комплемента; антитела; медиаторы воспаления (гистамин, серотонин, простагландины, лейкотриены, брадикинин…. ); лизоцим…..
Лимфоидные органы (первичные лимфоидные органы: красный костный мозг, тимус; вторичные лимфоидные органы: селезенка, лимфатические узлы…)
Слайд 83
Врожденный (Неспецифический иммунитет)
Способность отличать «чужое» с помощью TLR
и др. рецепторов
Клеточные факторы врожденного иммунитета: нейтрофилы и макрофаги(моноциты),
дендритные клетки (основные АПК),базофилы /тучные клетки, эозинофилы, NK клетки (нормальные киллеры).
Основные процессы врожденного иммунитета:
фагоцитоз (нейтрофилы и макрофаги/моноциты- “профессиональные” фагоциты).
цитотоксичность
разрушение чужеродных клеток и ...с помощью гуморальных факторов (комплемент…)
предоставление сигналов
воспаление
Слайд 84
Приобретенный иммунитет (Адаптивный,Специфический )
Клеточный и гуморальный иммунный ответ
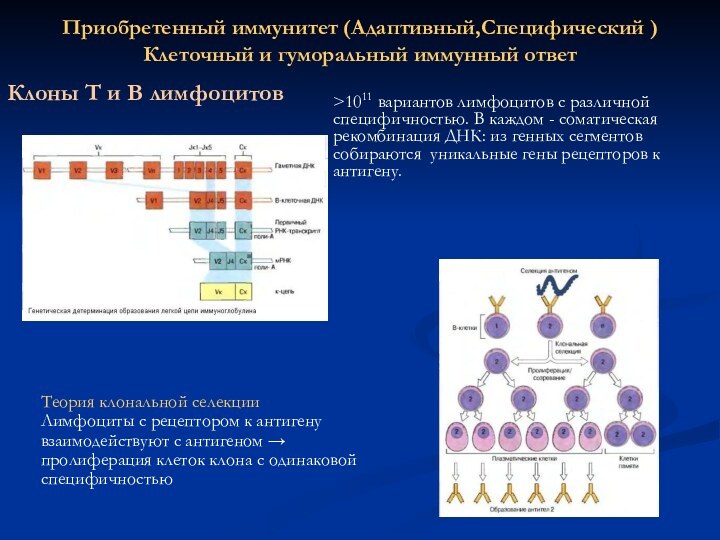
Клоны
Т и В лимфоцитов
>1011 вариантов лимфоцитов с различной
специфичностью. В каждом - соматическая рекомбинация ДНК: из генных сегментов собираются уникальные гены рецепторов к антигену.
Теория клональной селекции
Лимфоциты с рецептором к антигену взаимодействуют с антигеном → пролиферация клеток клона с одинаковой специфичностью
Слайд 85
T лимфоциты. Клеточный специфический иммунитет.
Т-клеточные рецепторы (TCR) распознают
фрагменты антигенных молекул в комплексе с МНС на поверхности
других клеток. (МНС человека = HLA-Human Leucocyte Antigens. 1018 вариантов у вида Н.sapiens)
Специфический клеточный иммунный ответ
Т-хелперы (CD4+) распознают антиген в комплексе с МНСII на поверхности антигенпрезентирующей клетки (АПК). Тh1 стимулируют Тц.
Цитотоксические Т-лимфоциты CD8+ (Тц) распознают антиген в комплексе с МНСI на поверхности любой клетки. Ликвидация (индукция апоптоза, либо некроза) вирусинфицированных клеток, опухолевых. Участвуют в отторжении трансплантата.
Т-регуляторы (Treg CD4+,FOXP3+, CD25+).
Прекращают иммунный ответ после уничтожения
патогена. Могут предотвращать аутоиммунные
реакции…
Т клетки памяти
Слайд 86
В лимфоциты. Гуморальный иммунный ответ
B лимфоциты распознают нерасщепленные
антигены.
Наивные В-лимфоциты. Плазматические B клетки – производят
антитела. В клетки памяти –обеспечивают вторичный иммунный ответ.
Активированные дендритными клеткамиТ-хелперы (Th2) стимулируют клон В лимфоцитов, узнающих тот же антиген.
В лимфоциты превращаются в эффекторные клетки (плазматические) и В клетки памяти.
Секреция антител плазматическими клетками.
Слайд 87
Антитела (иммуноглобулины)
Структурная единица AT — мономер
из двух
идентичных тяжёлых Н-цепей и двух идентичных лёгких L-цепей. Вариабельные
домены легких и тяжелых цепей формируют активный центр антитела – антигенсвязывающий участок. Тяжёлые и лёгкие цепи Ig соединены дисульфидными (-S-S-) связями.
Fab -антиген связывающий фрагмент. Отличается у антител, производимых разными клонами В
Fc- связывание рецепторами клеток, присоединение комплемента... ).
Гибкий участок – шарнир
Слайд 88
Основные функции антител. Эффекторные механизмы гуморального иммунитета
преципитация
агглютинация
Нейтрализация
опсонизация
активация
системы комплемента
активация дегрануляции тучных клеток
антитело-зависимая клеточная цитотоксичность
Основные функции антител.
Эффекторные механизмы гуморального иммунитета
Слайд 89
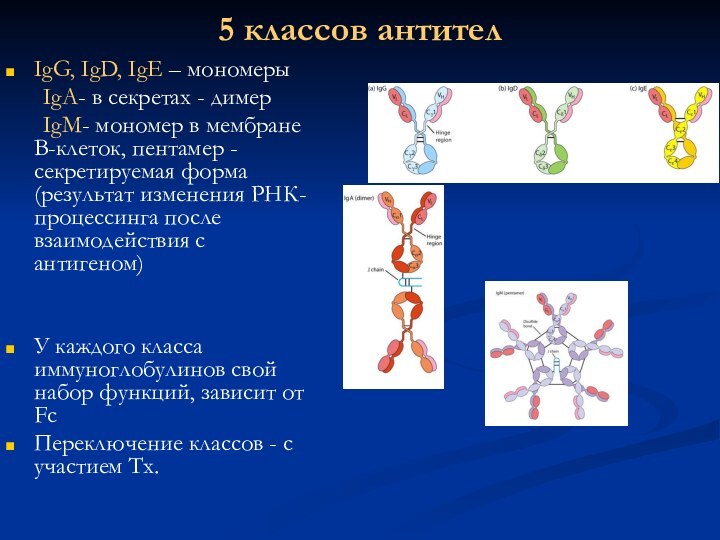
5 классов антител
IgG, IgD, IgE – мономеры
IgA- в
секретах - димер
IgM- мономер в мембране В-клеток, пентамер -секретируемая
форма(результат изменения РНК-процессинга после взаимодействия с антигеном)
У каждого класса иммуноглобулинов свой набор функций, зависит от Fc
Переключение классов - с участием Тх.
Слайд 90
Моноклональные антитела.
Способ создания моноклональных антител Георгом Кёлером и
Цезарем Мильштейном (Нобелевская премия 1984 года). Гибридома (результат слияния
В-лимфоцитов от иммунизированных животных, с клетками миеломы костного мозга) - природная фабрика по производству МКА.
Использование моноклональных антител в медицине
Диагностические антитела (иммуногистохимия,иммуноферментный анализ,
проточная цитофлуориметрия….)
Терапевтические антитела (как
самостоятельные факторы иммунотерапии, а также для доставки лекарственных средств и токсинов).
Область применения – лечение онкологических заболеваний (антитела к опухолевым антигенам, индукция уничтожения опухолевых клеток, доставка токсических веществ); аутоиммунных заболеваний (ревматоидный артрит -МКА Humira, Симпони блокируют TNF); аллергических заболеваний
…
Слайд 91
Геномика и
биоинформатика: роль в медицине
асс. каф. медицинской биологии Старунова З.И.
План
Введение
в геномику (терминология и направления исследований)
Биотехнологические методы и их применение в медицине
Технологии рекомбинантных ДНК
Секвенирование
ПЦР
Проект «Геном человека»
Основные события, связанные с проектом
Главные направления научных исследований
Геномные проекты других организмов
Геномные проекты до и после «Генома человека»
Значение других геномных проектов для медицины
Биоинформатика
Основные направления и история развития
Анализ последовательностей и базы данных
Слайд 92
Влияние геномики на различные области современной медицины
Биотехнология: ДНК-последовательности
как инструменты диагностики, получение терапевтических белков, вакцин, антител и
пр.
Производство биофармацевтических и новых лекарственных препаратов
Генная и клеточная терапия, в том числе моделирование болезней
Диагностика и лечение инфекционных заболеваний
Исследования и лечение генетических заболеваний
Диагностика и лечение рака
Слайд 93
Получение терапевтических белков
С помощью клонирующих векторов можно также

экспрессировать клонированный ген и получать
рекомбинантный белок для терапевтических
целей.
Первые терапевтические белки:
человеческий гормон роста и инсулин.
До 70-х годов данные белки приходилось выделять из трупов (риск заражения патогенами) или животных (не всегда полная идентичность человеческим).
Получение рекомбинантных вакцин
Имея информацию о генах специфических поверхностных белков патогена, можно использовать эти белки в качестве вакцины. Современные вакцины против гепатита В и гриппа представляют собой белковые субъединицы, продуцируемые в дрожжах.
Но такие субъединицы не способны размножаться в вакцинированном организме. Для достижения нужного эффекта используют суррогатные живые вакцины из невирулентных микроорганизмов
Применение методов молекулярной биологии в медицине
Первые успехи в медицине, достигнутые благодаря появлению методов рекомбинантных ДНК, были связанны с определением генов, ответственных за возникновение человеческих болезней, родственных им генов животных и генов патогенных организмов.
Гепатит В
Слайд 94
Главные направления научных
исследований, связанных
с проектом «Геном

человека»:
аннотирование (описание) генома – получение полезной биологической информации, а
именно, поиск генов и их регуляторных элементов. В геноме человека около 30 тыс. генов (на 50% больше чем у нематоды C. elegans в 12 хромосомах). Составление полного каталога человеческих генов может потребовать еще очень много времени.
структурно-функциональное изучение генома - установление функций определенных генов; точные взаимодействия между генами и их белковыми продуктами. Сходство структур не говорит о сходстве функций (структуры гемоглобина и миоглобина схожи, а последовательности идентичны на 17%). Установление связей типа «ген-болезнь» и «ген-ответ» было получено только для 1500 генов.
картирование и секвенирование всего человеческого генома для последующей идентификации всех человеческих генов. В черновом варианте генома, опубликованном в 2001 г. были представлены не более 90% генома, многие данные требовали уточнения.
На остальные 10% приходятся центромерные районы хромосом (гетерохроматин) и ошибки выборки (некоторые последовательности не были секвенированы). В «черновых» вариантах последовательности генома около 50 тыс. пробелов.
Слайд 95
Анализ последовательностей (генов и геномов) различных организмов показал
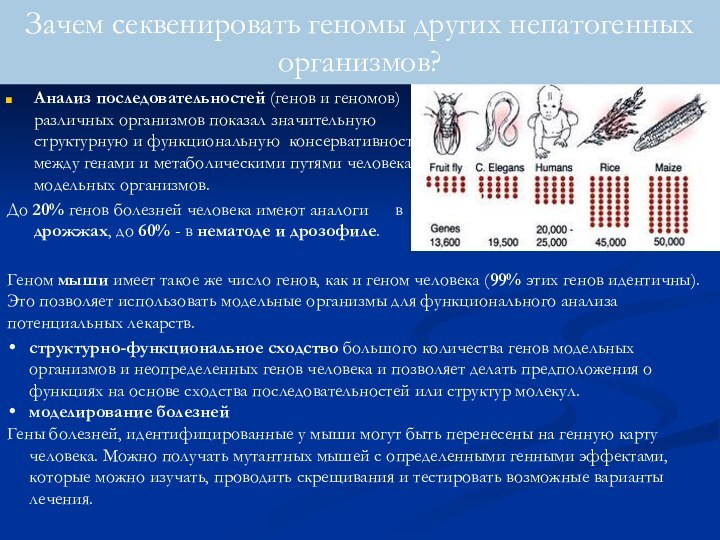
значительную структурную и функциональную консервативность между генами и метаболическими
путями человека и модельных организмов.
До 20% генов болезней человека имеют аналоги в дрожжах, до 60% - в нематоде и дрозофиле.
Зачем секвенировать геномы других непатогенных организмов?
Геном мыши имеет такое же число генов, как и геном человека (99% этих генов идентичны). Это позволяет использовать модельные организмы для функционального анализа потенциальных лекарств.
структурно-функциональное сходство большого количества генов модельных организмов и неопределенных генов человека и позволяет делать предположения о функциях на основе сходства последовательностей или структур молекул.
моделирование болезней
Гены болезней, идентифицированные у мыши могут быть перенесены на генную карту человека. Можно получать мутантных мышей с определенными генными эффектами, которые можно изучать, проводить скрещивания и тестировать возможные варианты лечения.