- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Терминация репликации. Теломеры. Их репликация и роль в функционировании эукариотической клетки
Содержание
- 2. Primary non-transformed cell cultures tend to change
- 3. Cells in Culture (5, 10, 15 and 40 p)
- 4. Терминация репликации у Е.coliПоследовательности, которые обеспечивают терминацию,
- 5. Движение репликативных вилок навстречу друг другу сопровождается
- 6. Окончание репликации ter (terminus) находятся на противоположной
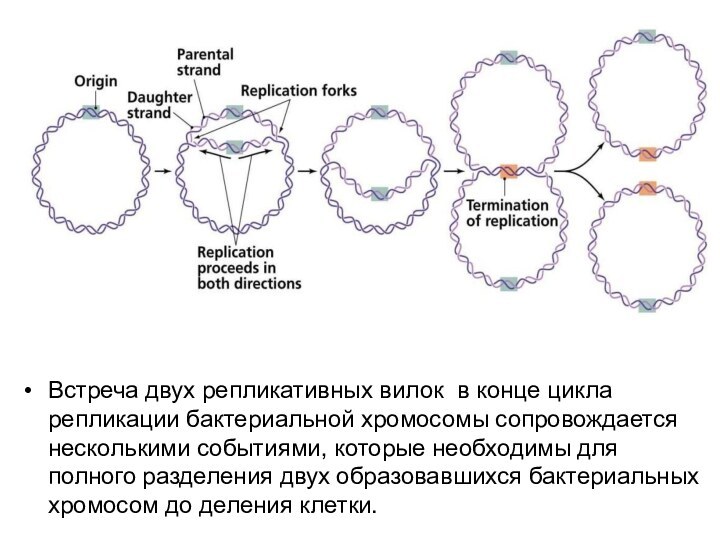
- 7. Встреча двух репликативных вилок в конце цикла репликации
- 10. Герман Джозеф Мёллер ( Hermann Joseph "H. J." Muller; декабрь
- 11. Ба́рбара Мак-Кли́нток ( Barbara McClintock; июнь 1902, Коннектикут сентябрь 1992, Нью-Йорк) Лауреат Нобелевской
- 12. История расшифровки механизма естественного старенияВплоть до конца
- 13. Леонард Хейфлик (Leonard Hayflick 20 мая1928, Филадельфия Медаль Джона Скотта (1914)
- 14. Лимит ХейфликаХейфлик культивировал клетки легкого эмбриона человека
- 16. В результате работ Хейфлика стало ясно, что
- 17. А.М. Оловников
- 18. Недорепликация теломерПрямоугольниками на отстающей нити изображены РНК-праймерыКороткие стрелки – фрагменты Оказаки
- 19. Теория Оловникова А. М. Оловников в
- 20. Теломерная теория старенияСтарение происходит на клеточном уровне:
- 21. Теория недорепликацииПроцесс удвоения отстающей цепи ДНК начинается
- 22. Нобелевская премия 2009 г. в области физиологии
- 24. Фредерик Сенгер Джожеф Галл Frederick Sanger
- 25. Рабочий геном макронуклеуса получается из неактивного микронуклеуса,
- 26. Схема геномных перестроек, происходящих в процессе развития макронуклеуса
- 27. Структура теломерного повтора инфузории окситрихиУ окситрихи повторяющейся
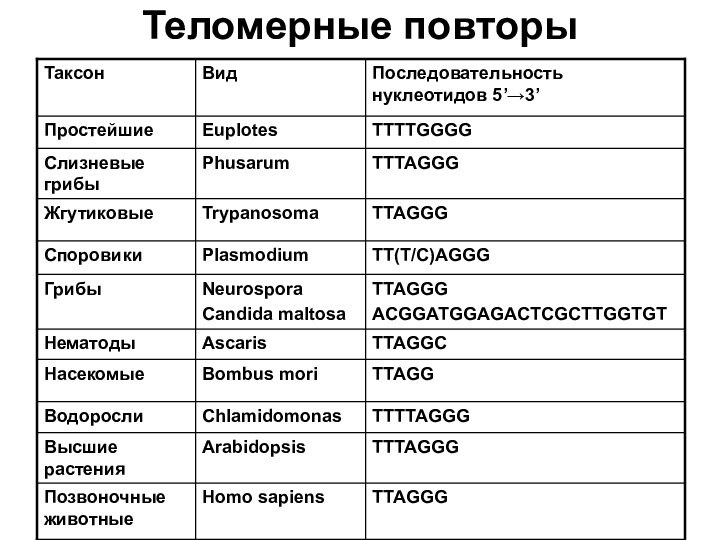
- 28. Теломерные повторы
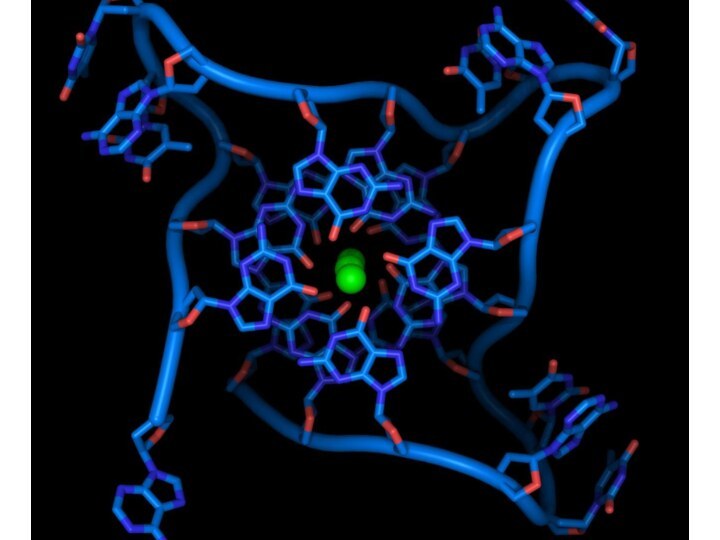
- 29. Схема организации теломерного конца хромосомы у окситрихи1
- 30. Четыре молекулы гуанина на выступающем конце, не
- 31. Четыре молекулы гуанина на выступающем конце, не
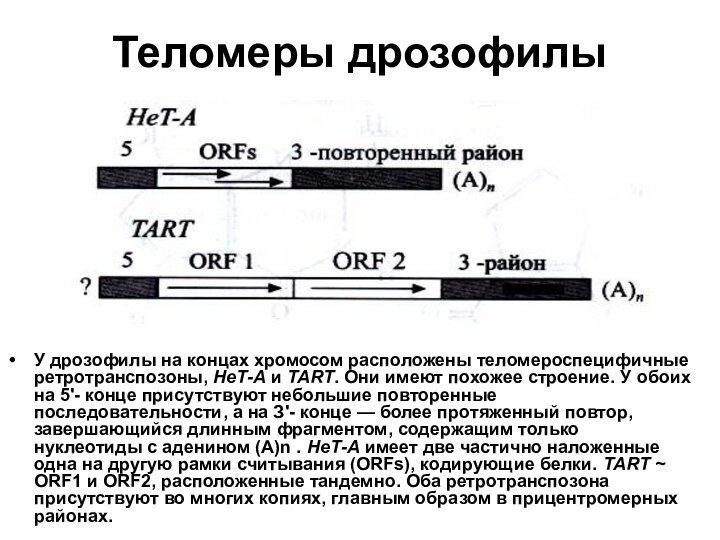
- 33. Теломеры дрозофилыУ дрозофилы на концах хромосом расположены
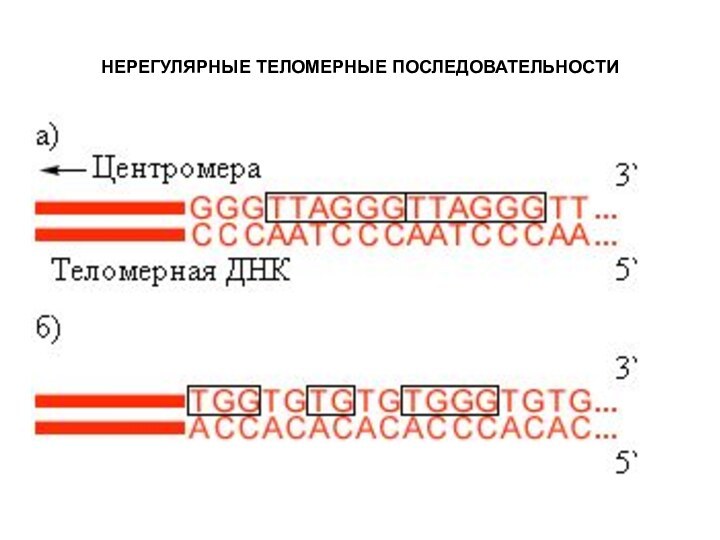
- 34. НЕРЕГУЛЯРНЫЕ ТЕЛОМЕРНЫЕ ПОСЛЕДОВАТЕЛЬНОСТИ
- 35. Строение теломерТеломеры человека содержат от 4 до
- 36. Динамика укорочения теломерв первичной культуре фибробластов, растущих
- 37. Гипотеза изменения взаимодействий ДНК и ядерного матрикса
- 38. Предсказание теломеразы А.М.ОловниковымТермин «теломераза» ввела Э.Блекборн в
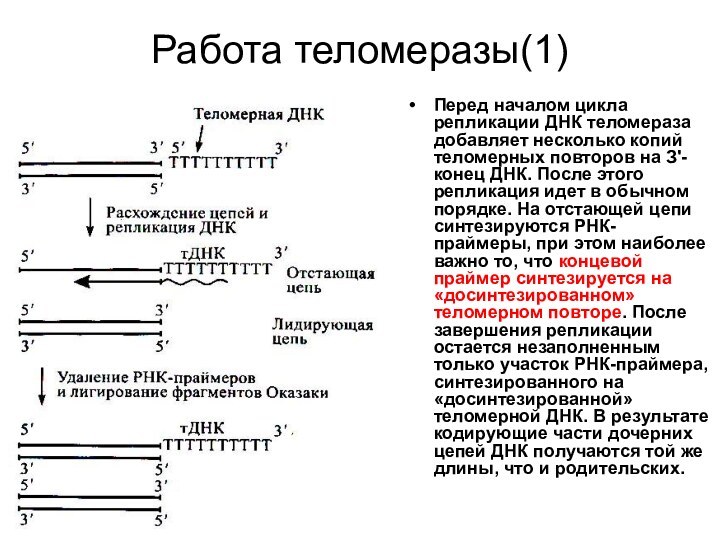
- 39. Работа теломеразы(1)Перед началом цикла репликации ДНК теломераза
- 40. Удлинение теломер теломеразой у тетрахименыТеломераза обладает своей
- 41. ТеломеразаТеломераза - крупный фермент, состоящий из двух
- 42. Роль теломеразной РНК 1. Изменение специфических оснований
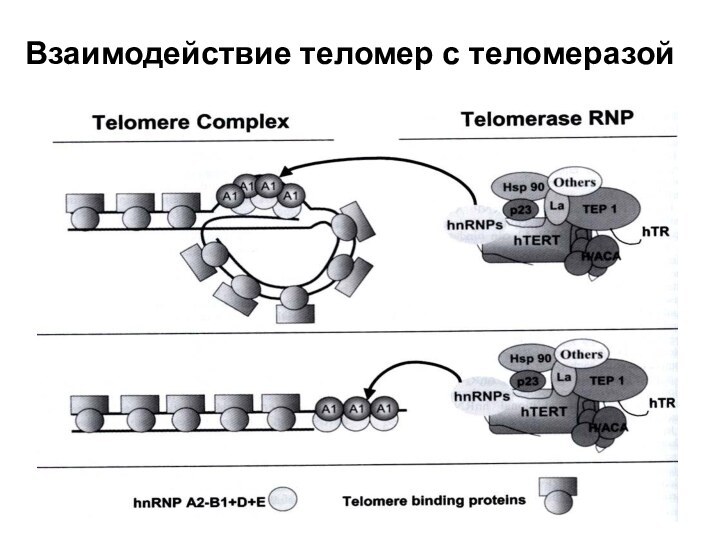
- 43. hnRNP hnRNPs – heterogeneous nuclear ribonucleoproteins –
- 44. Взаимодействие теломер с теломеразой
- 45. Теломеры. СтроениеGomez DEGomez DE, Armando RGGomez DE, Armando RG, Farina
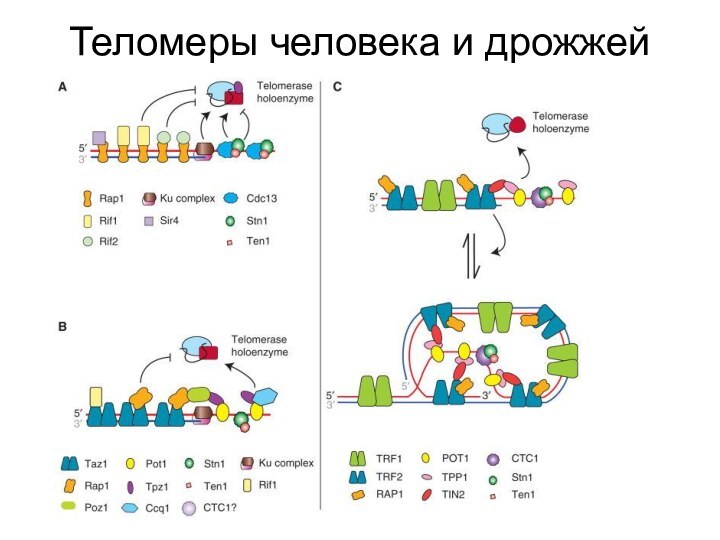
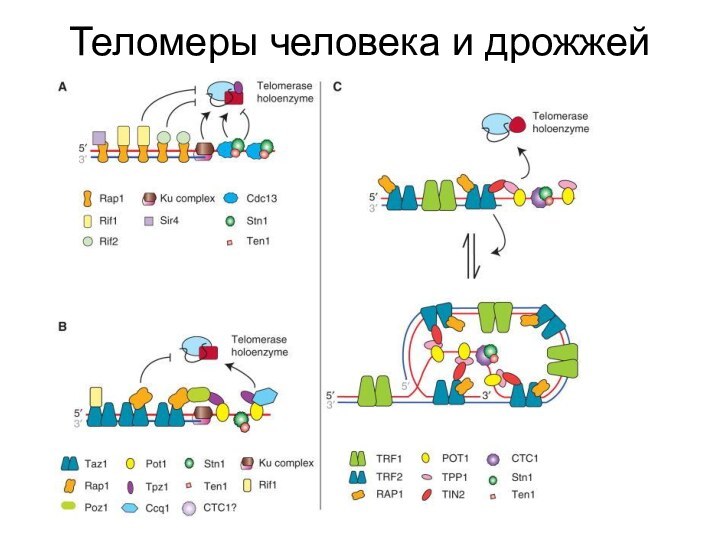
- 46. Теломеры человека и дрожжей
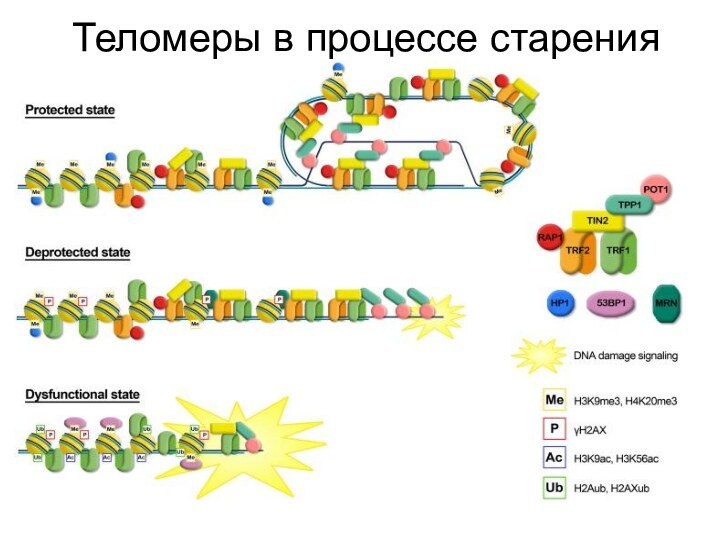
- 47. Теломеры в процессе старения
- 49. Сигнал от открытой теломеры
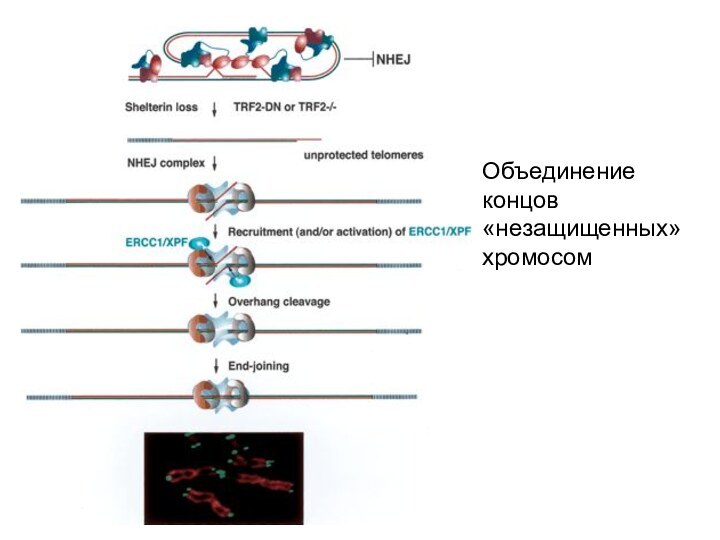
- 50. Объединение концов «незащищенных» хромосом
- 51. Теломеры человека и дрожжей
- 52. Белки, связанные с теломерами1. Поддерживающие пространственную структуру
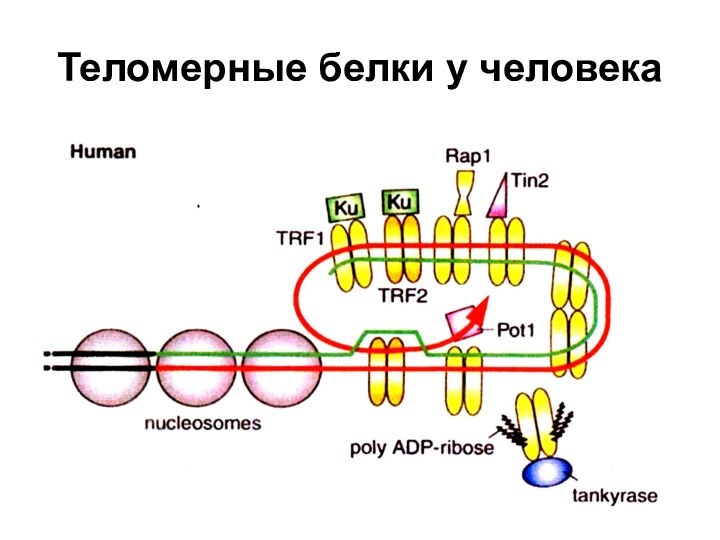
- 53. Теломерные белки у человека
- 54. Белки, связанные с теломерами в клетках человекаТRF1
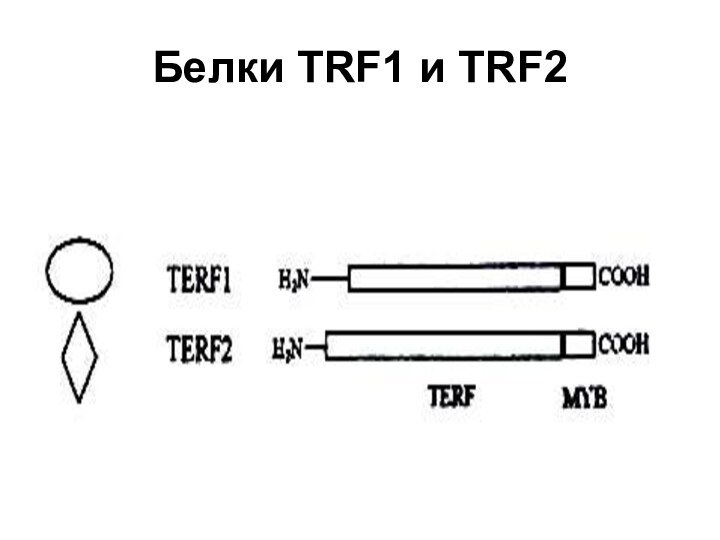
- 55. Белки TRF1 и TRF2
- 56. TRF 1Резкое увеличение концентрации ТRF1 при его
- 57. TRF 1Первое сообщение о белке TRF 1
- 58. ТRF2Белок ТRF2 был найден в конце 90-х
- 59. ТRF2Пороговая для сенильного торможения пролиферации длина теломер
- 60. TNKS и TNKLУ человека и позвоночных животных
- 61. TRF 1ТRF1может быть поли-АDР-рибозилирован, что сопровождается его
- 62. Белки, взаимодействующие с TRF1Теломерный белок TINF2 или
- 63. Теломерная теория старения объясняет многие давно известные,
- 64. Трудности теломерной теории1. Теломеры в клетках мыши
- 65. Возможное объяснение трудностей теломерной теории старения
- 66. Репарационные белки, связанные с теломерамиКu (состоит из
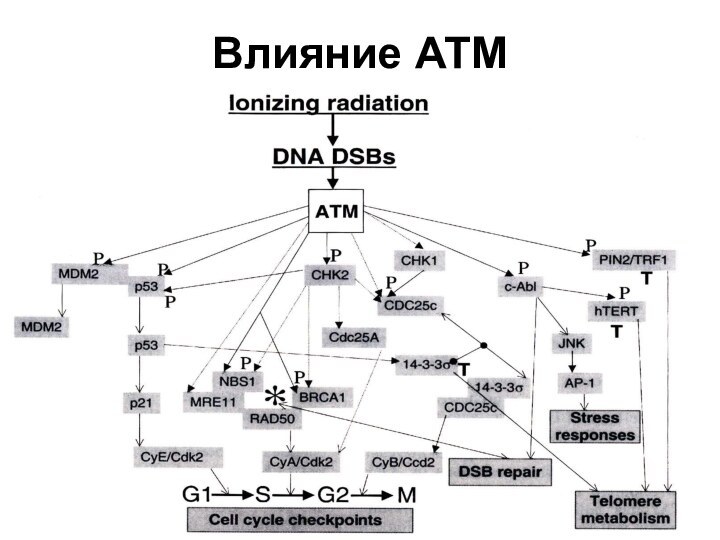
- 67. Влияние АТМ
- 68. Роль белка ретинобластомы в клеточном цикле
- 69. Репликация теломер, зависимая от гомологическоцй рекомбинации при
- 70. Белки, вовлеченные в процесс альтернативного удлинения теломер
- 71. Белки, вовлеченные в процесс альтернативного удлинения теломер
- 72. Белки, вовлеченные в процесс альтернативного удлинения теломер
- 73. Белки, связанные с теломерами1. Поддерживающие пространственную структуру
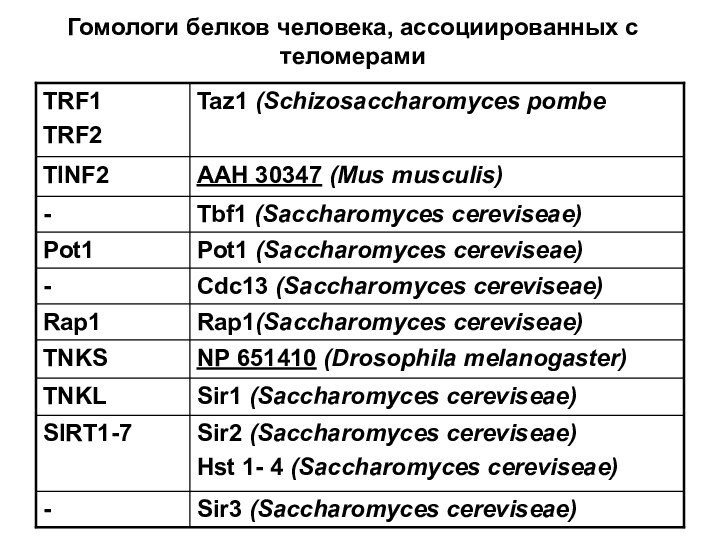
- 74. Гомологи белков человека, ассоциированных с теломерами
- 75. Гомологи белков человека, ассоциированных с теломерами (2)
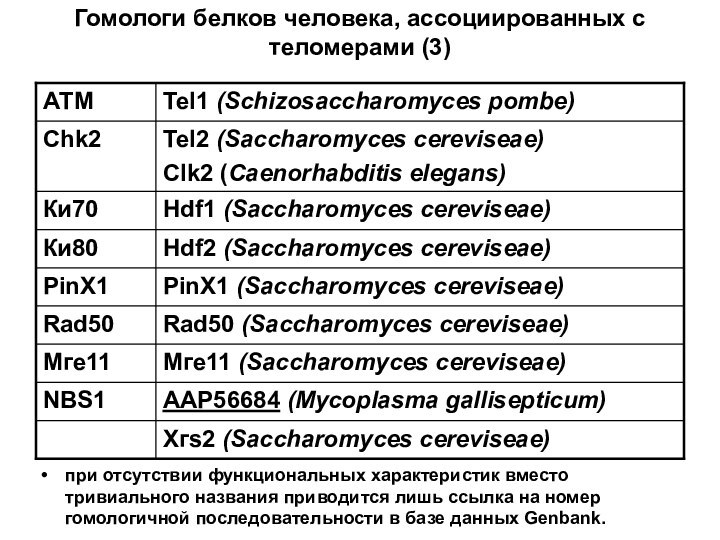
- 76. Гомологи белков человека, ассоциированных с теломерами (3)при
- 77. SIRT-белки (сиртуины)Известно, что в клетках каждой ткани
- 80. Недорепарация теломертеломерная ДНК повреждается в среднем сильней,
- 81. Причины недорепарации1. Репарация концов ДНК может встречать
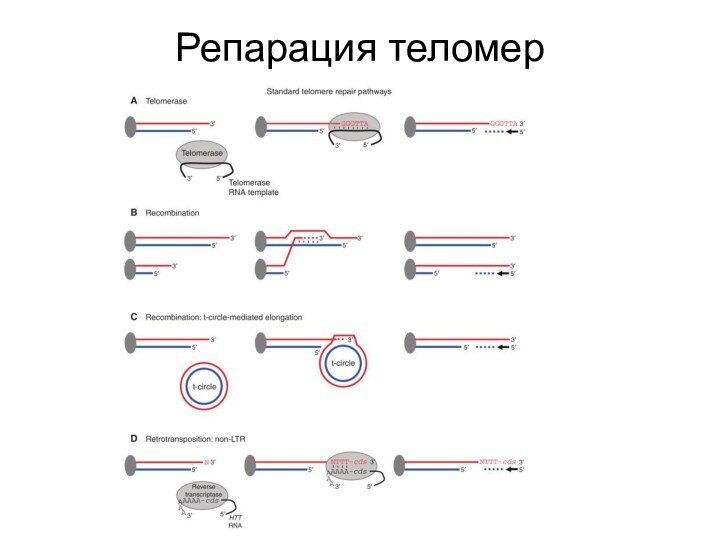
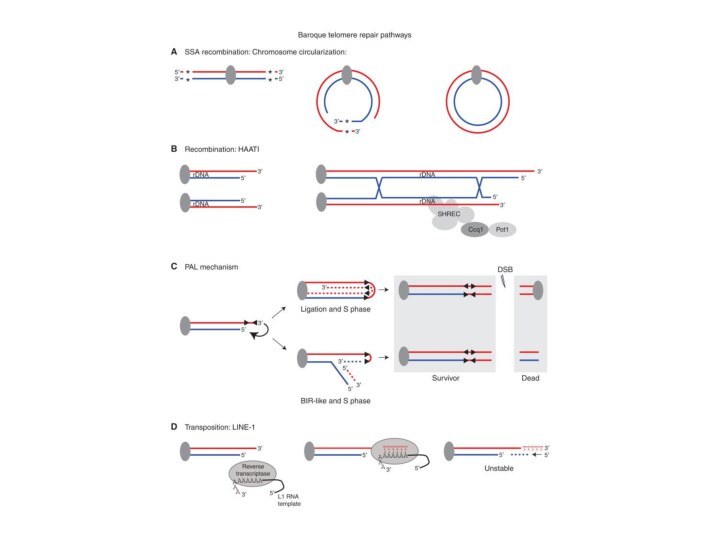
- 82. Репарация теломер
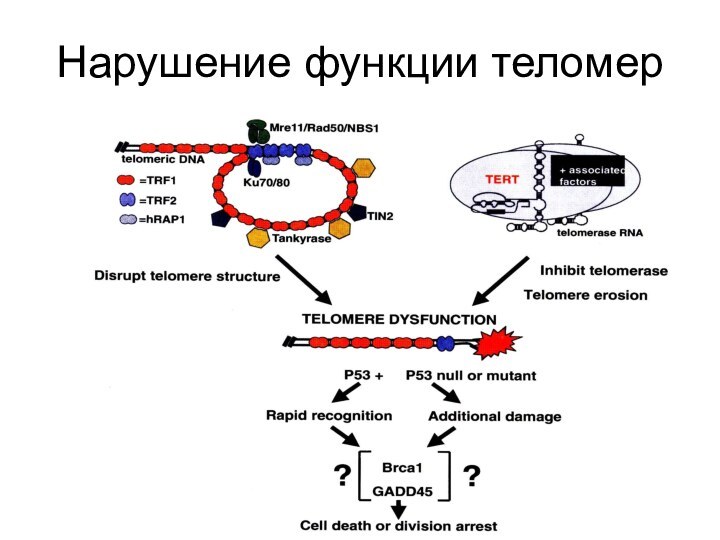
- 85. Нарушение функции теломер
- 86. Скачать презентацию
- 87. Похожие презентации
Primary non-transformed cell cultures tend to change with every passage. Population doubling time increases, cell morphology alteres, larger rotund cells appear, which are regarded as older, in comparison with smaller oblong ones (Мikhelson, 1984; Lorenzini et



















































Слайд 4
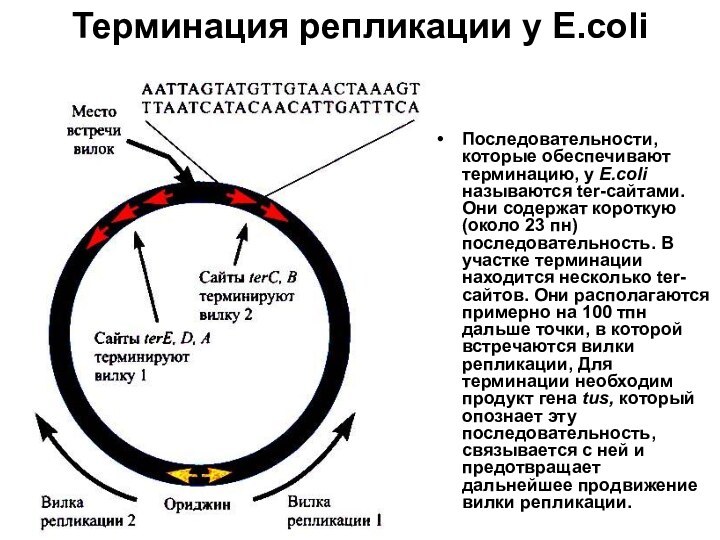
Терминация репликации у Е.coli
Последовательности, которые обеспечивают терминацию, у
Е.coli называются ter-сайтами. Они содержат короткую (около 23 пн)
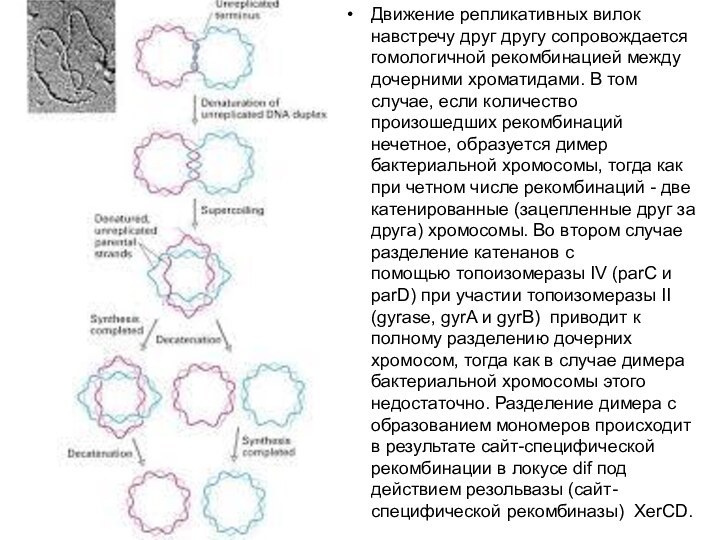
последовательность. В участке терминации находится несколько ter-сайтов. Они располагаются примерно на 100 тпн дальше точки, в которой встречаются вилки репликации, Для терминации необходим продукт гена tus, который опознает эту последовательность, связывается с ней и предотвращает дальнейшее продвижение вилки репликации.Слайд 5 Движение репликативных вилок навстречу друг другу сопровождается гомологичной
рекомбинацией между дочерними хроматидами. В том случае, если количество
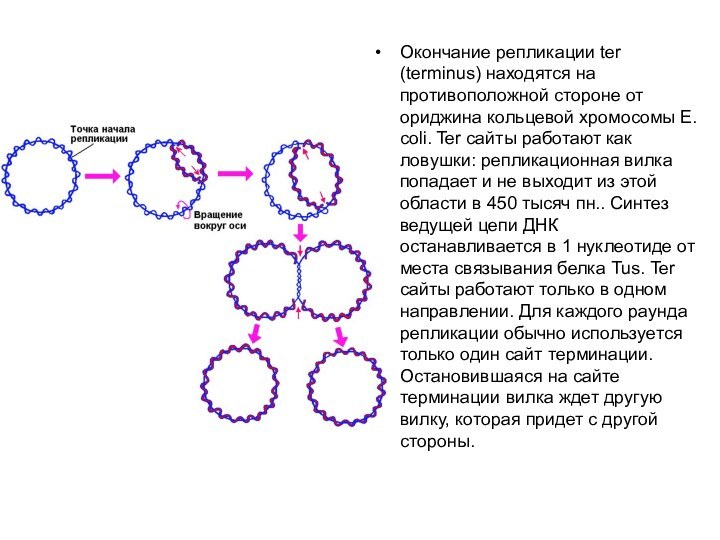
произошедших рекомбинаций нечетное, образуется димер бактериальной хромосомы, тогда как при четном числе рекомбинаций - две катенированные (зацепленные друг за друга) хромосомы. Во втором случае разделение катенанов с помощью топоизомеразы IV (parC и parD) при участии топоизомеразы II (gyrase, gyrA и gyrB) приводит к полному разделению дочерних хромосом, тогда как в случае димера бактериальной хромосомы этого недостаточно. Разделение димера с образованием мономеров происходит в результате сайт-специфической рекомбинации в локусе dif под действием резольвазы (сайт-специфической рекомбиназы) XerCD.Слайд 6 Окончание репликации ter (terminus) находятся на противоположной стороне
от ориджина кольцевой хромосомы E. coli. Ter сайты работают
как ловушки: репликационная вилка попадает и не выходит из этой области в 450 тысяч пн.. Синтез ведущей цепи ДНК останавливается в 1 нуклеотиде от места связывания белка Tus. Ter сайты работают только в одном направлении. Для каждого раунда репликации обычно используется только один сайт терминации. Остановившаяся на сайте терминации вилка ждет другую вилку, которая придет с другой стороны.Слайд 7 Встреча двух репликативных вилок в конце цикла репликации бактериальной
хромосомы сопровождается несколькими событиями, которые необходимы для полного разделения
двух образовавшихся бактериальных хромосом до деления клетки.Слайд 10 Герман Джозеф Мёллер ( Hermann Joseph "H. J." Muller; декабрь 1890, Нью-Йорк — апрель
1967, Индианаполис)
Американский генетик, ученик Томаса Ханта Моргана, лауреат Нобелевской премии по
физиологии и медицине («За открытие появления мутаций под влиянием рентгеновского облучения» 1946). Наиболее известен своими работами в области мутагенного действия рентгеновских лучей и радикальными политическими взглядами.Член-корреспондент АН ССРР (1933—1949, с 1990). 24 сентября 1948 г. направил в адрес АН СССР письмо с отказом от звания в знак протеста против преследования генетики в СССР; в январе 1949 г. был лишён звания; в 1990 году звание восстановлено
В 1955 году Мёллер был в числе одиннадцати деятелей науки, подписавших Манифест Рассела-Эйнштейна.
двоюродный дядя Урсулы Ле Гуин
Слайд 11
Ба́рбара Мак-Кли́нток ( Barbara McClintock; июнь 1902, Коннектикут сентябрь 1992, Нью-Йорк)
Лауреат Нобелевской премии
по физиологии и медицине «За открытие мобильных генетических элементов»
1983г. Мак-Клинток занималась главным образом исследованием цитогенетикикукурузы. В 1951 г. Мак-Клинток открыла транспозоны. Её работы получили признание в 1970 гг., когда был изучен механизм регуляции генов, открытой Мак-Клинток в 1940-е годы«Спустя годы я обнаружила, что сложно, если не невозможно, донести до сознания другого человека сущность его предположений, в то время как я пришла к ним опытным путём. Это стало мне мучительно очевидно в 1950-х годах, когда я пыталась убедить генетиков в том, что работа генов может и должна контролироваться. Сейчас так же тяжело осознавать предубеждённость многих насчёт природы контролирующих элементов кукурузы и их работы. Приходится выжидать, пока сменится общее представление.»
Слайд 12
История расшифровки механизма естественного старения
Вплоть до конца прошлого
века механизмы старения оставались совершенно непонятными. Несмотря на это,
само старение шло безотказно: для человека – редко чуть более 100 лет, и точка.Если за последние полтора века средняя продолжительность жизни человека выросла с 35-40 лет (во времена Пушкина) до более 80 лет в наиболее благополучных странах – Норвегии и Японии в наши дни, то максимальная (видовая для человека) продолжительность жизни какая была у древних египтян в III тысячелетии до н.э., такая и сейчас – порядка 100 лет.
Это значит, что существуют некие биологические законы, не позволяющие человеку жить дольше.
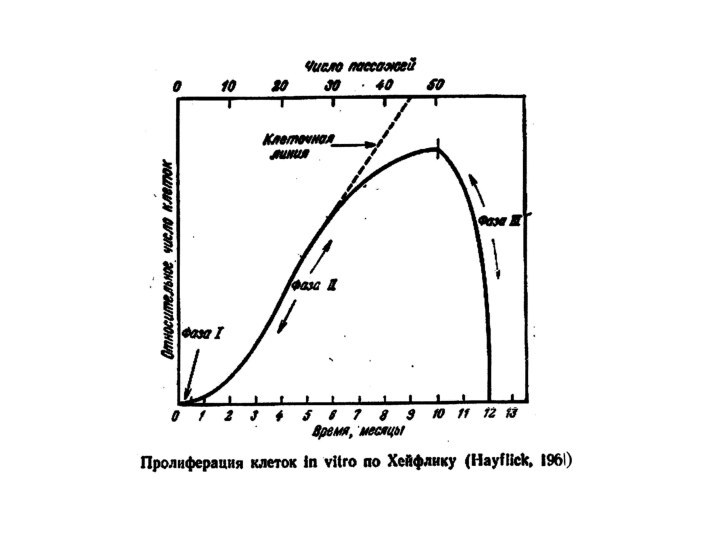
Было предложено более 100 теорий и гипотез о механизмах старения – все неверные. Первым открытием, сдвинувшим наши представления о механизмах старения с мертвой точки, было открытие Леонарда Хейфлика: в 1961 г. он обнаружил, что клетки человека не могут делиться бесконечно: проходят in vitro ≈ 50 удвоений и прекращают пролиферацию.
Слайд 14
Лимит Хейфлика
Хейфлик культивировал клетки легкого эмбриона человека и
обнаружил, что нормальные диплоидные клетки в культуре неспособны поделиться
более 50 раз, после чего пролиферация останавливается.Эта цифра (50 удвоений) получила название лимита Хейфлика для человека.
Позже выяснилось, что лимит Хейфлика для клеток других видов животных хорошо коррелирует с их максимальной (видовой) продолжительностью жизни.
Слайд 16 В результате работ Хейфлика стало ясно, что причина
ограниченной способности клеток к пролиферации лежит в самих клетках,
а не в условиях их культивирования: клетка каким-то образом «знает», сколько раз она уже поделилась.Т.е., при каждом делении в клетке что-то меняется: либо закономерно накапливается, либо безвозвратно теряется.
На вопрос, что же это такое, ответил в 1971 г., через 10 лет после Хейфлика и за 16 лет до Блекборн, российский (тогда – советский) исследователь Алексей Матвеевич ОЛОВНИКОВ
Слайд 18
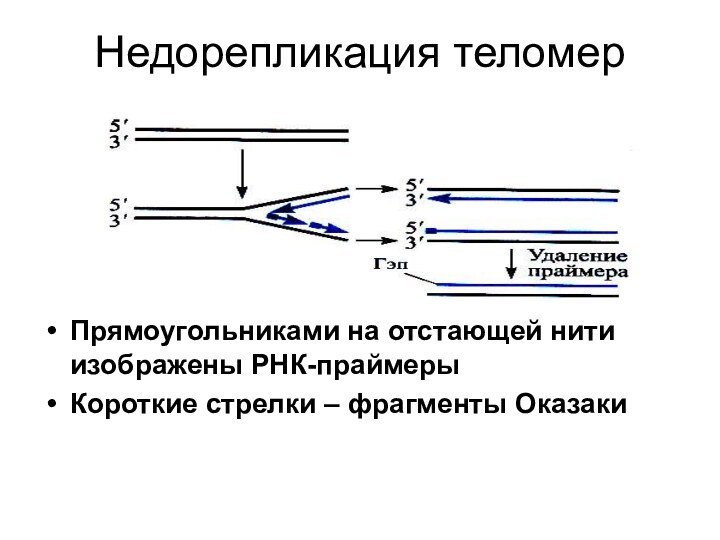
Недорепликация теломер
Прямоугольниками на отстающей нити изображены РНК-праймеры
Короткие стрелки
– фрагменты Оказаки
Слайд 19
Теория Оловникова
А. М. Оловников в 1971
г. предложил формулу для расчета продолжительности жизни любого клона
клеток in vitro:Т = k(lt/lm – n)
где Т — срок предстоящей жизни клеток; k — коэффициент корреляции между срокам жизни клона клеток и числом репликаций ДНК; lt — длина теломерного участка; lm — длина фрагмента ДНК, утрачиваемого в ходе каждого цикла репликации; n — число уже прошедших репликаций.
Слайд 20
Теломерная теория старения
Старение происходит на клеточном уровне: при
каждой репликации укорачиваются теломеры хромосом, т.е. дочерняя ДНК оказывается
короче материнской. После определенного числа делений, при минимальной длине теломер клетка теряет возможность делиться (лимит Хейфлика). Остановка деления клеток в тканях ведет к старению организма.Это четко подтверждается на клетках больных преждевременным старением
Слайд 21
Теория недорепликации
Процесс удвоения отстающей цепи ДНК начинается с
синтеза коротких РНК-праймеров, или затравок, с З'-концов которых синтезируются
отрезки ДНК — фрагменты Оказаки. Затем РНК-праймер удаляется, образовавшиеся бреши (гэпы) заполняются фрагментами ДНК которые синтезируются, используя в качестве праймеров З'-концы ранее синтезированных фрагментов Оказаки. Поскольку для синтеза крайнего участка нет такого фрагмента Оказаки - праймера, вновь образованная цепь оказывается на 8-12 нуклеотидов (длина РНК-праймера) короче исходной. В результате после каждого цикла репликации молекула ДНК должна становиться все короче: одна из четырех цепей укоротилась на 8 -12 пн
Слайд 22
Нобелевская премия 2009 г.
в области физиологии и медицины
Ученые
из США Элайзабет Блекборн, Керол Грейдер и Джек Шостак
удостоены Нобелевской премии 2009 г. «за открытие теломерной защиты хромосом и фермента теломеразы». Эти работы публиковались начиная с 1987 г.Слайд 24 Фредерик Сенгер Джожеф Галл Frederick Sanger
Joseph Gall август 1918 – ноябрь 2013
апрель 1928две Нобелевские премии по химии — в 1958 (строение инсулина) и 1980 (совместно с У.Гилбертом и П.Бергом) – за секвенирование
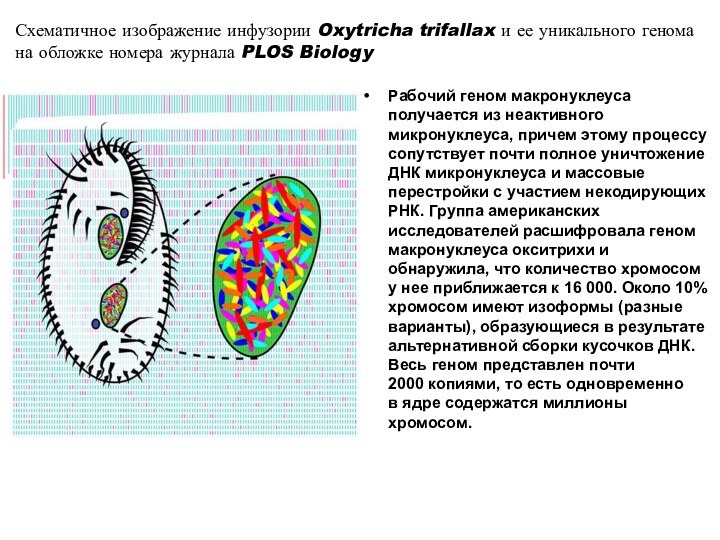
Слайд 25 Рабочий геном макронуклеуса получается из неактивного микронуклеуса, причем
этому процессу сопутствует почти полное уничтожение ДНК микронуклеуса и
массовые перестройки с участием некодирующих РНК. Группа американских исследователей расшифровала геном макронуклеуса окситрихи и обнаружила, что количество хромосом у нее приближается к 16 000. Около 10% хромосом имеют изоформы (разные варианты), образующиеся в результате альтернативной сборки кусочков ДНК. Весь геном представлен почти 2000 копиями, то есть одновременно в ядре содержатся миллионы хромосом.Схематичное изображение инфузории Oxytricha trifallax и ее уникального генома на обложке номера журнала PLOS Biology
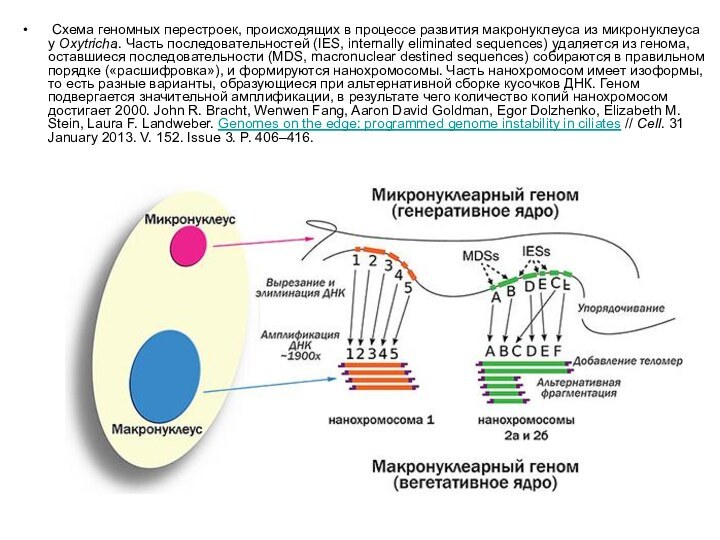
Слайд 26 Схема геномных перестроек, происходящих в процессе развития макронуклеуса из
микронуклеуса у Oxytricha. Часть последовательностей (IES, internally eliminated sequences) удаляется
из генома, оставшиеся последовательности (MDS, macronuclear destined sequences) собираются в правильном порядке («расшифровка»), и формируются нанохромосомы. Часть нанохромосом имеет изоформы, то есть разные варианты, образующиеся при альтернативной сборке кусочков ДНК. Геном подвергается значительной амплификации, в результате чего количество копий нанохромосом достигает 2000. John R. Bracht, Wenwen Fang, Aaron David Goldman, Egor Dolzhenko, Elizabeth M. Stein, Laura F. Landweber. Genomes on the edge: programmed genome instability in ciliates // Cell. 31 January 2013. V. 152. Issue 3. P. 406–416.
Слайд 27
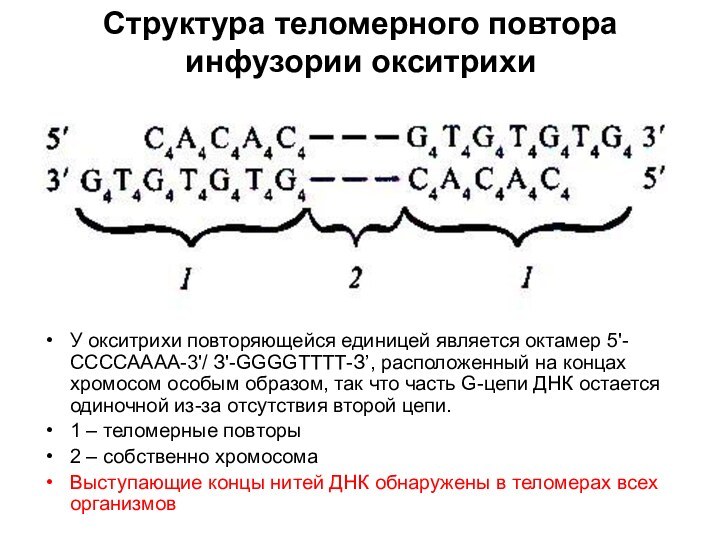
Структура теломерного повтора инфузории окситрихи
У окситрихи повторяющейся единицей
является октамер 5'-ССССАААА-3'/ З'-GGGGТТТТ-З’, расположенный на концах хромосом особым
образом, так что часть G-цепи ДНК остается одиночной из-за отсутствия второй цепи.1 – теломерные повторы
2 – собственно хромосома
Выступающие концы нитей ДНК обнаружены в теломерах всех организмов
Слайд 29
Схема организации теломерного конца хромосомы
у окситрихи
1 – повтор
из гуаниновых нуклеотидов,
2 – теломерный концевой повтор (TR),
3 – последовательности, ассоциированные с теломерой (TAS),
4 – собственно хромосома,
5 - центромера
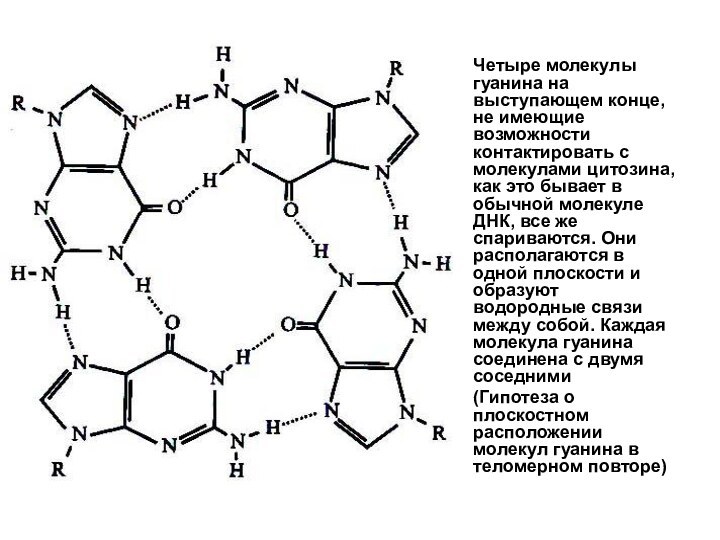
Слайд 30 Четыре молекулы гуанина на выступающем конце, не имеющие
возможности контактировать с молекулами цитозина, как это бывает в
обычной молекуле ДНК, все же спариваются. Они располагаются в одной плоскости и образуют водородные связи между собой. Каждая молекула гуанина соединена с двумя соседними(Гипотеза о плоскостном расположении молекул гуанина в теломерном повторе)
Слайд 31 Четыре молекулы гуанина на выступающем конце, не имеющие
возможности контактировать с молекулами цитозина, как это бывает в
обычной молекуле ДНК, все же спариваются. Они располагаются в одной плоскости и образуют водородные связи между собой. Каждая молекула гуанина соединена с двумя соседними(Гипотеза о плоскостном расположении молекул гуанина в теломерном повторе)
Слайд 33
Теломеры дрозофилы
У дрозофилы на концах хромосом расположены теломероспецифичные
ретротранспозоны, НеТ-А и ТАRТ. Они имеют похожее строение. У
обоих на 5'- конце присутствуют небольшие повторенные последовательности, а на З'- конце — более протяженный повтор, завершающийся длинным фрагментом, содержащим только нуклеотиды с аденином (А)n . НеТ-А имеет две частично наложенные одна на другую рамки считывания (ОRFs), кодирующие белки. ТАRТ ~ ОRF1 и ОRF2, расположенные тандемно. Оба ретротранспозона присутствуют во многих копиях, главным образом в прицентромерных районах.
Слайд 35
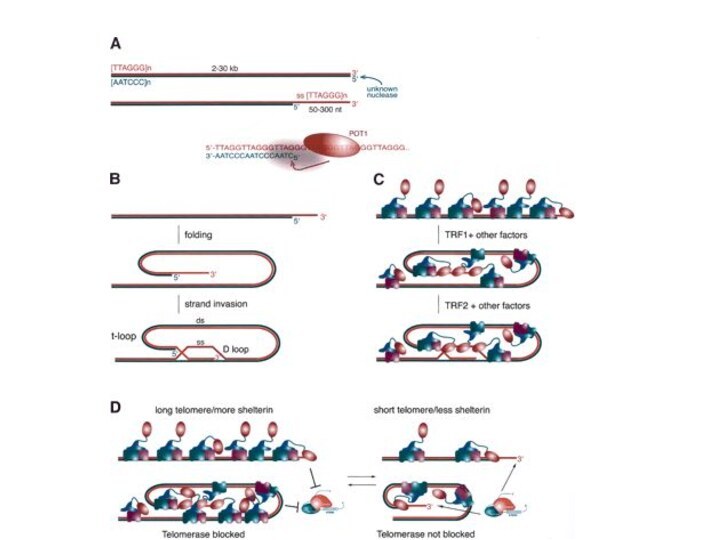
Строение теломер
Теломеры человека содержат от 4 до 15
тысяч пар оснований и состоят из повторяющихся последовательностей TTAGGG;
теломера заканчивается однонитевым TTAGGG-3’ нависающим концом, завернутым назад на себя, в структуру, называемую «t-петлей»Теломеры генетически пусты – не кодируют никаких белков. Поэтому укорочение теломер до определенного минимума никак не влияет на жизнь клетки. Но достижение этого минимума длины теломеры приводит к ее разрушению и «декепированию» (обезглавливанию) хромосомы и гибели клетки (Э.Блекборн,2001)
Впервые теломеры были обозначены как отдельная структура хромосом в 1930-х гг. американцем Г.Мёллером, работавшим в СССР, и советским генетиком Ф.Добжанским, работавшим в США.
Слайд 36
Динамика укорочения теломер
в первичной культуре фибробластов, растущих in
vitro, каждое удвоение количества клеток сопровождается уменьшением теломер на
48 ± 21 пар нуклеотидовфибробласты человека in vivo имеют среднюю величину укорочения теломер равной -75 пар оснований на один акт митоза
теломеры периферических клеток крови детей теряют более 1000 пар нуклеотидов в год.
в возрасте от 4 до 20 лет теломеры укорачиваются все медленнее, а в зрелом и пожилом возрасте их длина падает с практически постоянной скоростью около 30—60 пар нуклеотидов ежегодно
критическая длина теломер фибробластов человека при которой наступает репликативное старение (торможение и полное прекращение пролиферации), не более 5 -7 тыс. пар оснований
Слайд 37 Гипотеза изменения взаимодействий ДНК и ядерного матрикса при
укорачивании теломер
При укорачивании теломер происходит сдвиг ДНК относительно
матрикса. При этом генные локусы (а, Ь, с,) меняют свое положение относительно участков связывания ДНК-матрикса (греческие буквы). Укорачивание теломер должно приводить к ослаблению связи теломер с ядерным матриксом и к изменению связей ДНК-матрикс внутри хромосомы. Такие процессы приводят к плавным изменениям в упаковке ДНК, а значит, и к изменениям в экспрессии генов. Можно предположить, что эти изменения максимальны в прителомерных областях, а при приближении к центромерам должны уменьшаться.
Слайд 38
Предсказание теломеразы А.М.Оловниковым
Термин «теломераза» ввела Э.Блекборн в 1987
г., однако необходимость существования такого фермента предсказал опять же
А.М.Оловников еще в первой своей теоретической работе 1971 г. в Докладах АН СССР. Он назвал этот фермент «тандем-полимеразой»Вот цитата из этой работы: «Тандем-полимераза или ее изозимы должны присутствовать в клетках, способных к бесконечному удвоению генома, например, в опухолевых клетках, половых и в ряде других».
Слайд 39
Работа теломеразы(1)
Перед началом цикла репликации ДНК теломераза добавляет
несколько копий теломерных повторов на З'-конец ДНК. После этого
репликация идет в обычном порядке. На отстающей цепи синтезируются РНК-праймеры, при этом наиболее важно то, что концевой праймер синтезируется на «досинтезированном» теломерном повторе. После завершения репликации остается незаполненным только участок РНК-праймера, синтезированного на «досинтезированной» теломерной ДНК. В результате кодирующие части дочерних цепей ДНК получаются той же длины, что и родительских.
Слайд 40
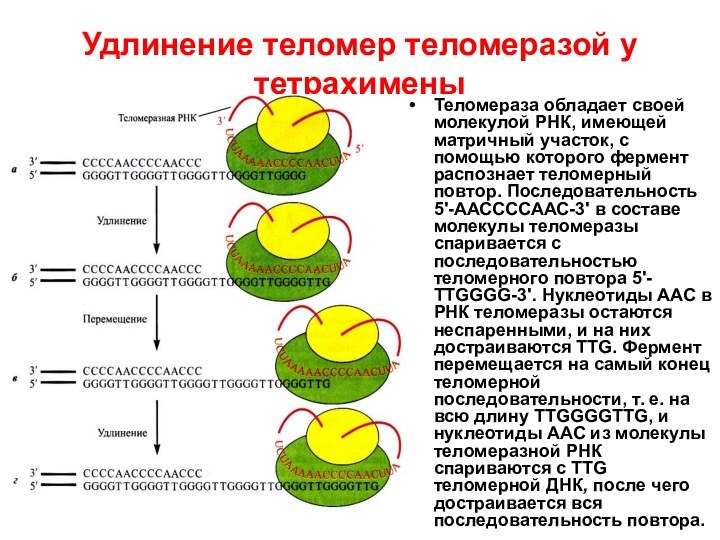
Удлинение теломер теломеразой у тетрахимены
Теломераза обладает своей молекулой
РНК, имеющей матричный участок, с помощью которого фермент распознает
теломерный повтор. Последовательность 5'-ААССССААС-3' в составе молекулы теломеразы спаривается с последовательностью теломерного повтора 5'-ТТGGGG-3'. Нуклеотиды ААС в РНК теломеразы остаются неспаренными, и на них достраиваются ТТG. Фермент перемещается на самый конец теломерной последовательности, т. е. на всю длину ТТGGGGТТG, и нуклеотиды ААС из молекулы теломеразной РНК спариваются с ТТG теломерной ДНК, после чего достраивается вся последовательность повтора.
Слайд 41
Теломераза
Теломераза - крупный фермент, состоящий из двух основных
субъединиц, кодируемых разными генами:
1. TR (hTR) или hTER
- (human) Telomerase RNA component - Матричная теломеразная РНК2. TERT (hTERT) - (human) Telomerase Reverse Transcriptase - Теломеразная обратная транскриптаза.
Теломераза восстанавливает укоротившиеся теломеры до исходной длины, т.е. предотвращает старение.
TR экспрессируется во всех клетках, TERT - только в гаметах и трансформированных клетках, а также ограниченно в стволовых клетках.
Теломераза была открыта Э.Блекборн и сотрудниками сначала в клетках простейших – тетрахимены, позже и у других организмов и человека.
Слайд 42
Роль теломеразной РНК
1. Изменение специфических оснований у
Тетрахимены или дрожжей путем внесения мутации в матрицу теломеразной
РНК свидетельствует, что эти основания крайне важны для ферментативной активности теломеразы2. При определенном изменении теломерной последовательности наблюдается полное блокирование микронуклеусов Tetrahymena в анафазе;
3. Специфические мутации в гене теломеразной РНК ведут к увеличению теломер у Tetrahymena и дрожжей Kluyveromyces lactis.
Слайд 43
hnRNP
hnRNPs – heterogeneous nuclear ribonucleoproteins – обширное
семейство связывющихся с нуклеиновыми кислотами белков часто обнаруживаемые в
40S рибонуклеопротеиновых частицах. Часть имеет строго ядерную локализацию, часть челночно перемещается из цитоплазмы в ядро. Играют роль в регуляции теломеразы и строения теломер. hnRNPs, связанные с теломерами – hnRNP A1, A2-B1, D, E. С теломеразой - hnRNP A1, C1/C2, D. Взаимносвязываясь, hnRNP облегчают связь теломеразы с теломерами.
Слайд 45
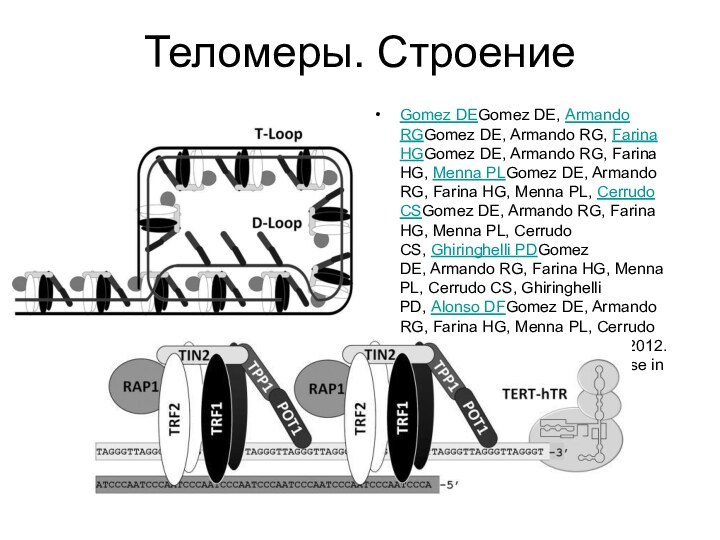
Теломеры. Строение
Gomez DEGomez DE, Armando RGGomez DE, Armando RG, Farina HGGomez
DE, Armando RG, Farina HG, Menna PLGomez DE, Armando RG, Farina HG, Menna PL, Cerrudo CSGomez
DE, Armando RG, Farina HG, Menna PL, Cerrudo CS, Ghiringhelli PDGomez DE, Armando RG, Farina HG, Menna PL, Cerrudo CS, Ghiringhelli PD, Alonso DFGomez DE, Armando RG, Farina HG, Menna PL, Cerrudo CS, Ghiringhelli PD, Alonso DF. 2012. Telomere structure and telomerase in health and disease. Int J Oncol. 41(5):1561-9.
Слайд 52
Белки, связанные с теломерами
1. Поддерживающие пространственную структуру теломер
- семейство TRF и другие белки с телобоксом.
2. Обеспечивающие
и регулирующие образование теломерного гетерохроматина, модулирующие активность генов, прилегающих к теломерам, путем их включения в гетерохроматин - Rap, Sir, Rif. гистоновые ацетилазы, метилтрансферазы и др.3. Отвечающие за подготовку теломер к репликации и взаимодействию с теломеразой - танкираза и белки, регулирующие непосредственно теломеразу: РinX1, комплекс Stn1/Сdс13/Ten1 у дрожжей.
4. Осуществляющие репарацию повреждений теломер и, возможно, негативно регулирующие их длину, т.е. нуклеазы - Rad50/Мге11/NBS1 и Кu.
5. Передающие информацию о защите или повреждениях теломер в другие субклеточные компартменты, инициирующие клеточное старение и апоптоз - АТМ, р53, р16INК4, рRb и другие белки сигнальных путей, регулирующих пролиферацию.
Слайд 54
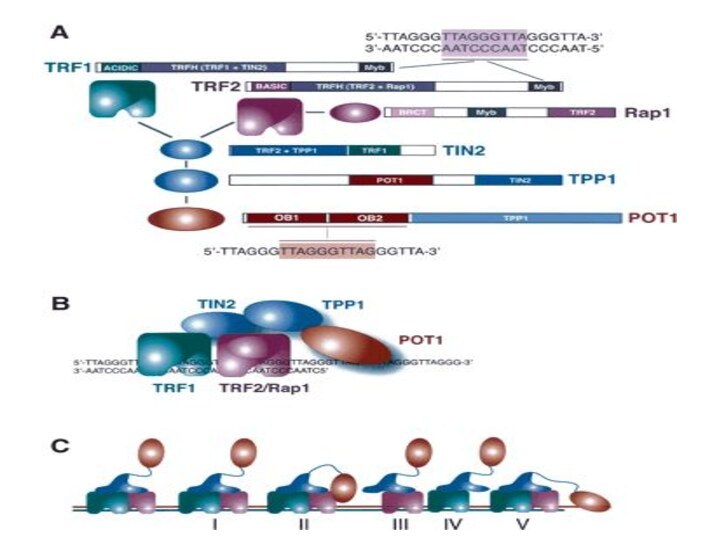
Белки, связанные с теломерами в клетках человека
ТRF1
- Теlоmеге repeat binding factor 1 (Pin2).
Негативный регулятор длины теломер. Препятствует действию теломеразы.ТRF2 - Теlоmеге repeat binding factor 2. Защищает теломеры от слияния друг с другом путем образования t-петли.
ТNKS -Танкираза 1 - человеческая теломерная поли(АДФ-рибозо) полимераза (РАRР). Риболизирует и тем самым дезактивирует ТRF1 (и, вероятно, удаляет с теломер ТIN2) и т.о. способствует удлинению теломер в раковых и других клетках, где функционирует теломераза.
ТIN2 – TRF1-interacting nuclear protein 2. Отрицательный регулятор длины теломер, препятствующий присоединению теломеразы
Pot1- Protection of telomeres - защищает G-богатую нависающую однонитевую теломерную ДНК.
Rap1 - Repressor-activator protein присоединяется к ТRF2, взаимодействует с С-концом белка. При образовании t-петли белок Rap1, возможно, образует поперечные сшивки с теломерной и даже субтеломерной ДНК, чем и удерживается t-петля.
Слайд 56
TRF 1
Резкое увеличение концентрации ТRF1 при его экспрессии
в культуре клеток под вирусным промотором приводит к преждевременному
вступлению в митоз и последующей гибели клетки - ТRF1 необходим для упаковки митотических хромосом. Чтобы отложить митоз, например, когда ДНК нуждается в репарации, этот белок может быть фосфорилирован протеинкиназой АТМ; той же самой протеинкиназой, которая активирует р53 и индуцирует апоптоз и клеточное старение по р53-зависимому механизмуИнгибирование ТRF1 в клетках, экспреccирующих теломеразу, сопровождается медленным увеличением длины теломер
Очевидно, ТRF1, способствуя образованию t-петли, тем самым препятствует удлинению теломер за счет теломеразной активности
Механизм действия ТRF1 на теломерах вряд ли заключается только в закручивании ДНК в сулерспираль и облегчении последующего образования t-петли. Благодаря взаимодействию с множеством регупяторных белков, ТRF1 может концентрировать их близ теломер.
Слайд 57
TRF 1
Первое сообщение о белке TRF 1 (Теlomeric
repeat binding factor 1) было опубликовано в 1992 г.
В 1997 г. определена его аминокислотная последовательность. Есть два продукта одного и того же гена, образующиеся в результате альтернативного сплайсинга РНК; TRF1, а другой Рin2. Хотя расчетные молекулярные массы продуктов составляют 50 и 48 кДа соответственно, их кажущиеся массы, определяемые при электрофорезе, — 63 и 61 кДа.На С-конце этой молекулы имеется ДНК-связывающий домен типа Муb. Чтобы белок взаимодействовал с нуклеиновой кислотой, необходима олигомеризация полипептидов, для которой служит ТRF домен. По данным электронной микроскопии, тетрамер ТRF1 с высокой специфичностью связывает до 12 теломерных повторов ДНК позвоночных. В отношении однонитевой ДНК, расположенной на конце теломер человека ТRF1 не активен. В насыщающей концентрации этот белок покрывает теломеры как сплошная оболочка 10-нм толщины. Каждая молекула ТRF1 изгибает ДНК под утлом около 1200, что указывает на роль этого белка в образовании пространственной структуры теломер. В последовательности ДНК белок связывает два сайта 5'-TАGGGТТ-3', которые могут быть расположены на разном расстоянии и под разным углом, в связи с чем предполагается, что ДНК-связывающие участки ТRF1 связаны с остальной частью белковой молекулы регионами, обладающими повышенной эластичностью.
Слайд 58
ТRF2
Белок ТRF2 был найден в конце 90-х годов.
По структуре он сходен с ТRF1, но его ТRF
домен не взаимодействует с гомологичным доменом TRF1, так что оба белка в клетке могут существовать в виде гомо-, но не гетеромеров. У ТRF2, как и у ТRF1, в результате альтернативного сплайсинга образуются два варианта, 65 и 69 кДа.На теломерах белок ТRF2 связывается в существенно меньшем количестве, чем ТRF1. Для связывания ТRF2 на конце хромосомы необходим однонитевой участок теломерной ДНК длиной не менее одного повтора из шести нуклеотидов ТТАGGG. Наличие более одного повтора в однонитевом участке улучшает связывание. Добавленный в избытке этот белок связывается на теломерах в количестве не менее 3, а в среднем около 10 димеров. ТRF2 расположен в узле, образующемся в точке касания конца теломер со «стволом».
Ингибирование ТRF2 может приводить к активации АТМ/р53-зависимого пути ответа клетки на повреждение ДНК и затем к апоптозу.
Функция белка ТRF2 - защита хромосомы от нуклеаз, слияния и последующих разрывов при митозе.
Слайд 59
ТRF2
Пороговая для сенильного торможения пролиферации длина теломер у
контрольных клеток составляет 6—7 тыс. пар нуклеотидов. При экспрессии
большого количествао ТRF2, этот порог на 2—2,7 тыс. пар оснований ниже, что позволяет клеткам пройти еще около 15 делений, прежде чем наступает старение.В клетках с критически короткими теломерами, сенильных или мутантных по р53 и рRb, повышенная экспрессия ТRF2 предотвращает слияния и разрывы хромосом. Это значит, что не длина теломер важна для индукции клеточного старения, а их состояние, связанное с защитной функцией белка ТRF2. Сенильные теломеры могут быть недостаточно длинными для маскирования конца хромосомы в узловой точке t-петли, но при повышенной концентрации ТRF2 вероятность образования нормальной t-петли возрастает.
У животных рецепторы инсулина и факторов роста могут контролировать теломеры через танкиразу, Короткие теломеры могут передавать информацию о своем состоянии на сигнальный путь, начинающийся от рецепторов факторов роста и ведущий к танкиразе. р53 регулирует передачу сигнала от указанных рецепторов через адапторный белок р66-Shс. Мутации в генах р53 и Shс могут приводить к изменению продолжительности жизни мышей
Слайд 60
TNKS и TNKL
У человека и позвоночных животных имеется
два изозима танкиразы, (142 и 127 кДа в немодифицированном
состоянии), ТNKL или танкираза 1 и ТNKS или танкираза 2. Кроме энзиматического домена, гомологичного соответствующему домену РАRР, у танкиразы имеется большой анкириновый домен, состоящий из 24 повторов, а так же SАМ домен; оба участвующие в различных белок-белковых взаимодействиях. Ни один из изозимов не имеет собственного сигнала ядерной локализации, поэтому большая часть фермента находится в цитоплазме. Танкираза фосфорилируется и активируется МАР-киназой. МАР-киназа через сигнальный путь Ras-МАРК регулируется инсулином и факторами роста; поэтому следует предположить, что с помощью танкиразы организм держит теломеры всех клеток под контролем гормонов.
Слайд 61
TRF 1
ТRF1может быть поли-АDР-рибозилирован, что сопровождается его диссоциацией
от ДНК. Эту посттрансляционную модификацию катализирует танкираза (теломерная анкириновая
поли-АDР-рибоза-полимераза), Это партнер ТRF1, вместе с ним проникающий в ядро в неактивном состоянии. После активации танкираза подвергает поли-АDР-рибозилированию себя и ТRF1, что приводит к распаду нуклеопротеидного комплекса и освобождению теломер. В результате последние могут быть доступны для теломеразы и других ферментов.TNKL (танкираза 1) и TNKS (танкираза 2)
Слайд 62
Белки, взаимодействующие с TRF1
Теломерный белок TINF2 или ТIN2
(ТRF1 intracting nuclear factor 2) - 40кДа, по структуре
напоминает белки ТRF, так как имеет ДНК-связываюший домен типа Муb на С-конце. ТINF2 опосредует действие ТRF1.ТRF1 связывает мощный ингибитор теломеразы, белок РinX1, который действует непосредственно на фермент, в отличие от остальных модуляторов, влияющих на доступность теломер.
с ТRF1 взаимодействует Роt1 (71 кДа), который защищает особенно уязвимую со стороны нуклеаз, облучения и химических агентов однонитевую ДНК, (Protection of telomeres). Влияя на связывание Роt1, белок ТRF1, концентрация которого пропорциональна длине теломер, передает на однонитевые концы информацию об общей протяженности теломерной ДНК.
Слайд 63 Теломерная теория старения объясняет многие давно известные, но без
нее непонятные факты
1. Почему злокачественные клетки делятся неограниченно
2. Почему
наши дети начинают стареть каждый раз с нуля, а не с того уровня, до которого успели постареть их родители и их клетки к моменту зачатия
3. Связь старения с размножением («В чем смысл жизни?») и возможность «бессмертия», предоставляемая природой всем живым организмам. Ограниченные возможности клонирования.
Слайд 64
Трудности теломерной теории
1. Теломеры в клетках мыши ~
в 10 раз длиннее, чем в клетках человека, но
мышь живет не более 3 лет, а человек - заметно больше.2. Длина теломер в фибробластах человека и их пролиферативный потенциал не отчетливо коррелируют с возрастом донора.
3. Хромосомы фибробластов глубоких стариков сохраняют в среднем достаточно длинные теломеры.
Слайд 65
Возможное объяснение трудностей теломерной теории старения
Для старения
и смерти от старости вовсе не обязательно, чтобы лимит
Хейфлика исчерпался во всех тканях организма. Достаточно исчерпания пролиферативного потенциала в каком-то отдельном участке какого-либо органа или ткани. Это повысит вероятность одной из характерных возрастных болезней. Совокупность этих болезней и есть старение. Никто не умирает от самогő увеличения возраста. Люди умирают от болезней, вероятность которых с возрастом увеличивается. Таких болезней, являющихся самыми частыми причинами смерти, немного: рак, инсульт и сердечная недостаточность (инфаркт). Они приводят к смерти чаще всего в возрасте до 70 лет. Если человеку повезло избежать этих заболеваний, он вполне может прожить до 100 лет и скончаться от исчерпания пролиферативного потенциала в других тканях – коже, мышцах, и т.д. – это ведет к постепенному одряхлению (senescense) и смерти в глубокой старости.
Слайд 66
Репарационные белки, связанные с теломерами
Кu (состоит из субъединиц
Кu 70 и Ки 80(86) - аутоантиген, участвующий в
репарации двунитевых разрывов ДНК, путем негомологичного соединения концов. Присоединяется к ТRF1. Способствует работе теломеразы. В отсутствие Кu происходят слияния теломер-теломер.RAD50 (Rad50) Radiation mutant 50 - постоянно присутствует в теломерах.
MRE11 meiotic recombination 11
NBS1 -Nijmegen breakage syndrome 1 экспрессируется только в S-фазе цикла.
АТМ-киназа (Ataxia-telangiectasia mutated)-киназа - фосфорилирует NBS1(нибрин), активируя изменение ДНК на концах теломер, что делает ее доступной для теломеразы. Мутация по гену АТМ вызывает одну из болезней старения - атакеию-телеангиэктазию (синдром Луи-Барр).
DNA-PKcs – ДНК-зависимая протеинкиназа
Слайд 69
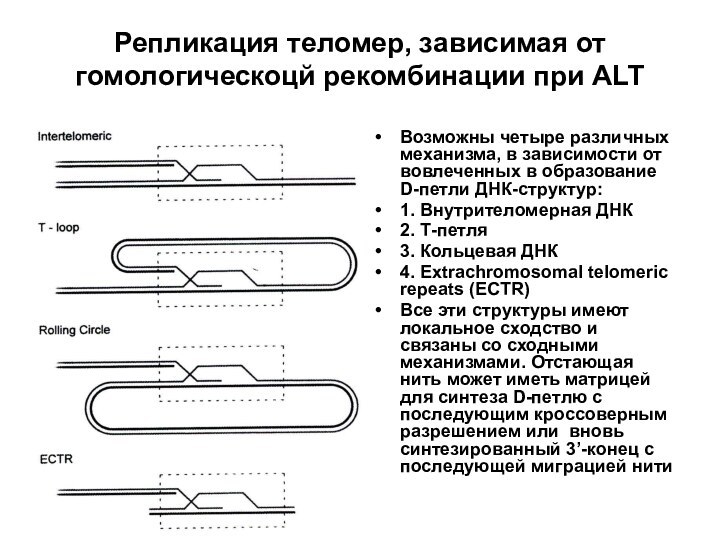
Репликация теломер, зависимая от гомологическоцй рекомбинации при ALT
Возможны
четыре различных механизма, в зависимости от вовлеченных в образование
D-петли ДНК-структур:1. Внутрителомерная ДНК
2. Т-петля
3. Кольцевая ДНК
4. Extrachromosomal telomeric repeats (ECTR)
Все эти структуры имеют локальное сходство и связаны со сходными механизмами. Отстающая нить может иметь матрицей для синтеза D-петлю с последующим кроссоверным разрешением или вновь синтезированный 3’-конец с последующей миграцией нити
Слайд 70 Белки, вовлеченные в процесс альтернативного удлинения теломер и
находящиеся во внутриядерных PML-тельцах
RAD52 – Связывается с двунитевыми концами
ДНК и способствует активности RAD51. Колокализуется в общих фокусах с RAD51 и с MRE11/RAD50, которые образуются во время репарации двунитевых разрывов. В клетках S. Cerevisiae RAD52 необходим для гомологической рекомбинации, вовлеченной в оба известных пути выживаемости безтеломерных штаммов, а также для образования миниколец рибосомальной ДНКRAD51 – RecA-подобный белок, способный к перемещению нити ДНК, вовлеченный в репарацию одно- и двунитевых разрывов ДНК с участием гомологической рекомбинации. Ассоциируется с белками RPA, BLM и PML, образуя фокусы в районе разрывов ДНК и внепланового синтеза. У дрожжей Rad51 белковый комплекс необходим для генной конверсии, когда донорная ДНК транскрипционно неактивна (подавлена) и вовлечен только в путь I выживаемости безтеломерных штаммов
Слайд 71 Белки, вовлеченные в процесс альтернативного удлинения теломер и
находящиеся во внутриядерных PML-тельцах (2)
MRE11/RAD50/NBS1 (MRN-комплекс) – Функционально значим
для репарации двойных разрывов ДНК обоими путями, для поддержания геномной стабильности и чекпойнт-контроля S-фазы. В нормальных клетках находится в течение всего клеточного цикла в области теломер. MRE11 in vitro является 3’-5’ДНК-экзонуклеазой и однонитевой ДНК-эндонуклеазой. Сочетание этих активностей с ДНК-геликазным действием RAD50 может быть востребовано в экзонуклеазной деятельности in vivo. NBS1 ответственен за фосфорилирование и активацию всего комплекса, хотя обычно находится в комплексе только в S-фазе. Его локализация в PML-тельцах может служить доказательством активного синтеза ДНК в них. У дрожжей RAD50 необходим для II пути выживаемости безтеломерных штаммов, а гомологи MRN участвуют в рекомбинации.RPA - Белок, связывающийся с однонитевой ДНК, облегчающий раскручивание ДНК и модулирующий активность других белков. Играет основную, а, возможно, и координирующую роль в репликации, рекомбинации и репарации ДНК. У дрожжей, дефектных по этому белку, сохраняются нормальные теломеры.
Слайд 72 Белки, вовлеченные в процесс альтернативного удлинения теломер и
находящиеся во внутриядерных PML-тельцах (3)
WRN и BLM – Геликазы
типа RecQ, вовлеченные в репликацию ДНК. Могут, в зависимости от контекста, облегчать или усложнять гомологическую рекомбинацию. Гомологичны Sgs1, RecQ-геликазе дрожжей, которая необходима для II пути выживаемости безтеломерных штаммов и является ключевым белком дрожжевого «старения». Способны связываться с 3’-концами и G-квадридуплексами ДНК. BLM способен связываться с трех- и четырехнитевыми объединениями и взаимодействовать с топоизомеразой III и RPA. Р53 облегчает накопление BLM в PML-тельцах, но ингибирует экзонуклеазную активность WRN.
TRF1 и TRF2 – Специфически связывающиеся с теломерными повторами белки. Негативные регуляторы длины теломер, играют роль в структурной организации теломер и их связыванием с ядерным матриксом. Увеличение или уменьшение количества TRF1 может соответственно участвовать в контроле входа клетки в митоз и выхода из него. TRF2 вовлечен в поддержание стабильности теломер. Ингибирование его связывания с теломерами приводит к потере 3’-выступающего конца, слиянию теломер и активации Р53-зависимого чекпойнта, вызванного повреждениями ДНК (G1).
Слайд 73
Белки, связанные с теломерами
1. Поддерживающие пространственную структуру теломер
- семейство TRF и другие белки с телобоксом.
2. Обеспечивающие
и регулирующие образование теломерного гетерохроматина, модулирующие активность генов, прилегающих к теломерам, путем их включения в гетерохроматин - Rap, Sir, Rif. гистоновые ацетилазы, метилтрансферазы и др.3. Отвечающие за подготовку теломер к репликации и взаимодействию с теломеразой - танкираза и белки, регулирующие непосредственно теломеразу: РinX1, комплекс Stn1/Сdс13/Ten1 у дрожжей.
4. Осуществляющие репарацию повреждений теломер и, возможно, негативно регулирующие их длину, т.е. нуклеазы - Rad50/Мге11/NBS1 и Кu.
5. Передающие информацию о защите или повреждениях теломер в другие субклеточные компартменты, инициирующие клеточное старение и апоптоз - АТМ, р53, р16, рRb и другие белки сигнальных путей, регулирующих пролиферацию.
Слайд 76
Гомологи белков человека, ассоциированных с теломерами (3)
при отсутствии
функциональных характеристик вместо тривиального названия приводится лишь ссылка на
номер гомологичной последовательности в базе данных Genbank.
Слайд 77
SIRT-белки (сиртуины)
Известно, что в клетках каждой ткани функционируют
только те гены, которые экспрессируют белки, нужные для работы
этой ткани. Остальные гены молчат. Их молчание обеспечивают специальные белки – сиртуины, или SIRT-белки (Silent Information Regulators). Химически это – гистоновые дезацетилазы, которые экспрессируются генами SIRT.В ходе старения (вызываемого все-таки укорочением теломер), а также при повреждении ДНК, может изменяться экспрессия генов. В результате этих эпигенетических изменений сиртуины могут отсоединяться от локусов молчащих генов и перемещаться к поврежденным участкам ДНК, где способствуют их репарации (в этом – вторая функция сиртуинов). Освободившиеся от сиртуинов молчащие гены перестают быть молчащими, и экспрессируемые ими не нужные в данной ткани белки нарушают нормальную работу ее клеток, и тем способствуют ускорению старения и дополнительно изменяют экспрессию генов, что в свою очередь способствует освобождению от сиртуинов новых ранее молчавших генов, и тем еще более ускоряют старение, и т.д. (порочный круг).
Т.о., разблокирование молчащих генов в результате отсоединения сиртуинов – не самостоятельный механизм старения, а результат укорочения теломер.
Слайд 80
Недорепарация теломер
теломерная ДНК повреждается в среднем сильней, чем
ДНК из внутренних областей хромосом.
имеются сведения о почти
полном отсутствии репарации при повреждении теломер.в теломерах неделящихся клеток в состоянии контактного торможения накапливаются однонитевые разрывы
вероятно, теломеры являются универсальными аккумуляторами разнообразных повреждений, т.е. самым слабым местом в ДНК
Слайд 81
Причины недорепарации
1. Репарация концов ДНК может встречать те
же трудности, что и репликация.
2. Теломеры могут не
репарироваться в том случае, если образующийся в результате двойного разрыва проксимальный фрагмент имеет достаточную длину, чтобы не индуцировать остановку пролиферации клеток. 3.Разрыв теломеры, в отличие от внутреннего разрыва, не ведет к потерям генов, а значит клетка с таким разрывом не элиминируется из популяции.