- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Универсальные пути катаболизма аминокислот. (Лекция 2)
Содержание
- 2. План лекцииУниверсальные пути катаболизма аминокислот: трансаминирование,
- 3. Общая схема катаболизма аминокислот Катаболизм аминокислот
- 4. Общая схема катаболизма аминокислот Катаболизм аминокислотАминокислоты
- 5. Общая схема катаболизма аминокислот Катаболизм аминокислотОсновным
- 6. Переаминирование Катаболизм аминокислотТрансаминирование (переаминирование )
- 7. Переаминирование Катаболизм аминокислотРеакция трансаминирования происходит
- 8. Переаминирование Катаболизм аминокислотПиридоксин, пиридоксаль-5-фосфат и пиридоксамин-5-фосфат
- 9. Переаминирование Катаболизм аминокислотАктивный центр аминотрансферазы
- 10. Переаминирование Катаболизм аминокислотМеханизм реакции переаминирования был
- 11. Переаминирование Катаболизм аминокислотАкцептором аминогруппы в
- 12. Переаминирование Катаболизм аминокислотПроцесс переаминированияПроцесс переаминирования
- 13. Переаминирование Катаболизм аминокислотПроцесс переаминирования Процесс
- 14. Переаминирование Катаболизм аминокислотРеакции переаминирования относятся к
- 15. ПереаминированиеКатаболизм аминокислотАланинаминотрансфераза (АЛТ)АЛТ катализирует реакцию
- 16. ПереаминированиеКатаболизм аминокислотАспартатаминотрансфераза (АСТ)ACT катализирует реакцию трансаминирования
- 17. Дезаминирование аминокислотКатаболизм аминокислотДезаминирование аминокислотДезаминирование аминокислот
- 18. Дезаминирование аминокислотКатаболизм аминокислотОкислительное дезаминированиеглутаминовой кислоты
- 19. Дезаминирование аминокислот Катаболизм аминокислотПрямое окислительное
- 20. Дезаминирование аминокислотКатаболизм аминокислотПрямое окислительное дезаминированиеглутаминовой
- 21. Дезаминирование аминокислотКатаболизм аминокислотРегуляция активности глутаматдегидрогеназы
- 22. Трансдезаминирование Катаболизм аминокислотНепрямое окислительное дезаминирование -
- 23. Трансдезаминирование аминокислотКатаболизм аминокислот Непрямое окислительное
- 24. Трансдезаминирование аминокислотКатаболизм аминокислот Непрямое окислительное дезаминирование аминокислотБ. Окислительное дезаминирование глутаминовой кислоты
- 25. Трансдезаминирование аминокислотКатаболизм аминокислот Две стадии
- 26. Дезаминирование аминоксилот Катаболизм аминокислотСудьба продуктов окислительного дезаминирования аминокислот
- 27. Дезаминирование аминокислот Катаболизм аминокислотНеокислительное дезаминированиеаминокислот
- 28. Дезаминирование аминокислот Катаболизм аминокислотНеокислительное дезаминированиеаминокислот Сериндегидратаза Треониндегидратаза
- 29. Дезаминирование аминокислот Катаболизм аминокислотВнутримолекулярное дезаминированиегистидинаНеокислительное
- 30. Катаболизм аминокислотДекарбоксилирование аминокислотДекарбоксилирование - отщепление СООН-группы от
- 31. Катаболизм аминокислотДекарбоксилирование аминокислотБиогенные амины и их предшественники
- 32. Декарбоксилирование аминокислот Катаболизм аминокислотГлутамат-декарбоксилазаГАМК –
- 33. Декарбоксилирование аминокислот Катаболизм аминокислотГистидин-декарбоксилазаГистамин образуется
- 34. Декарбоксилирование аминокислот Катаболизм аминокислот5-окситриптофан-декарбоксилазаРяд аминокислот
- 35. Пути образования и детоксикации NH3
- 36. Декарбоксилирование аминокислот Катаболизм аминокислотКатаболизм биогенных
- 37. Скачать презентацию
- 38. Похожие презентации
План лекцииУниверсальные пути катаболизма аминокислот: трансаминирование, дезаминирование, декарбоксилирование. Катаболизм аминокислот



























Слайд 2
План лекции
Универсальные пути катаболизма аминокислот:
трансаминирование, дезаминирование, декарбоксилирование.
Слайд 4
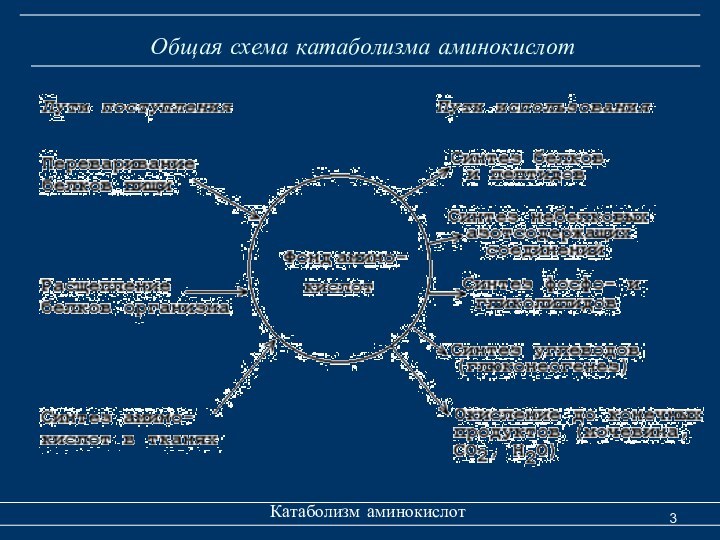
Общая схема катаболизма аминокислот
Катаболизм аминокислот
Аминокислоты в клетке
составляют динамичный пул, который непрерывно пополняется и так же
непрерывно расходуется.Большая часть аминокислот организма человека, примерно 15 кг, входит в состав белков. Фонд свободных АК организма составляет примерно 35г.
Существуют три источника аминокислот для пополнения этого пула – поступление из крови, распад собственных внутриклеточных белков и синтез заменимых аминокислот.
Путь дальнейшего превращения каждой аминокислоты зависит от вида и функции клетки, условий ее существования и гормональных влияний. Спектр веществ, получаемых клеткой из аминокислот, чрезвычайно широк.
Слайд 5
Общая схема катаболизма аминокислот
Катаболизм аминокислот
Основным источником аминокислот
в организме служат белки пищи. Аминокислоты, образующиеся при переваривании
белков, поступают в клетки различных тканей, где вовлекаются как в катаболические, так и анаболические процессы.Катаболизм аминокислот включает следующие процессы: 1) удаления α-аминогруппы; 2) удаление СООН-группы; 3) распад углеродного скелета аминокислот.
Универсальными являются первые два процесса, деградация С-скелета уникальна для каждой аминокислоты.
Удаление α-аминогруппы из аминокислот осуществляется в результате 2 процессов – трансаминирования и дезаминирования.
Слайд 6
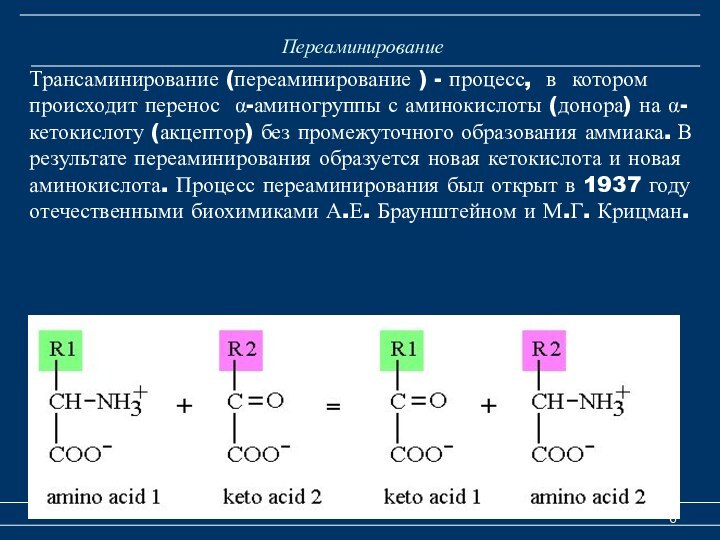
Переаминирование
Катаболизм аминокислот
Трансаминирование (переаминирование ) - процесс,
в котором происходит перенос α-аминогруппы с аминокислоты (донора) на
α-кетокислоту (акцептор) без промежуточного образования аммиака. В результате переаминирования образуется новая кетокислота и новая аминокислота. Процесс переаминирования был открыт в 1937 году отечественными биохимиками А.Е. Браунштейном и М.Г. Крицман.
Слайд 7
Переаминирование
Катаболизм аминокислот
Реакция трансаминирования происходит с участием
ферментов аминотрансфераз (трансаминаз), которые локализованы в цитозоле и митохондриях
клеток практически всех органов.Простетической группой этих ферментов является производное витамина В6 – пиридоксаль-5-фосфат.
Аминотрансферазы обладают групповой специфичностью и вовлекают в реакции все аминокислоты, кроме пролина, лизина, треонина, которые не подвергаются трансаминированию. В тканях человека обнаружено более 10 различных аминотрансфераз. Наиболее распространенными являются: аспартатаминотрансфераза (АСТ) и аланинаминотрансфераза (АЛТ).
Слайд 8
Переаминирование
Катаболизм аминокислот
Пиридоксин, пиридоксаль-5-фосфат и
пиридоксамин-5-фосфат
Слайд 10
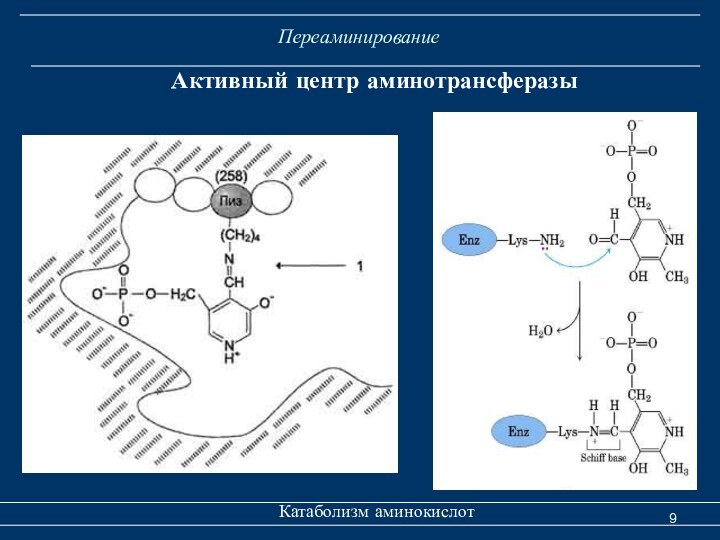
Переаминирование
Катаболизм аминокислот
Механизм реакции переаминирования был предложен А.Е.
Браунштейном, М.М. Шемяки-ным, Д. Мецлером и Э. Снеллом.
Пиридоксаль-5-фосфат выполняет роль промежуточного переносчика аминогруппы, отщепляемой от аминокислоты.
Слайд 11
Переаминирование
Катаболизм аминокислот
Акцептором аминогруппы в реакциях переаминирования
служат три кетокислоты: пируват, α–кетоглутарат и оксалоацетат.
α–Кетоглутарат -
универсальный акцептор α-аминогруппы.Донором аминогрупп в процессе трансаминирования чаще всего выступают аминокислоты, которых много в организме – Глу, Ала, Асп.
Процесс трансаминирования легко обратим, константа равновесия Кр ≈ 1.
Слайд 12
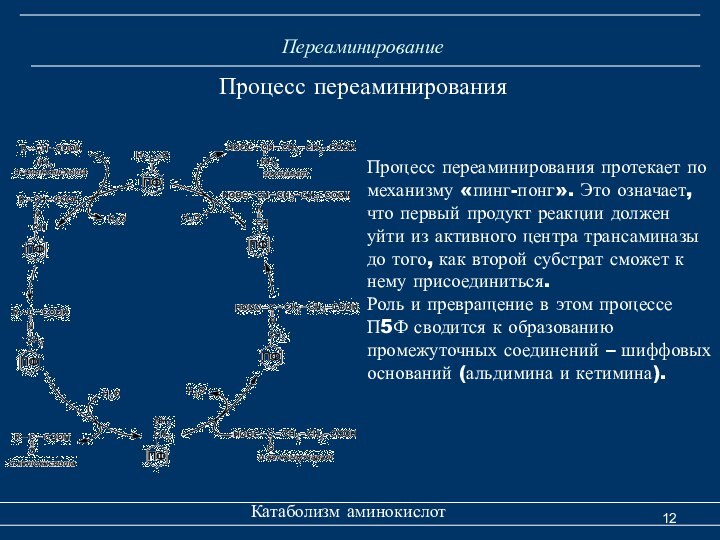
Переаминирование
Катаболизм аминокислот
Процесс переаминирования
Процесс переаминирования протекает по
механизму «пинг-понг». Это означает, что первый продукт реакции должен
уйти из активного центра трансаминазы до того, как второй субстрат сможет к нему присоединиться.Роль и превращение в этом процессе П5Ф сводится к образованию промежуточных соединений – шиффовых оснований (альдимина и кетимина).
Слайд 13
Переаминирование
Катаболизм аминокислот
Процесс переаминирования
Процесс переаминирования протекает
в две стадии. После отщепления молекулы воды образуется альдиминовая
связь между остатком аминокислоты и пиридоксальфосфатом. Полученное соединение называется альдимин.Перемещение двойной связи приводит к образованию кетимина, который гидролизуется водой по месту двойной связи. От фермента отщепляется готовый продукт – кетокислота.
После отщепления кетокислоты к комплексу пиридоксамин-фермент присоединяется новая кетокислота и процесс идет в обратном порядке: сначала образуется кетимин, затем альдимин, после чего от активного центра фермента отделяется новая аминокислота. Фермент возвращается в исходное состояние.
п
Слайд 14
Переаминирование
Катаболизм аминокислот
Реакции переаминирования относятся к амфиболическим процессам,
то есть выполняют как катаболическую, так и анаболическую функцию.
Роль
реакций трансаминирования в организме:1) путь синтеза заменимых аминокислот;
2) участие в непрямом дезаминировании аминокислот;
3) образующиеся в реакции α-кетокислоты могут включаться в общий путь катаболизма и глюконеогенез.
Слайд 15
Переаминирование
Катаболизм аминокислот
Аланинаминотрансфераза (АЛТ)
АЛТ катализирует реакцию трансаминирования между
аланином и α-кетоглутаратом. АЛТ локализуется в
цитозоле клеток
многих органов, больше всего ее в клетках печени и миокарда.
Слайд 16
Переаминирование
Катаболизм аминокислот
Аспартатаминотрансфераза (АСТ)
ACT катализирует реакцию трансаминирования между аспарагиновой
кислотой и α-кетоглутаратом . ACT имеет как цитоплазматическую, так
и митохондриальную формы. Наибольшее ее количество обнаружено в миокарде и печени.
Слайд 17
Дезаминирование аминокислот
Катаболизм аминокислот
Дезаминирование аминокислот
Дезаминирование аминокислот - процесс
отщепления NH2-группы с образованием аммиака и различных кислот.
Известны следующие
типы дезаминирования: восстановительное, гидролитическое, внутримолекулярное и окислительное.Общим продуктом всех типов дезаминирования является аммиак. Кроме аммиака образуются жирные кислоты (насыщеннын и ненасыщенные), гидрокси- и кетокислоты. Для большинства организмов характерно окислительное дезаминирование.
Слайд 18
Дезаминирование аминокислот
Катаболизм аминокислот
Окислительное дезаминирование
глутаминовой кислоты
Слайд 19
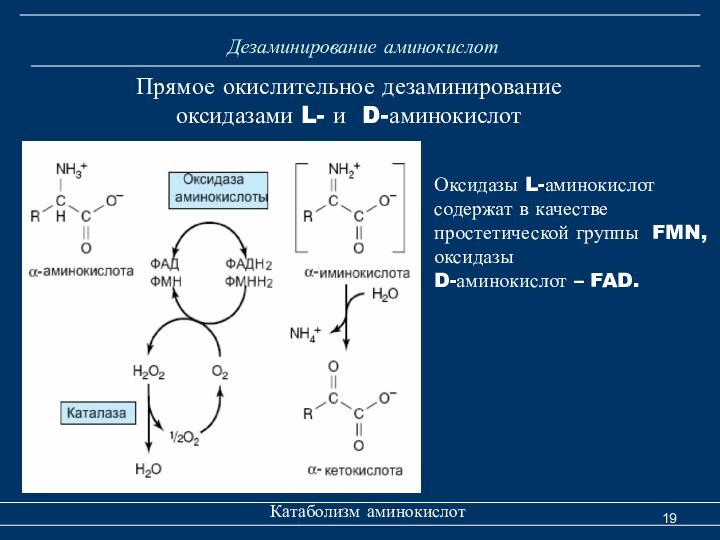
Дезаминирование аминокислот
Катаболизм аминокислот
Прямое окислительное дезаминирование
оксидазами L-
и D-аминокислот
Оксидазы L-аминокислот
содержат в качестве
простетической группы FMN,
оксидазыD-аминокислот – FAD.
Слайд 20
Дезаминирование аминокислот
Катаболизм аминокислот
Прямое окислительное дезаминирование
глутаминовой кислоты
Глутаматдегидрогеназа -
олигомер, состоящий из 6 субъединиц. М.м. 312 кДа.
Слайд 21
Дезаминирование аминокислот
Катаболизм аминокислот
Регуляция активности глутаматдегидрогеназы
Слайд 22
Трансдезаминирование
Катаболизм аминокислот
Непрямое окислительное дезаминирование - основной способ дезаминирования
большинства аминокислот.
В большинстве тканей процессу окислительного дезаминирования предшествует
процесс трансаминирования – передачи аминогруппы от аминокислоты на α–кетоглутаровую кислоту и уже глутаминовая кислота подвергается далее прямому окислительному дезаминированию. Непрямое окислительное дезаминирование аминокислот происходит при участии 2 ферментов: аминотрансферазы (простетическая группа П5Ф) и глутаматдегидрогеназы (кофермент NAD+). Непрямое окислительное дезаминирование - трансдезаминирование
Слайд 23
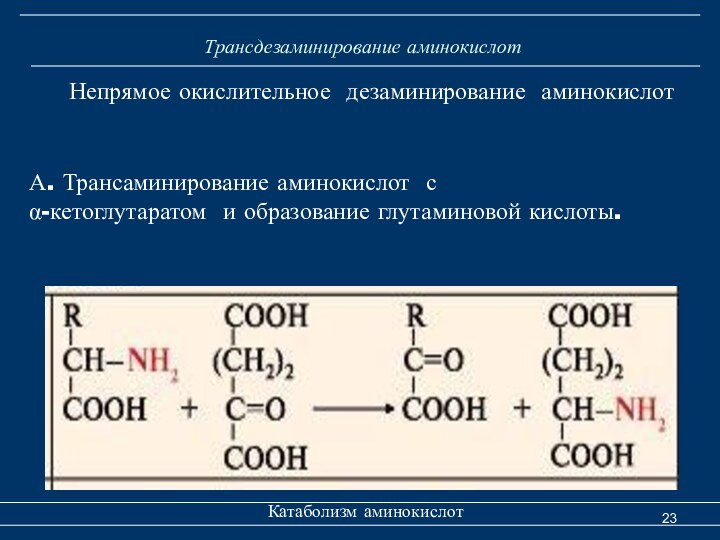
Трансдезаминирование аминокислот
Катаболизм аминокислот
Непрямое окислительное дезаминирование аминокислот
А.
Трансаминирование аминокислот с
α-кетоглутаратом и образование глутаминовой кислоты.
Слайд 24
Трансдезаминирование аминокислот
Катаболизм аминокислот
Непрямое окислительное дезаминирование аминокислот
Б.
Окислительное дезаминирование глутаминовой кислоты
Слайд 25
Трансдезаминирование аминокислот
Катаболизм аминокислот
Две стадии непрямого дезаминирования
обратимы, что обеспечивает как катаболизм аминокислот, так и возможность
образования практически любой аминокислоты из соответствующей α-кетокислоты.
Слайд 26
Дезаминирование аминоксилот
Катаболизм аминокислот
Судьба продуктов окислительного дезаминирования аминокислот
Слайд 27
Дезаминирование аминокислот
Катаболизм аминокислот
Неокислительное дезаминирование
аминокислот
В печени
человека присутствуют специфические ферменты, катализирующие реакции дезаминирования аминокислот серина,
треонина и гистидина неокислительным путём.Неокислительное дезаминирование серина катализирует сериндегидратаза. Реакция начинается с отщепления молекулы воды и образования метиленовой группы, затем происходит неферментативная перестройка молекулы, в результате которой образуется иминогруппа, слабо связанная с а-углеродным атомом. Далее в результате неферментативного гидролиза отщепляется молекула аммиака и образуется пируват.
Слайд 28
Дезаминирование аминокислот
Катаболизм аминокислот
Неокислительное дезаминирование
аминокислот
Сериндегидратаза
Треониндегидратаза
Слайд 29
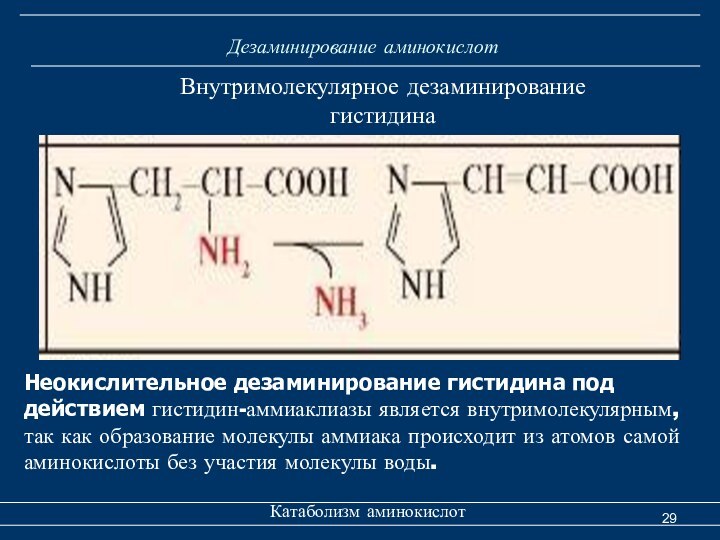
Дезаминирование аминокислот
Катаболизм аминокислот
Внутримолекулярное дезаминирование
гистидина
Неокислительное дезаминирование гистидина
под действием гистидин-аммиаклиазы является внутримолекулярным, так как образование молекулы
аммиака происходит из атомов самой аминокислоты без участия молекулы воды.
Слайд 30
Катаболизм аминокислот
Декарбоксилирование аминокислот
Декарбоксилирование - отщепление СООН-группы от аминокислоты
осуществляется ферментами декарбоксилазами, относящимися к классу лиаз.
Простетической группой у
декарбоксилаз служит пиридоксаль-5-фосфат.Продуктами реакции декарбоксилирования
являются СО2 и биогенные амины, участвующие в регуляции обмена веществ и физиологических процессов в организме. Реакции являются необратимыми.
Слайд 32
Декарбоксилирование аминокислот
Катаболизм аминокислот
Глутамат-декарбоксилаза
ГАМК – нейромедиатор, обеспечивающий
процессы
торможения. Основное место образования – ткань головного мозга. γ-АМК
– главный медиатор в нервной системе. Образуется и удаляется постоянно, ее присутствие сопровождается переходом ионов хлора в постсинаптическую мембрану. Это ведет к гиперполяризации постсинаптической мембраны, из-за чего сигнал от возбуждающего нерва не достигает порогового уровня.
Слайд 33
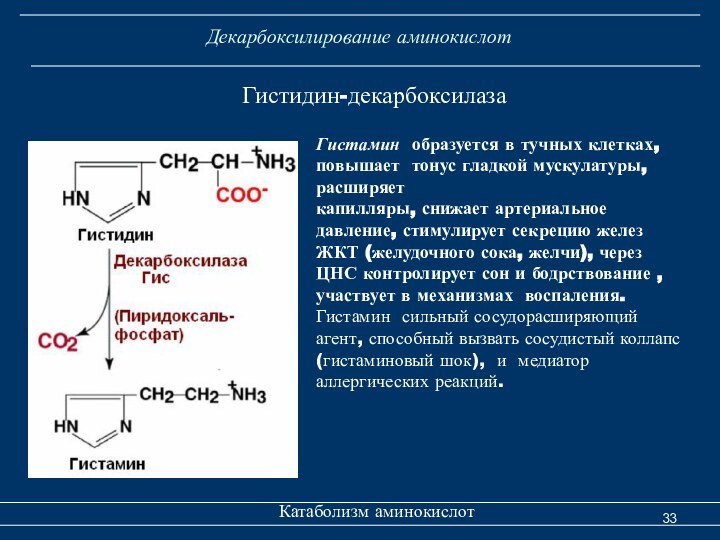
Декарбоксилирование аминокислот
Катаболизм аминокислот
Гистидин-декарбоксилаза
Гистамин образуется в тучных
клетках, повышает тонус гладкой мускулатуры, расширяет
капилляры, снижает артериальное давление,
стимулирует секрецию желез ЖКТ (желудочного сока, желчи), через ЦНС контролирует сон и бодрствование , участвует в механизмах воспаления. Гистамин сильный сосудорасширяющий агент, способный вызвать сосудистый коллапс (гистаминовый шок), и медиатор аллергических реакций.
Слайд 34
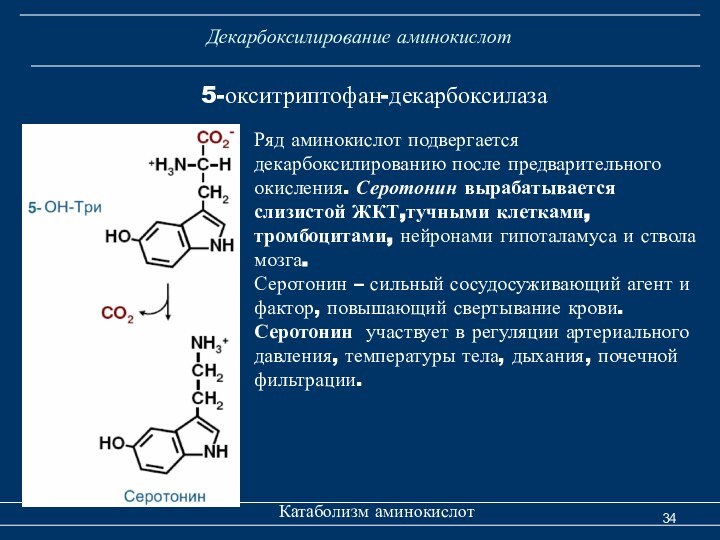
Декарбоксилирование аминокислот
Катаболизм аминокислот
5-окситриптофан-декарбоксилаза
Ряд аминокислот подвергается декарбоксилированию
после предварительного окисления. Серотонин вырабатывается слизистой ЖКТ,тучными клетками, тромбоцитами,
нейронами гипоталамуса и ствола мозга.Серотонин – сильный сосудосуживающий агент и фактор, повышающий свертывание крови. Серотонин участвует в регуляции артериального давления, температуры тела, дыхания, почечной фильтрации.
Слайд 35
Пути образования и детоксикации NH3
Катаболизм аминокислот
В
органах и тканях существуют специальные механизмы, предупреждающие накопление биогенных
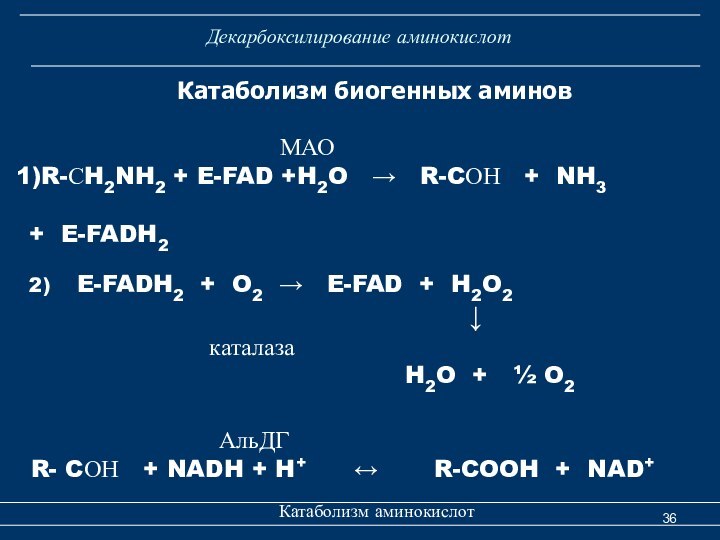
аминов. Основной путь инактивации биогенных аминов – окислительное дезаминирование с образованием аммиака – катализируется моно- и диаминооксидазами.Моноаминооксидаза (МАО) - FАD-содержащий фермент – осуществляет реакцию:
Катаболизм биогенных аминов
Слайд 36
Декарбоксилирование аминокислот
Катаболизм аминокислот
Катаболизм биогенных аминов
МАО
R-СH2NH2 + E-FAD +H2O → R-CОН + NH3
+ E-FADH2
2) E-FADH2 + O2 → E-FAD + H2O2
↓ каталаза
H2O + ½ O2
АльДГ
R- CОН + NADH + H+ ↔ R-COOH + NAD+