Слайд 2
Общая характеристика воды
Вода является самым распространенным
веществом на Земле;
Жизнь зародилась в воде, и
вода входит в состав всех живых организмов;
В организме взрослого человека содержание воды составляет 60-65 % или примерно 2/3;
Слайд 3
Биологические функции воды
Вода является универсальным растворителем,
в ней растворены почти все химические соединения, входящие в
состав живого организма;
Вода выполняет транспортную функцию: легко перемещаясь по пространствам организма, вода переносит растворенные в ней вещества;
Вода участвует в терморегуляции и способствует поддержанию у теплокровных организмов постоянной температуры;
Вода участвует в обмене веществ.
Слайд 4
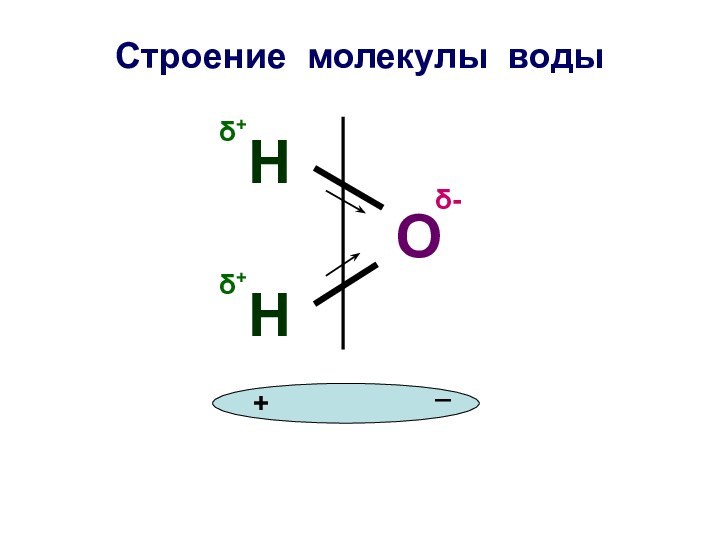
Строение молекулы воды
О
Н
Н
δ+
δ+
δ-
+
_
Слайд 5
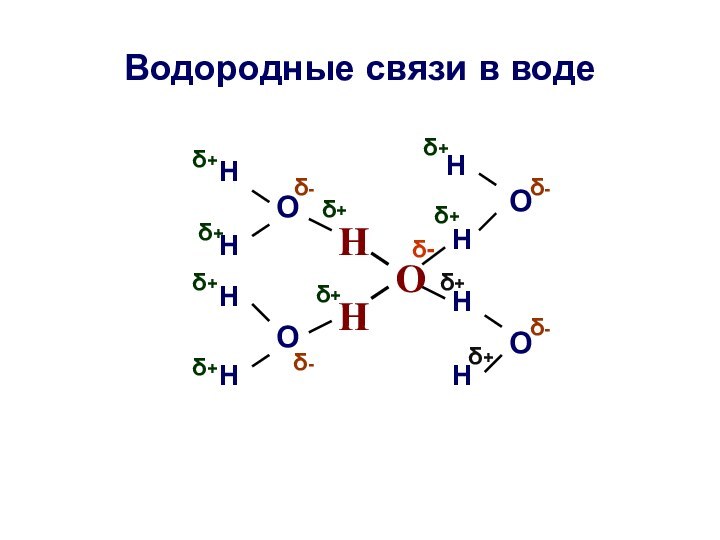
Водородные связи в воде
О
Н
Н
О
О
Н
Н
Н
Н
Н
Н
Н
О
Н
О
δ+
δ+
δ+
δ+
δ+
δ+
δ-
δ-
δ-
δ+
δ+
δ+
δ+
δ-
δ-
Слайд 6
Характеристика водородных связей
Водородные связи очень
непрочные: они в 10-12 раз слабее ковалентных связей;
Время существования водородных связей всего 1·10-10 - 1·10 -11 с;
Водородные связи обладают кооперативным эффектом (кооперативностью): при увеличения количества водородных связей их суммарная прочность резко возрастает;
Слайд 7
Количество водородных связей в воде зависит
от температуры;
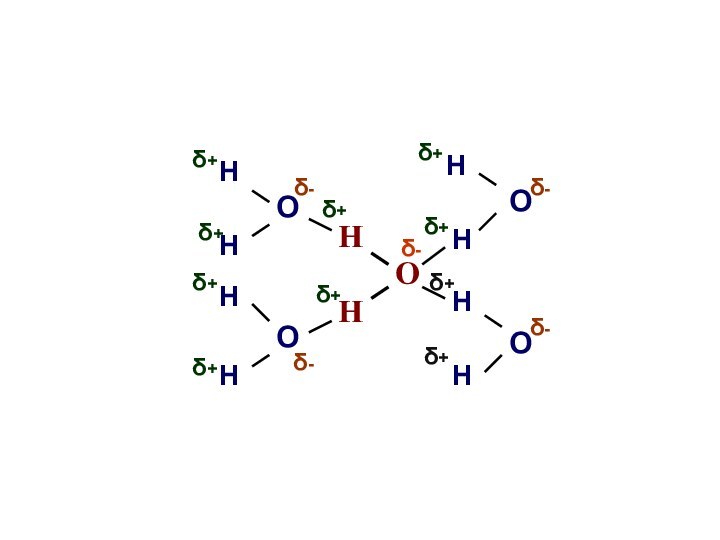
При 0°С каждая молекула воды образует водородные
связи с четырьмя соседними;
При повышение температуры количество водородных связей уменьшается, и при температуре 100°С водородные связи не образуются.
Слайд 8
Благодаря огромному количеству водородных связей у воды
имеется ряд уникальных свойств, отсутствующих у других жидкостей:
Высокая
теплоемкость;
Высокая теплопроводность;
Высокая температура кипения;
Большая теплота испарения
Слайд 9
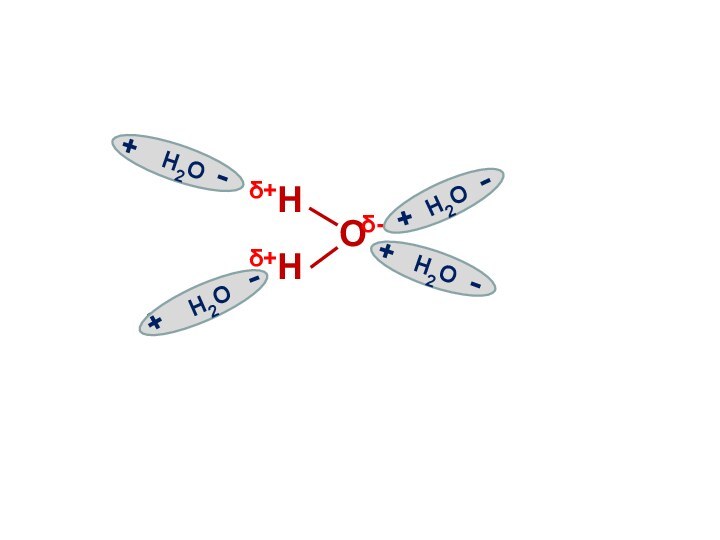
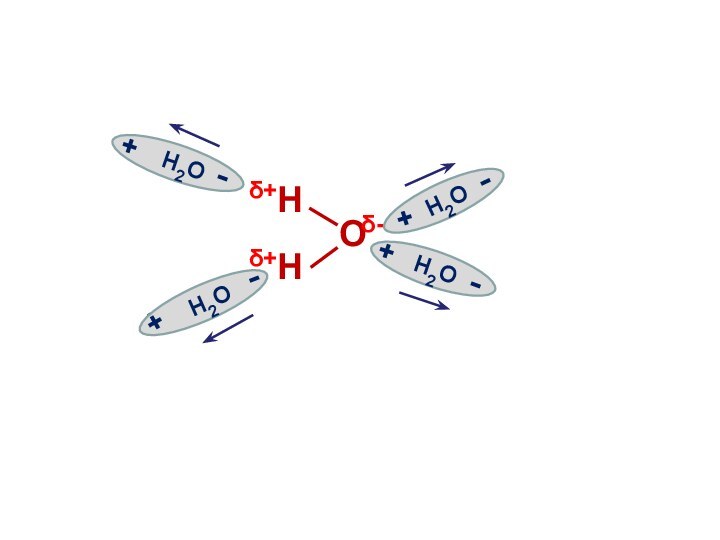
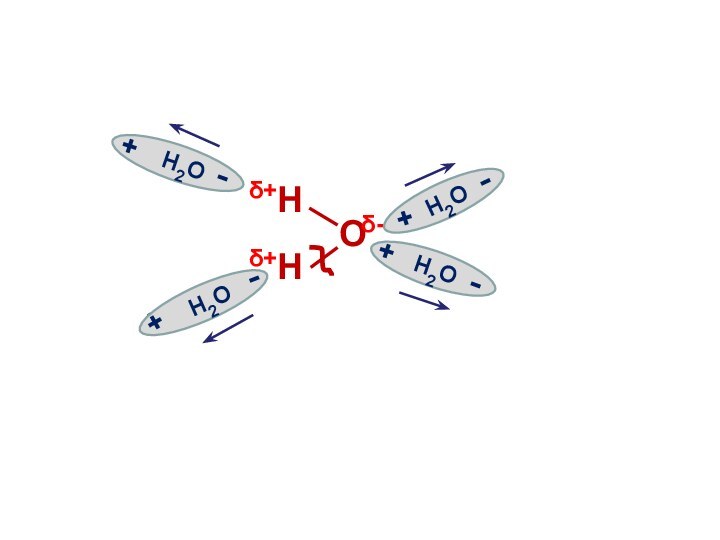
Электролитическая диссоциация воды
Вода является слабым электролитом
и подвергается расщеплению под действием соседних молекул с образованием
иона водорода и иона гидроксила:
Н2О Н+ + ОН-
Слайд 10
О
Н
Н
О
О
Н
Н
Н
Н
Н
Н
Н
О
Н
О
δ+
δ+
δ+
δ+
δ+
δ+
δ-
δ-
δ-
δ+
δ+
δ+
δ+
δ-
δ-
H2O
+
H2O
-
+
+
H2O
+
-
+
H2O
+
+
H2O
-
+
H2O
+
-
+
-
H
H
O
-
+
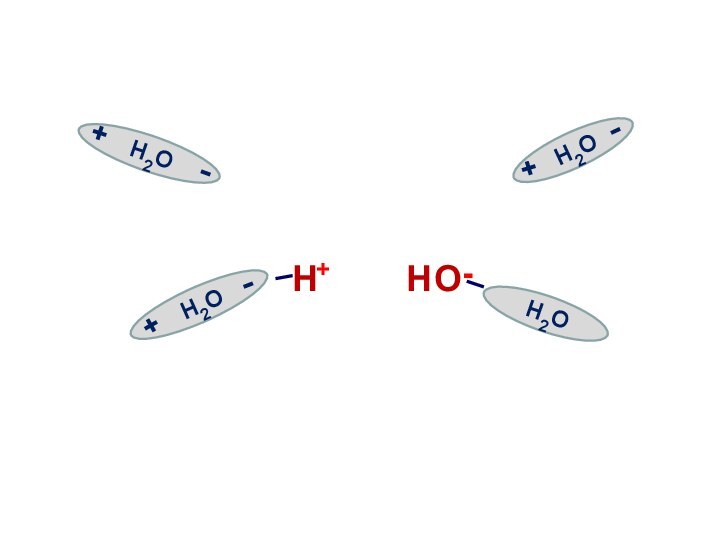
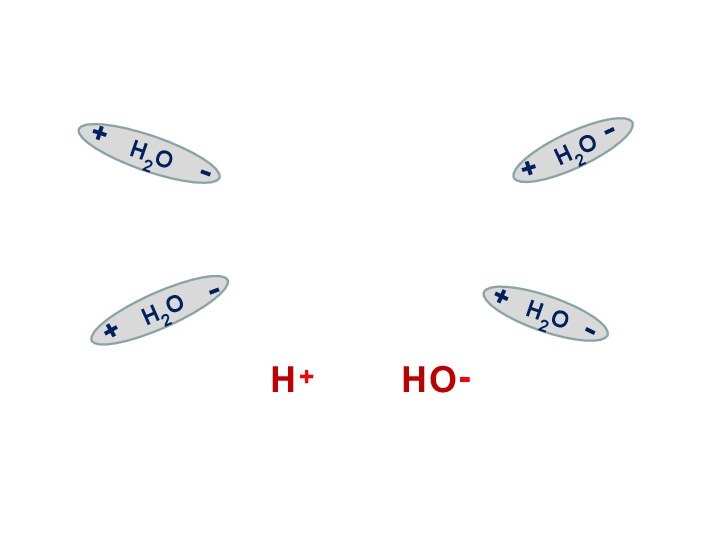
Н2О Н+ +
ОН-
55,5 моль/л
1·10-7 моль/л
1·10-7 моль/л
Слайд 17
Однако присутствие ионов водорода и гидроксила даже
в очень низких концентрациях существенно влияет на свойства воды
и водных растворов;
Для оценки содержания ионов водорода и гидроксила в воде и водных растворах используют соответственно водородный и гидроксильный показатели.
Слайд 18
Водородный показатель – это отрицательный десятичный
логарифм концентрации ионов водорода:
Водородный
показатель
= - lg [ H+]
- lg = p
= рН
Водородный
показатель
В дисциллированной воде концентрация ионов водорода равна 1·10-7 моль/л;
рН = - lg 1·10-7 = 7
Слайд 19
Гидроксильный показатель – это
отрицательный десятичный логарифм концентрации ионов гидроксила:
рОН =
- lg [ОH-]
В дисциллированной воде концентрация ионов гидроксила равна 1·10-7 моль/л
рОН = - lg 1·10-7 = 7
В нейтральной среде
рН = рОН = 7
Слайд 20
В воде и во всех водных растворах
рН +
рОН = 14
Ионное произведение воды:
[Н+] · [ОН-] = 1·10-7 ·1·10-7 = 1·10-14
Слайд 21
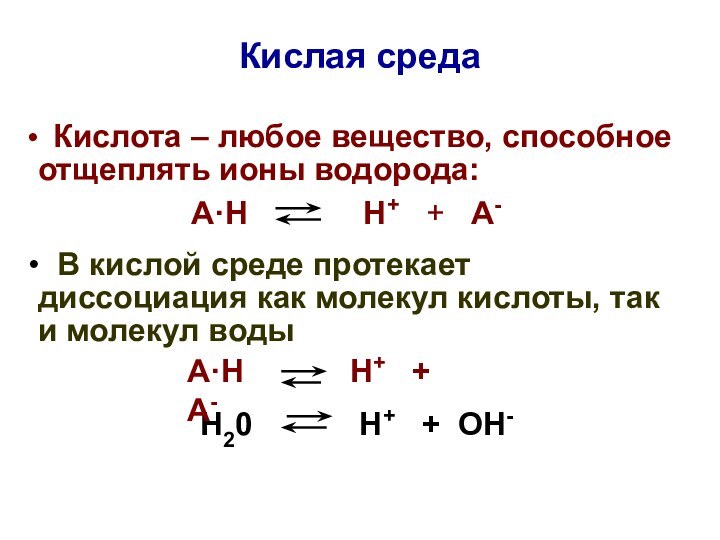
Кислая среда
Кислота – любое вещество, способное отщеплять
ионы водорода:
А·Н Н+ + А-
В кислой среде протекает диссоциация как молекул кислоты, так и молекул воды
Н20 Н+ + ОН-
А·Н Н+ + А-
В кислой среде:
[Н+]кисл > [Н+]нейтр
> 1·10-7 моль/л
рНкисл < рНнейтр < 7
Слайд 23
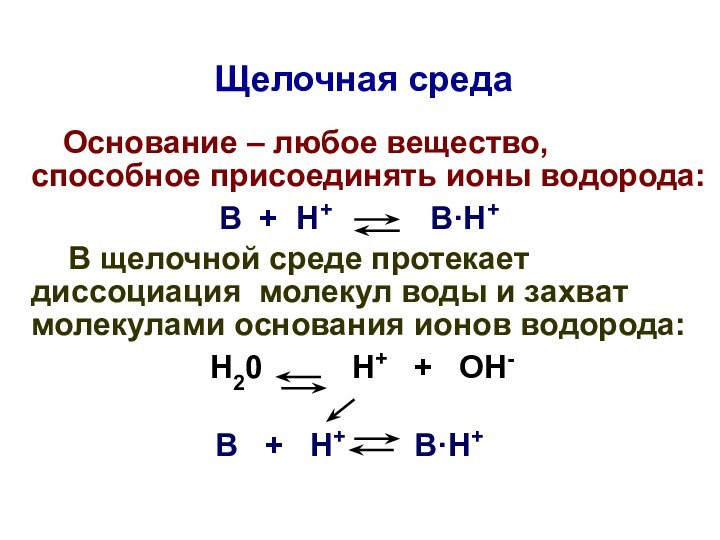
Щелочная среда
Основание – любое вещество,
способное присоединять ионы водорода:
В + Н+ В·Н+
В щелочной среде протекает диссоциация молекул воды и захват молекулами основания ионов водорода:
Н20 Н+ + ОН-
В + Н+ В·Н+
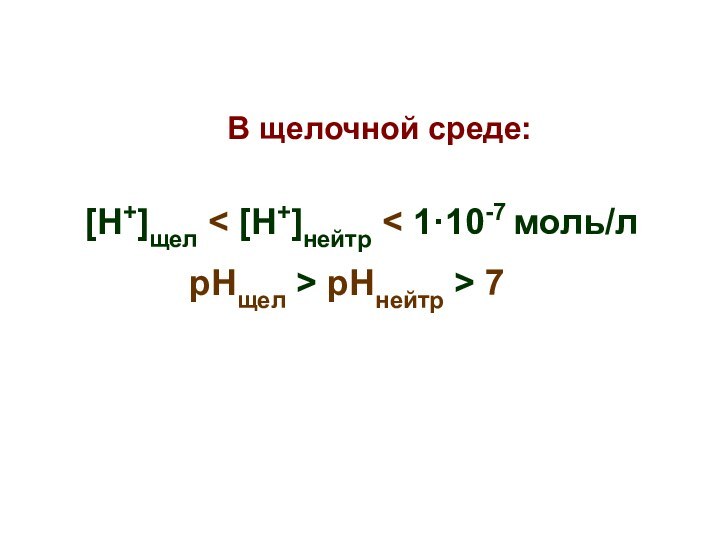
В щелочной среде:
[Н+]щел < [Н+]нейтр
< 1·10-7 моль/л
рНщел > рНнейтр > 7
Слайд 25
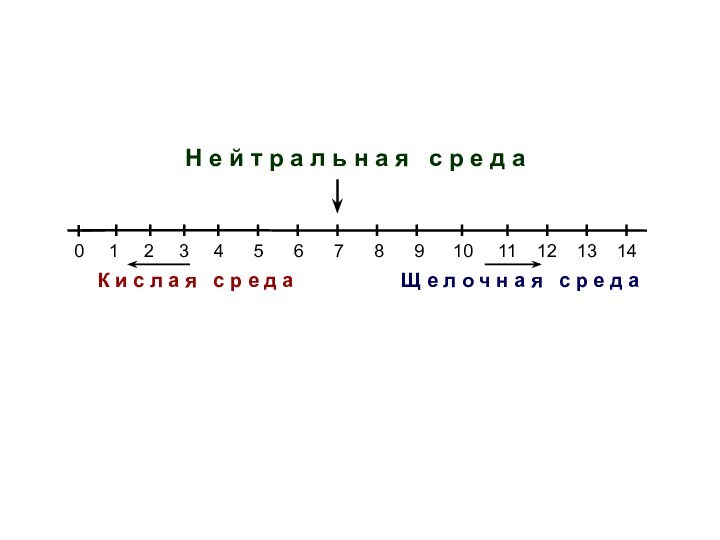
Изменению рН на одну единицу
соответствует повышение или снижение кислотности в 10 раз
3 4 5
6 7 8 9 10 11 12 13 14
Щ е л о ч н а я с р е д а
К и с л а я с р е д а
Н е й т р а л ь н а я с р е д а
Слайд 27
Методы определения рН
Индикаторные или колориметрические
Электрометрические
Слайд 28
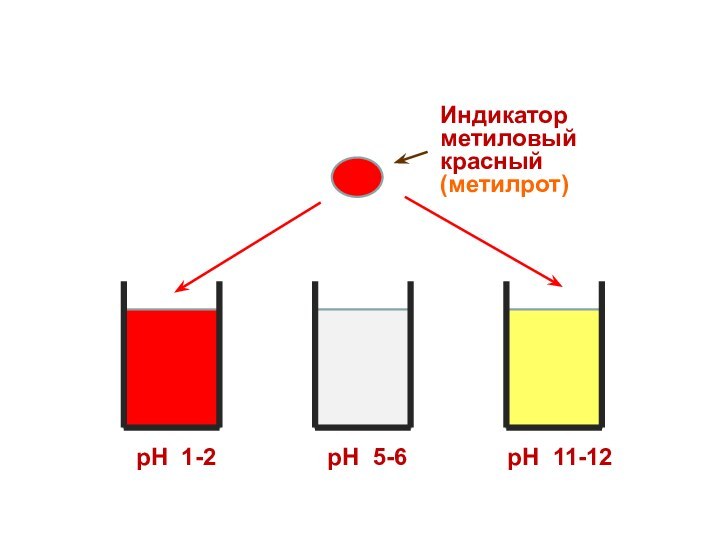
Индикатор – слабая органическая кислота или
основание, у которых диссоциированная и недиссоциированная формы имеют разную
окраску:
Соотношение между диссоциированной и недиссоциированной формами индикатора зависит от кислотности.
H Ind H+ + Ind-
.
Слайд 29
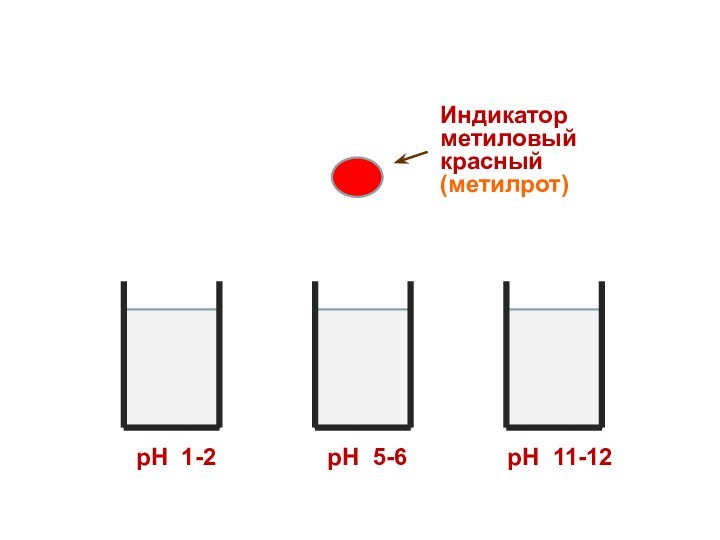
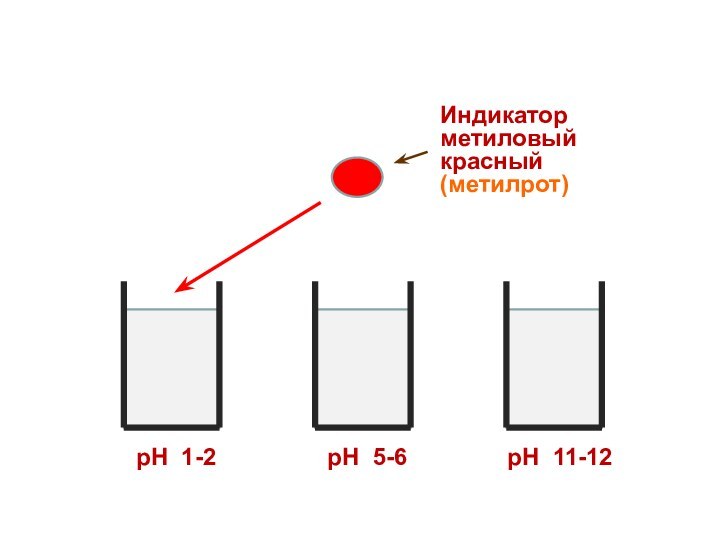
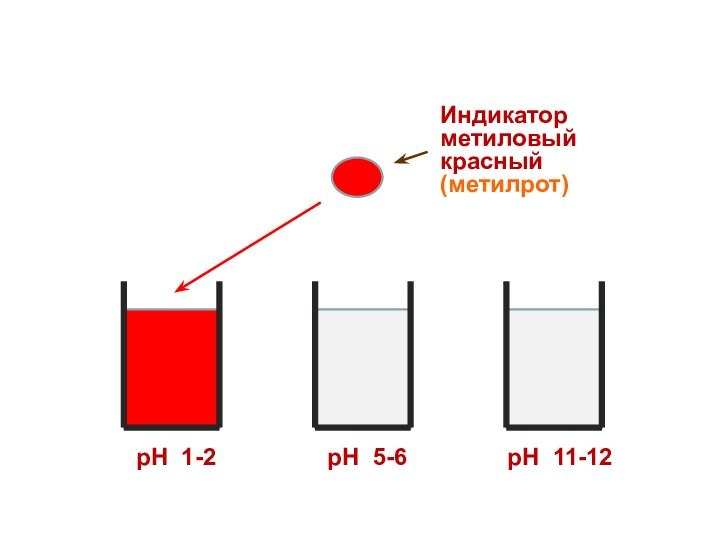
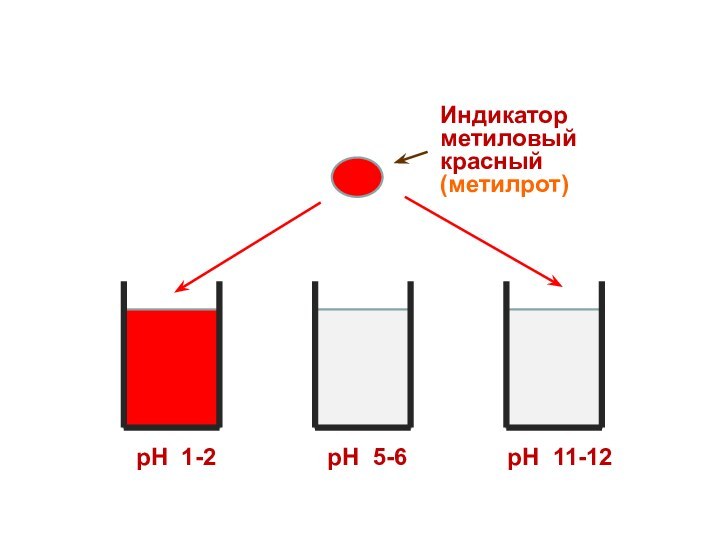
Поэтому каждому диапазону кислотности соответствует определенная
окраска индикатора.
Слайд 30
Индикатор
метиловый красный
(метилрот)
рН 1-2
рН 5-6
рН 11-12
Слайд 31
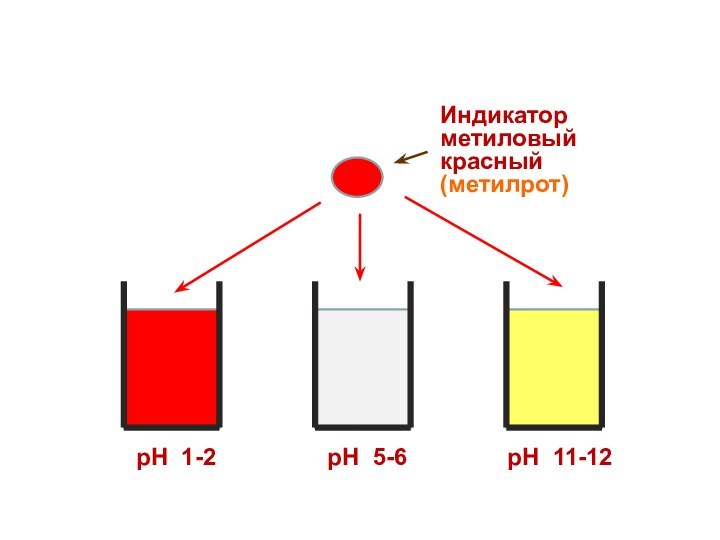
Индикатор
метиловый красный
(метилрот)
рН 1-2
рН 5-6
рН 11-12
Слайд 32
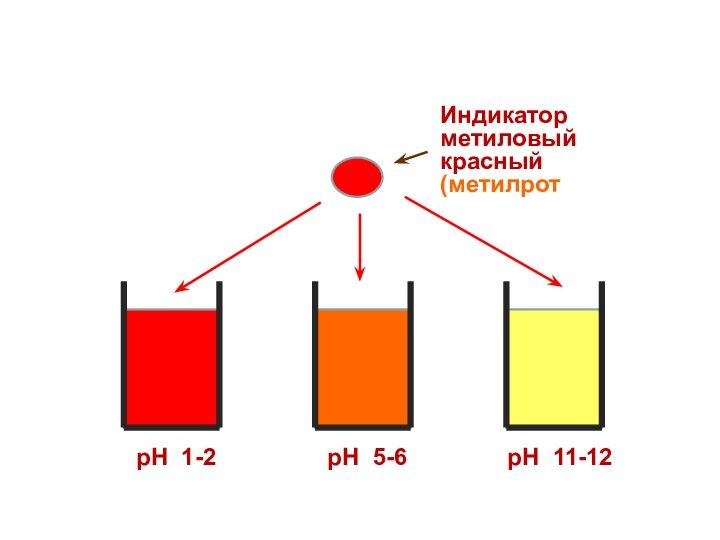
Индикатор
метиловый красный
(метилрот)
рН 1-2
рН 5-6
рН 11-12
Слайд 33
Индикатор
метиловый красный (метилрот)
рН 1-2
рН 5-6
рН 11-12
Слайд 34
Индикатор
метиловый красный
(метилрот)
рН 1-2
рН 5-6
рН 11-12
Слайд 35
рН 1-2
рН 5-6
рН 11-12
Индикатор
метиловый красный
(метилрот)
Слайд 36
рН 1-2
рН 5-6
рН 11-12
Индикатор
метиловый красный
(метилрот
Слайд 37
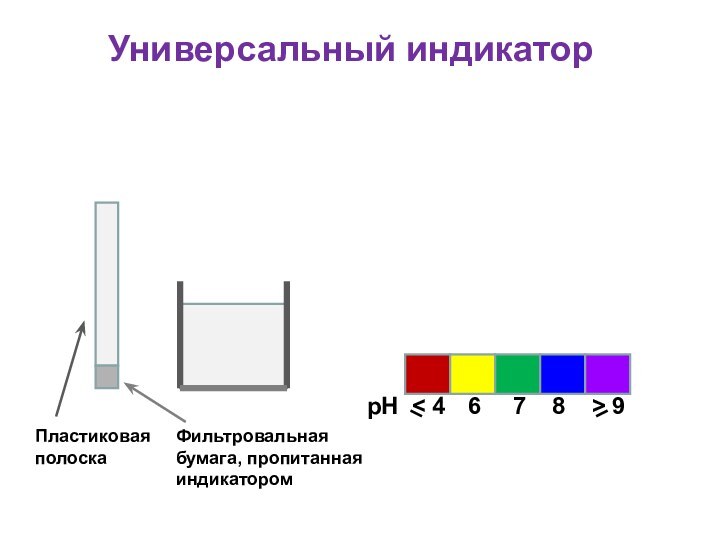
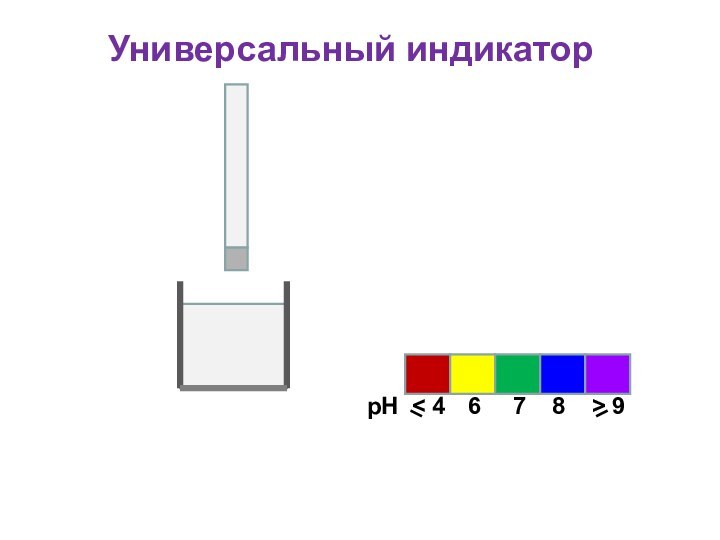
Универсальный индикатор
Для определения кислотности часто используется
универсальный индикатор, являющийся смесью нескольких индикаторов с разными зонами
перехода;
Универсальный индикатор последовательно меняет окраску от красной в кислой среде до фиолетовой в щелочной;
Каждому значению рН соответствует определенная окраска;
По цветной шкале находят величину рН
Слайд 38
Универсальный индикатор
рН
6
< 4
7
8
> 9
Пластиковая
полоска
Фильтровальная бумага, пропитанная индикатором
Слайд 39
Универсальный индикатор
рН
6
< 4
7
8
> 9
Слайд 40
Универсальный индикатор
рН
6
< 4
7
8
> 9
Слайд 41
Универсальный индикатор
рН
6
< 4
7
8
> 9
Слайд 42
Универсальный индикатор
рН
6
< 4
7
8
> 9
Слайд 43
Универсальный индикатор
рН
6
< 4
7
8
> 9
Слайд 44
Электрометрические методы
Измерение кислотности проводится с использованием
специальных приборов - рН-метров;
Главной частью рН-метра является
стеклянный электрод, электрический потенциал которого зависит от величины рН.
Слайд 45
Буферные растворы
Буферные растворы (буферные системы) – растворы
способные сохранять постоянное значение рН при добавлении кислоты или
щелочи;
Любой буферный раствор содержит два компонента: кислотный и оснόвный:
Слайд 46
Кислотный компонент – слабая кислота, предназначенная
для нейтрализации щелочей;
Оснόвный компонент – слабое основание,
предназначенное для нейтрализации кислот;
Часто это соль слабой кислоты и сильного основания, обладающая оснόвными свойствами.
Слайд 47
Бикарбонатный буфер
В состав бикарбонатного буфера входит
угольная кислота (слабая кислота) и бикарбонат натрия (слабое основание):
H2CO3
NaHCO3
Слайд 48
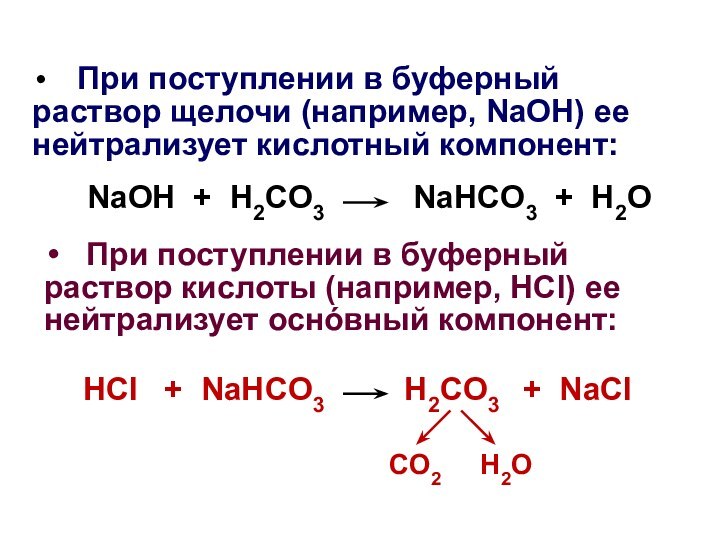
При поступлении в буферный раствор щелочи
(например, NaOH) ее нейтрализует кислотный компонент:
NaOH + H2CO3 NaHCO3 + H2O
При поступлении в буферный раствор кислоты (например, HCl) ее нейтрализует оснόвный компонент:
HCl + NaHCO3 H2CO3 + NaCl
CO2 H2O
Слайд 49
Буферная емкость
Эффективность буферного действия оценивается буферной
емкостью;
Буферная емкость – количество молей сильной кислоты (например,
HCl) или сильной щелочи (например, NaOH) , которое необходимо добавить к 1 л буферного раствора для изменения рН на одну единицу.
Слайд 50
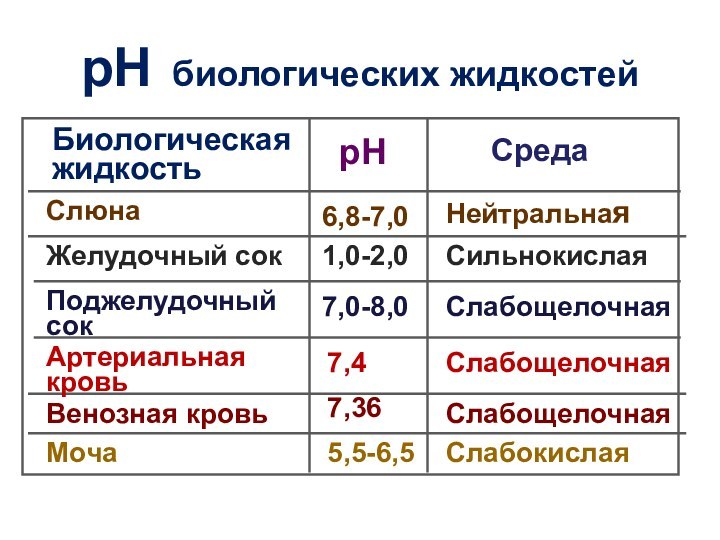
рН биологических жидкостей
Биологическая
жидкость
рН
Среда
Слюна
6,8-7,0
Нейтральная
Желудочный сок
1,0-2,0
Сильнокислая
Поджелудочный
сок
7,0-8,0
Слабощелочная
Артериальная кровь
Венозная кровь
7,4
Слабощелочная
7,36
Слабощелочная
Моча
5,5-6,5
Слабокислая
Тест 1
Содержание
воды в организме
взрослого человека
а) 10-20 %
б) 30-40 %
в) 60-70 %
г) 80-90 %
Тест 2
Молекулы воды соединяются друг с другом:
а) водородными связями
б) донорно-акцепторными
в) ионными связями
г) металлическими связями
Слайд 53
Тест 3
Концентрация ионов гидроксила в дистиллированной воде равна:
а) 1·10-2 моль/л
б) 1·10-7
моль/л
в) 1·10-12 моль/л
г) 1·10-14 моль/ л
Слайд 54
Тест 4
Концентрация ионов водорода в дистиллированной воде равна:
а) 1·10-2 моль/л
б) 1·10-7
моль/л
в) 1·10-12 моль/л
г) 1·10-14 моль/л