- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по физике Основы молекулярно-кинетической теории
Содержание
- 2. Основные положения МКТМолекула – наименьшая
- 3. Основные положения МКТВсе макроскопические тела состоят из
- 4. Экспериментальное обоснование положений МКТДоказательства: механическое дробление телрастворение
- 5. Экспериментальное обоснование положений МКТДиффузией называется самопроизвольное проникновение
- 6. Экспериментальное обоснование положений МКТИспарение – переход вещества
- 7. Опыт Штерна частота вращения: v = 1500 с–1угол
- 8. Распределение БольцманаДемонстрационная модель "Распределение Больцмана" может использоваться
- 9. Броуновское движениеР. Броун в 1827 г. наблюдал под микроскопом
- 10. Опыт ПерренаИзучение движения таких частиц нерастворимых в воде
- 11. Количество вещества, число Авогадро, молярная массаКоличество вещества –
- 12. Количество вещества, число Авогадро, молярная масса
- 13. Молярная массаМолярная масса M равна массе вещества, взятого в
- 15. Масса и размер молекулМасса молекулы может быть рассчитана
- 16. Агрегатные состояния вещества Агрегатные состояния вещества – это состояния
- 17. Методические указания по решению задачЗадачи этой темы
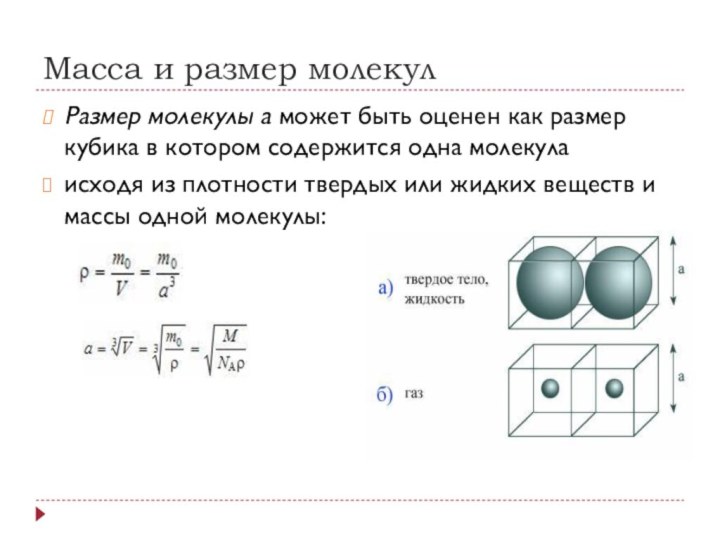
- 18. Масса и размер молекулРазмер молекулы a может быть оценен
- 19. Примеры решения задачЗадача 1В стакане находится 100
- 20. Задача 1
- 21. Задача 2Считая, что в жидкости молекулы расположены
- 22. Задача 2
- 23. Задача 3Определите число молекул, содержащихся в 1м3
- 24. Скачать презентацию
- 25. Похожие презентации
Основные положения МКТМолекула – наименьшая устойчивая частица какого-либо вещества, обладающая его химическими свойствами.Планетарная модель строения атома:




















Слайд 2
Основные положения МКТ
Молекула – наименьшая устойчивая частица
какого-либо вещества, обладающая его химическими свойствами.
Слайд 3
Основные положения МКТ
Все макроскопические тела состоят из частиц
– атомов и молекул.
Частицы вещества взаимодействуют между собой: притягиваются
и отталкиваются.Частицы вещества находятся в непрерывном хаотическом движении.
Слайд 4
Экспериментальное обоснование положений МКТ
Доказательства:
механическое дробление тел
растворение
диффузия
давление
газов
способность газов неограниченно расширяться
упругость газов, жидкостей, твёрдых тел
броуновское движение
испарение
и конденсацияи т. д.
Слайд 5
Экспериментальное обоснование положений МКТ
Диффузией называется самопроизвольное проникновение соприкасающихся
веществ друг в друга. В этом случае причиной перемешивания
веществ является тепловое движение их частиц.Можно рассматривать
диффузию собственных частиц
какого-либо тела, т.е. самодиффузию.
Ресурсы по физике заочной физико-математической школы Томского государственного университета
Молекулярная физика, термодинамика Диффузия
Слайд 6
Экспериментальное обоснование положений МКТ
Испарение – переход вещества из
жидкого состояния в газообразное со свободной поверхности жидкости.
Конденсация –
переход вещества из газообразного состояния в жидкое.Давление газа как явление проявляется в перемещении некоторой массы газа (ветер), деформации мембран и стенок сосудов. Трактуется как совокупность ударов невидимых частиц, которые действуют на препятствие как поток камней или брызги воды.
Слайд 7
Опыт Штерна
частота вращения: v = 1500 с–1
угол поворота внешнего
цилиндра: j = 2p ν t
смещение точек А и В: s = R2j =
2p ν R2tОпыт Штерна
Слайд 8
Распределение Больцмана
Демонстрационная модель "Распределение Больцмана" может использоваться как
в традиционном, так и в углубленном курсе физики при
рассмотрении тем, посвященных распределению молекул по скоростям и, в частности, распределению Больцмана. В модели условно представлен процесс движения молекул в поле силы тяжести.
Слайд 9
Броуновское движение
Р. Броун в 1827 г. наблюдал под микроскопом беспорядочное
движение мелких частиц цветочной пыльцы, взвешенных в жидкости.
Современная
теория объясняет броуновское движение – беспорядочное движение мелких частиц, взвешенных в жидкости или газе, непрерывными беспорядочными соударениями этих частиц с молекулами жидкости (газа).Демонстрационная модель
"Броуновское движение"
Лабораторная работа
Слайд 10
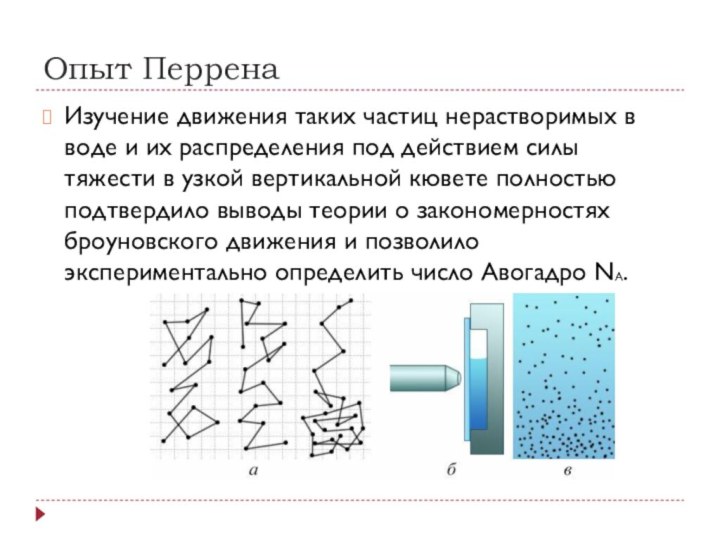
Опыт Перрена
Изучение движения таких частиц нерастворимых в воде и
их распределения под действием силы тяжести в узкой вертикальной
кювете полностью подтвердило выводы теории о закономерностях броуновского движения и позволило экспериментально определить число Авогадро NА.
Слайд 11
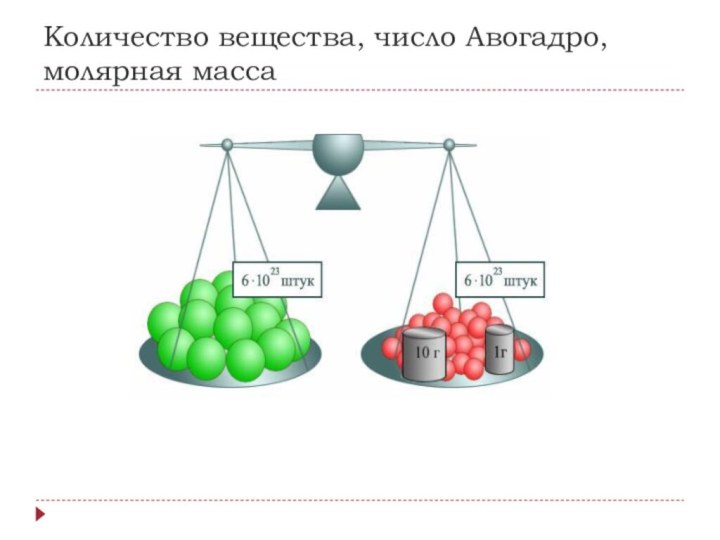
Количество вещества, число Авогадро, молярная масса
Количество вещества – это
физическая величина, характеризующая число структурных единиц в теле (атомов
в атомарном веществе, молекул – в молекулярном)Единицей количества вещества в СИ является моль. Один моль (1 моль) равен количеству вещества, в котором содержится столько же атомов или молекул, сколько атомов содержится в чистом углероде массой 0,012 кг. Такое число атомов называется числом Авогадро. Оно равно
NА = 6,02·1023 моль-1
Количество вещества равно отношению числа частиц в теле (атомов – в атомарном веществе, молекул – в молекулярном) к числу молекул в одном моле вещества, т.е. к числу Авогадро:
ν = N/NА
Слайд 13
Молярная масса
Молярная масса M равна массе вещества, взятого в количестве
одного моля.
Единица молярной массы – кг/моль.
М = 0,012 + 0,016·2
= 0,044 кг/мольM = m0NА
Масса m любого количества вещества, содержащего N молекул, равна
m = m0N= (N/NА) m0NА = ν M,
где количество вещества (в молях) ν = m / M.
Слайд 15
Масса и размер молекул
Масса молекулы может быть рассчитана на
основе молярной массы и числа Авогадро:
m0 = M / NА
Масса одного
атома водорода - 1,67·10–27 кг,молекулы водорода Н2 в 2 раза больше
масса атома углерода в 12 раз
молекулы кислорода в 32 раза
больше массы атома водорода.
Слайд 16
Агрегатные состояния вещества
Агрегатные состояния вещества – это состояния одного
и того же вещества, переходы между которыми сопровождаются скачкообразным
изменением плотности и других физических характеристик.Внешними отличительные : сжимаемость (изменение объема) и текучесть (сохранение формы).
С точки зрения МКТ различаются:
по значению среднего расстояния между молекулами
характеру движения молекул друг относительно друга.
Слайд 17
Методические указания по решению задач
Задачи этой темы можно
условно разделить на следующие группы:
а) определение и сравнение
размеров молекул и расстояний между нимиб) вычисление массы молекул, молярной массы вещества, количества вещества