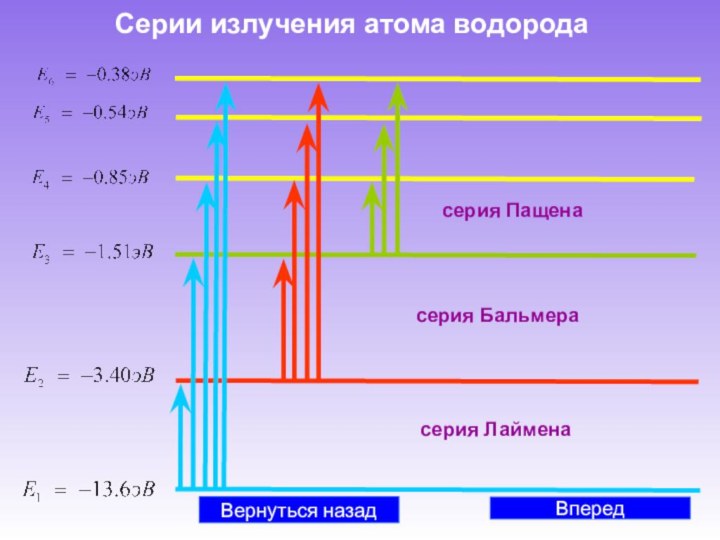
Английский физик, член Лондонского
королевского общества (с 1884, в 1915–20 – президент). В 1884–19 профессор Кембриджского университета и руководитель Кавендишской лаборатории; одновременно в 1905–18 профессор Королевского института в Лондоне. Ранние работы Томсона посвящены вычислению электромагнитного поля движущегося заряженного шара, теории вихрей, прецизионному измерению отношения абсолютных электрических единиц к электромагнитным. Занимаясь изучением газового разряда, Томсон совместно с сотрудниками выполнил серию классических работ, приведших к открытию электрона (впервые измерил отношение заряда электрона к массе, 1897; Нобелевская премия, 1906). Томсон дал объяснение непрерывного спектра рентгеновского излучения, установил природу положительных ионов, предложил первую модель строения атома. В 1911 Томсон разработал так называемый метод парабол для измерения отношения заряда частицы к ее массе, который сыграл большую роль в исследовании изотопов.
Большое значение имела научно-организационная деятельность Томсона. Возглавляемая им Кавендишская лаборатория превратилась в ведущий научно-исследовательский физический центр, в котором под его руководством работали крупнейшие английские физики (Э. Резерфорд, Ч. Вильсон, Ф. У. Астон, У. Ричардсон и др.). Будучи убежденным сторонником классической физики, Томсон придерживался гипотезы эфира.
Вернуться назад