- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по физике бинарный урок Строение атома(11 класс)
Содержание
- 2. «… Про опыты начальныеИ про умы пытливые,Про
- 3. Цель: Познакомиться с теорией строения атома
- 4. “Отыщи всему начало и ты многое
- 5. Модели атома Философы полагают, что
- 6. РОССИЯ 1888 год Чичерин Борис Николаевич (1828
- 7. ФРАНЦИЯ 1901 год Жан Батист Перрен атом
- 8. АНГЛИЯ 1902 год Уильям Томсон Атом облако
- 9. 1904 год Джозеф-Джон Томсон 1856 - 1940
- 10. ГЕРМАНИЯ 1904 год Филип Ленард 1862 -
- 11. ЯПОНИЯ 1904 год Хантаро Нагаока Атом уподоблялся
- 12. Чтобы окончательно решить вопрос о строении атома, необходим эксперимент. Как же устроен атом?
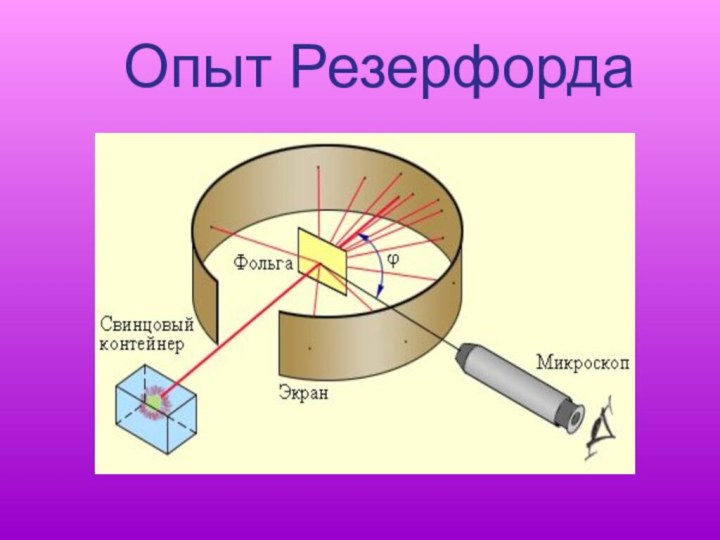
- 13. Опыт Резерфорда
- 14. Опыт Резерфорда++++++++Свинцовый контейнер++Золотая фольга источник α-частицЭКРАН+++++
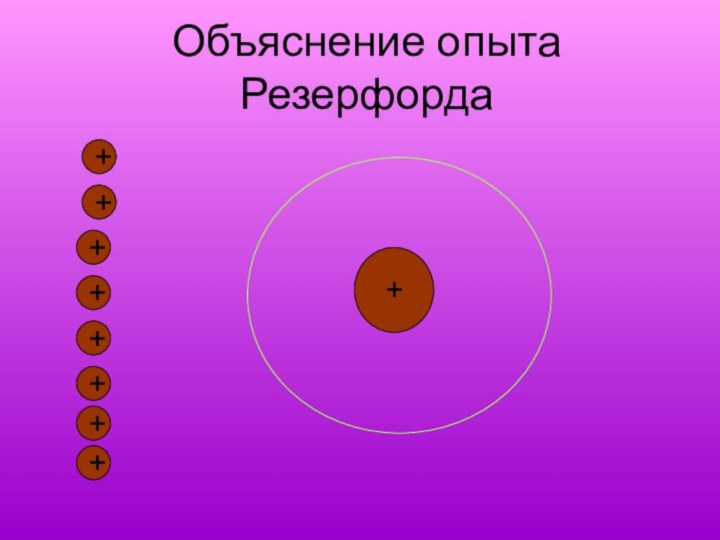
- 15. Объяснение опыта Резерфорда+++++++++
- 16. Медь-+Протон-Электрон-Нейтрон------Порядковый номер-29Атомная масса- 63,546=64Число протонов-29Число нейтронов-35Число электронов -29Как устроен атом по Резерфорду
- 17. Строение атома по Томсону и РезерфордуПланетарная модель
- 18. Атомное ядроАтомное ядро заряжено положительно. Его диаметр
- 19. Формула связи частиц в атомеЧисло протонов Z
- 20. Повторение.Определить число протонов , нейтронов и электронов.РФосфор1530,9748Р
- 21. Квантовые постулаты бора. Модель атома водорода по
- 22. Нильс Бор
- 23. n- номер орбиты, главное квантовое число
- 24. Постулаты БораАтомная система может находится только в
- 25. Второй постулат БораПри переходе электрона с орбиты
- 26. Определите энергию кванта который излучается при переходе
- 27. Определите сколько квантов с различной энергией может
- 28. орбитали и их формы
- 29. - Электронная оболочка – это совокупность электронов,
- 30. -Строение электронной оболочки.- Энергетический уровень состоит из
- 32. -Строение электронной оболочки.285- Орбиталь состоит из квантовых
- 33. Тема: Строение электронных оболочек атомов.Нарисуйте схемы строения
- 34. Тема: Строение электронных оболочек атомов.- Составить строение электронной оболочки элемента: В, Cl. В+5110231s21s22s22s22p12p1
- 35. Домашнее заданиеФизика: параграфы 64,65Химия:
- 36. ЕЩЁ, БЫТЬ МОЖЕТ, КАЖДЫЙ АТОМ –ВСЕЛЕННАЯ, ГДЕ
- 37. Сегодня на уроке я... научился… было интересно… было трудно… мои ощущения… больше всего понравилось...
- 38. Скачать презентацию
- 39. Похожие презентации





























Слайд 3 Цель: Познакомиться с теорией строения атома и
атомного ядра
Изучить две модели строения атома, их недостатки в
объяснении стабильности и сходства атомов.Выяснить, как постулаты Бора позволяют преодолеть трудности планетарной модели.
Изучить строение атома водорода по Бору.
. Рассмотреть строение электронных оболочек и научиться составлять электронные формулы атомов.
Задачи:
Слайд 5
Модели атома
Философы полагают, что факты
рождают идеи, и в некотором смысле это верно. Но
я нахожу в истории естествознания следующее: для того, чтобы понимать факты, необходимо иметь в голове определенные идеи и что глазами можно не увидеть того, что увидит разум.Ю. Либих
Слайд 6
РОССИЯ
1888 год
Чичерин Борис Николаевич (1828 -
1904)
Морозов Николай Александрович (1854 - 1946)
Атом сложная
система, состоящая из положительно заряженной центральной массы и окружающих ее отрицательных оболочек. Частицы с отрицательным зарядом (электроны) обладают, наибольшей подвижностью, а общее число оболочек возрастает с увеличением атомной массы элемента. Между центральной массой и вращающимися массами действует сила притяжения, подобная силе тяготения. Атом подобен солнечной системе.
Слайд 7
ФРАНЦИЯ
1901 год
Жан Батист Перрен
атом состоит
из «положительно заряженного ядра, окруженного отрицательными электронами, которые двигаются
по определенным «орбитам» со скоростями, соответствующими частотам световых волн».1870 - 1942
Слайд 8
АНГЛИЯ
1902 год
Уильям Томсон
Атом облако положительного
электричества с вкрапленными в него электронами, которые находятся в
некоторых устойчивых положениях, но могут смещаться и совершать колебания под действием внешнего электрического поля. Простейший атом — атом водорода представлял собой положительно заряженный шар, в центре которого находится электрон.
Слайд 9
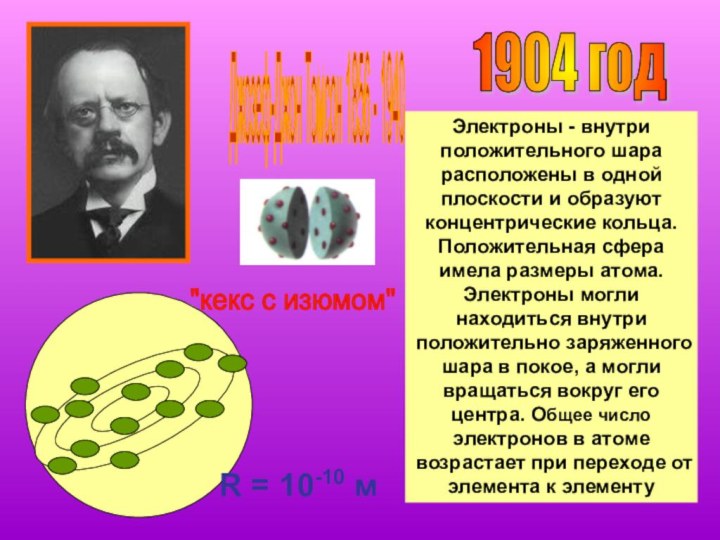
1904 год
Джозеф-Джон Томсон 1856 - 1940
Электроны
- внутри положительного шара расположены в одной плоскости и
образуют концентрические кольца. Положительная сфера имела размеры атома. Электроны могли находиться внутри положительно заряженного шара в покое, а могли вращаться вокруг его центра. Общее число электронов в атоме возрастает при переходе от элемента к элементу"кекс с изюмом"
R = 10-10 м
Слайд 10
ГЕРМАНИЯ
1904 год
Филип Ленард 1862 - 1947
Атом состоит из нейтральных частиц, каждая из которых является
электрическим дуплетом , частицы обладают очень малым радиусом и, следовательно, большая часть атома пуста.3*10-12 см
"динамиды"
Слайд 11
ЯПОНИЯ
1904 год
Хантаро Нагаока
Атом уподоблялся планете
Сатурн. Роль самой планеты играл положительно заряженный шар —основная
часть атома, вокруг которого, как расположенные в виде колец спутники Сатурна, вращаются электроны .
Слайд 12 Чтобы окончательно решить вопрос о строении атома, необходим
эксперимент.
Как же устроен атом?
Слайд 16
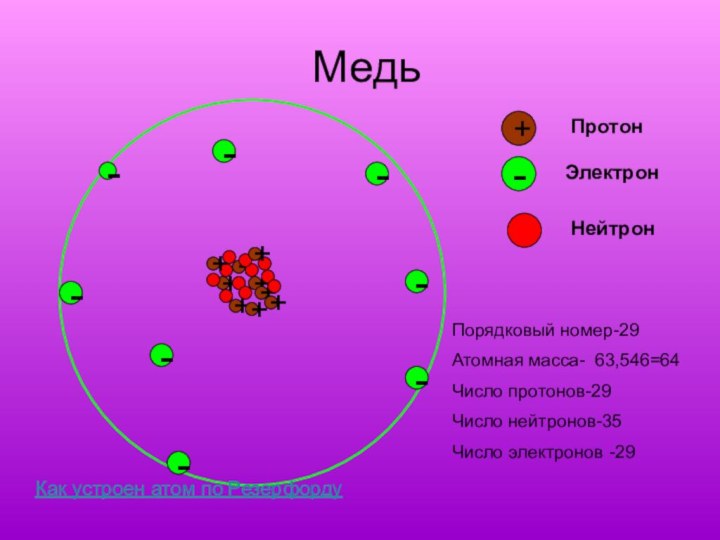
Медь
-
+
Протон
-
Электрон
-
Нейтрон
-
-
-
-
-
-
Порядковый номер-29
Атомная масса- 63,546=64
Число протонов-29
Число нейтронов-35
Число электронов -29
Как
устроен атом по Резерфорду
Слайд 17
Строение атома по Томсону и Резерфорду
Планетарная модель атома
Атом
– наименьшая частица химического элемента, являющаяся носителем его свойств.
Атом
состоит из ядра и движущихся вокруг него электронов. Отрицательно заряженные электроны удерживаются вблизи положительно заряженного ядра силами электромагнитного взаимодействия.Электрон – это частица, заряд которой отрицателен и равен по модулю элементарному заряду e = 1,6·10–19 Кл, а масса me = 9,1·10–31 кг.
Планетарную модель атома предложил Резерфорд в 1911 году
на основании своих исследований.
Слайд 18
Атомное ядро
Атомное ядро заряжено положительно. Его диаметр не
превышает 10–14–10–15 м, а заряд Q равен произведению элементарного
заряда электрона на порядковый номер атома Z в таблице Менделеева:Q = Z·e.
В настоящее время доказано, что атомное ядро состоит из протонов и нейтронов, удерживаемых ядерными силами. Протоны и нейтроны носят общее название нуклонов.
Протон – это частица, заряд которой положителен и равен по модулю заряду электрона: qp = +1,6·10–19 Кл, а масса mp = 1,6726·10–27 кг.
Нейтрон – это нейтральная частица, масса которой равна mn = 1,6749·10–27 кг.
Условное обозначение химического элемента позволяет легко определять состав ядра и число электронов в атоме. В ядре атома кислорода 168О находятся 8 протонов и 8 нейтронов
Слайд 19
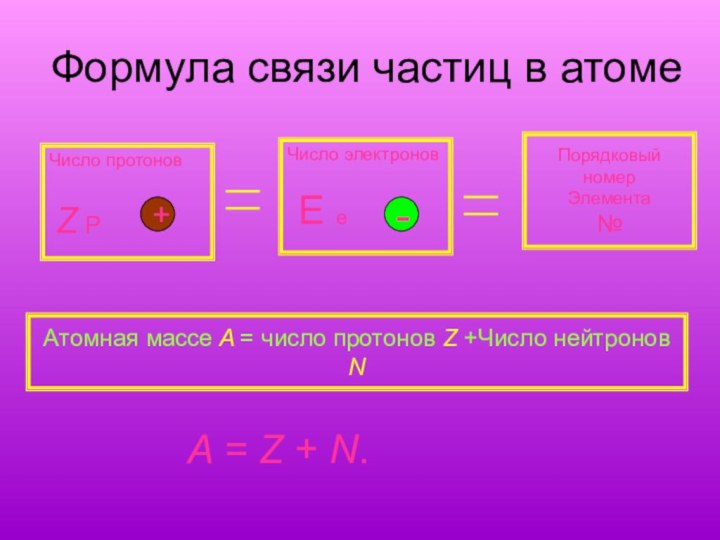
Формула связи частиц в атоме
Число протонов
Z
P
Число электронов
E e
Порядковый номер
Элемента
№
Атомная массе A
= число протонов Z +Число нейтронов NA = Z + N.
Слайд 20
Повторение.
Определить число протонов , нейтронов и электронов.
Р
Фосфор
15
30,9748
Р =
е
=
N =
Правила:
1. Порядковый номер элемента определяет заряд
ядра и равен числу протонов. (+15)
15
2. Атом в целом электронейтрален. Число протонов равно числу электронов .
15
(-15)
= 0
31
- 15 = 16
3. Масса атома складывается из числа протонов и нейтронов.
Р
+15
0
31
Вернуться к теме урока
Слайд 21
Квантовые постулаты бора. Модель атома водорода по бору.
Планетарная
модель атома, предложенная Резерфордом, – это попытка применения классических
представлений о движении тел к явлениям атомных масштабов. Эта попытка оказалась несостоятельной. Классический атом неустойчив. Электроны, движущиеся по орбите с ускорением, должны неизбежно упасть на ядро, растратив всю энергию на излучение электромагнитных волн
Слайд 24
Постулаты Бора
Атомная система может находится только в особых
стационарных, или квантовых, состояниях, каждому из которых соответствует определенная
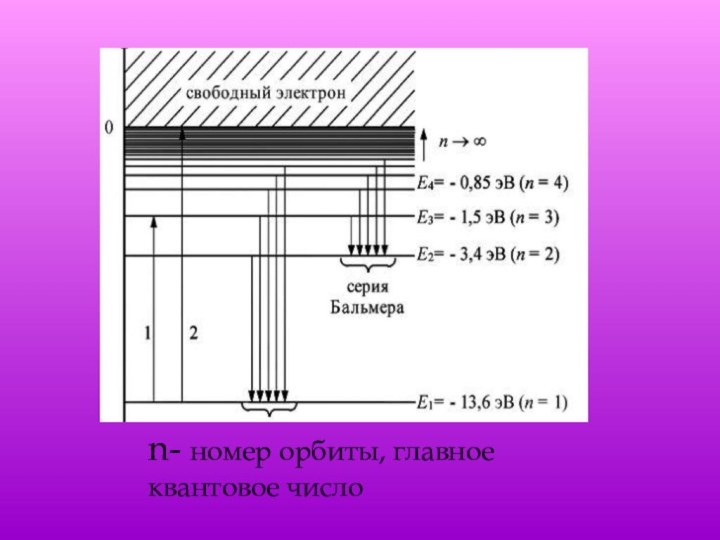
энергия En. В стационарном состоянии атом не излучаетИзлучение света происходит при переходе атома из стационарного состояния с большей энергией Em в стационарное состояние с меньшей энергией En. Энергия излученного фотона равна разности энергий стационарных состояний.
Слайд 25
Второй постулат Бора
При переходе электрона с орбиты с
более высокой энергией на орбиту с более низкой энергией
атом излучает квант энергии; при переходе электрона с орбиты с более низкой энергией на орбиту с более высокой энергией атом поглощает квант энергии.hν = Em - En
Слайд 26
Определите
энергию кванта который излучается при переходе электрона
с пятого энергетического уровня на третий.
энергию фотона для перехода
электрона с первого энергетического уровня на второй.
Слайд 27
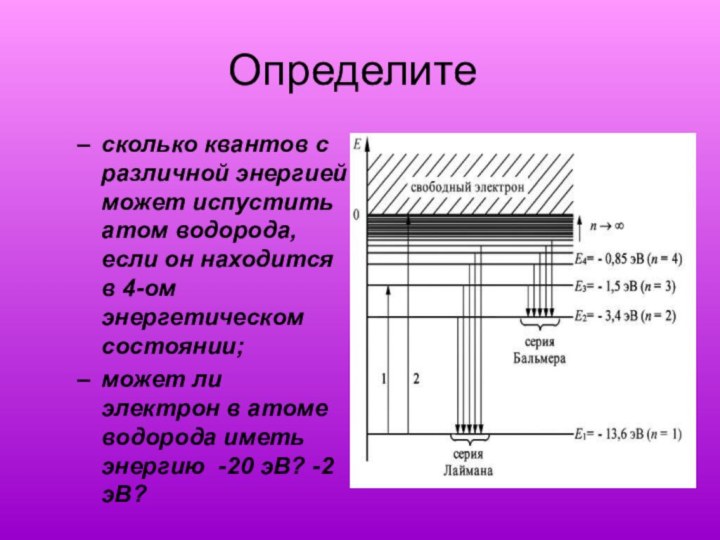
Определите
сколько квантов с различной энергией может испустить
атом водорода, если он находится в 4-ом энергетическом состоянии;
может
ли электрон в атоме водорода иметь энергию -20 эВ? -2 эВ?Слайд 29 - Электронная оболочка – это совокупность электронов, двигающихся
вокруг ядра атома.
Электроны в электронной оболочке располагаются на энергетических
уровнях.n – главное квантовое число – определяет число энергетических уровней .
Номер периода совпадает с числом энергетических уровней элемента.
Период
3
Группа
V
3
Число электронов (N) на уровне рассчитывается по формуле.
N = 2n2
n = 1, N = 2 . 12 = 2
2
n = 2, N = 2 . 22 = 8
8
Номер группы совпадает с числом электронов на последнем энергетическом уровне.
5
Общее число электронов
е =
15
Проверка
15
Слайд 30
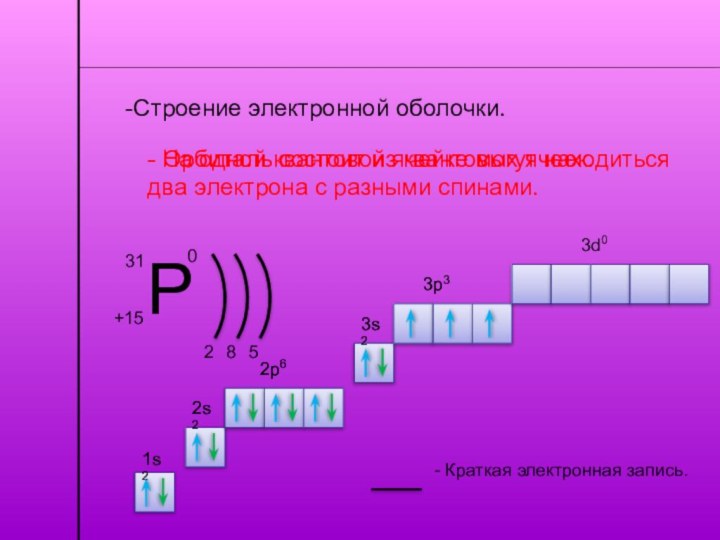
-Строение электронной оболочки.
- Энергетический уровень состоит из орбиталей.
2
8
5
Первый
уровень
s – орбиталь
Второй уровень
s – орбиталь
p – орбиталь
Третий уровень
s
– орбитальp – орбиталь
d – орбиталь
- Орбиталь состоит из квантовых ячеек.
квантовая
ячейка
Слайд 32
-Строение электронной оболочки.
2
8
5
- Орбиталь состоит из квантовых ячеек.
-
На одной квантовой ячейке могут находиться два электрона с
разными спинами.1s2
1s2
2s2
2s2
2p6
2p6
3s2
3s2
3p3
3p3
3d0
- Краткая электронная запись.
Слайд 33
Тема: Строение электронных оболочек атомов.
Нарисуйте схемы строения электронных
оболочек атомов: кислорода, натрия, водорода, кремния, углерода, гелия.
O
Na
H
Si
C
2
1
Hе
2
6
2
8
1
2
8
4
2
4
+8
0
0
0
0
0
0
+11
+1
+14
+6
+2
16
23
1
28
12
4
Слайд 34
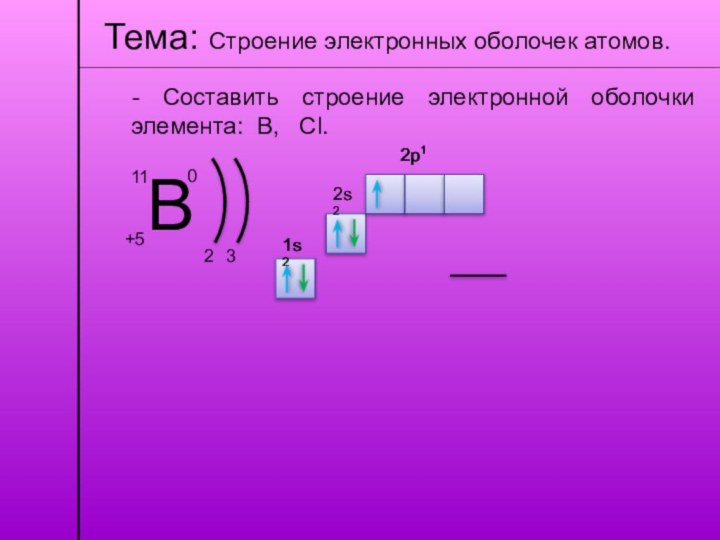
Тема: Строение электронных оболочек атомов.
- Составить строение электронной
оболочки элемента: В, Cl.
В
+5
11
0
2
3
1s2
1s2
2s2
2s2
2p1
2p1
Слайд 36
ЕЩЁ, БЫТЬ МОЖЕТ, КАЖДЫЙ АТОМ –
ВСЕЛЕННАЯ, ГДЕ СТО
ПЛАНЕТ,
ТАМ ВСЕ, ЧТО ЗДЕСЬ, В ОБЪЕМЕ СЖАТОМ,
НО ТАК ЖЕ
ТО, ЧЕГО ЗДЕСЬ НЕТ.»ВАЛЕРИЙ БРЮСОВ





























