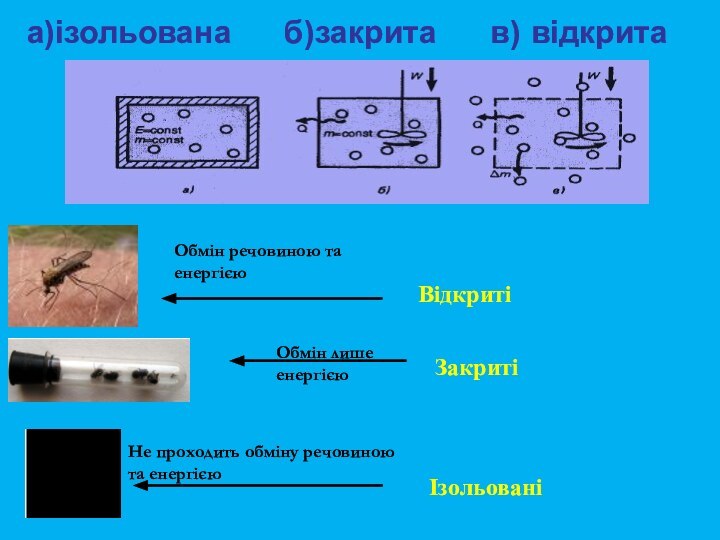
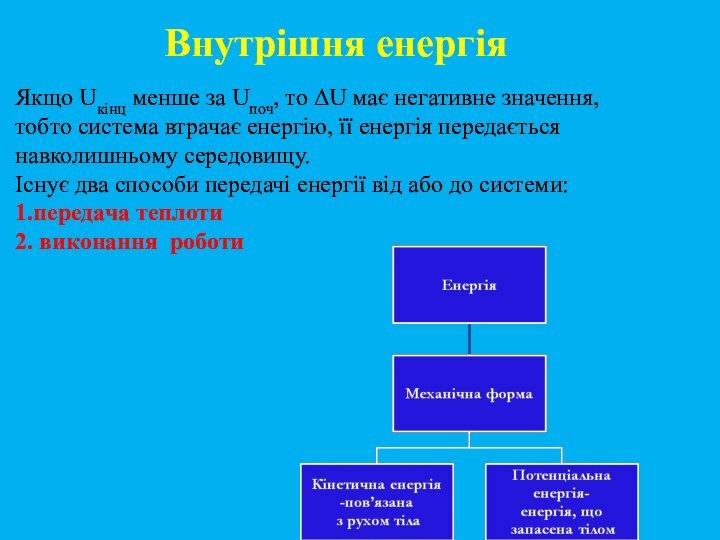
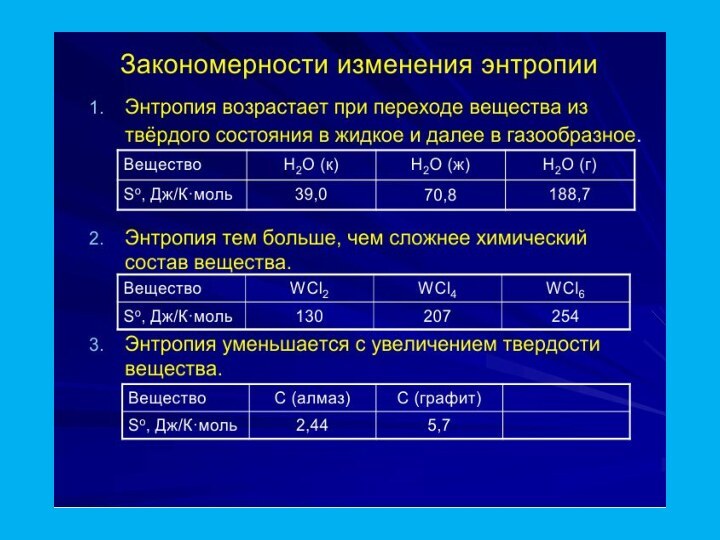
та здатність хімічних систем виконувати корисну роботу.
Завдання хімічної термодинаміки:
-попереднє
визначення того, чи можливе проходження хімічної реакції у результаті змішування двох різних речовин;-розрахунки кількості енергії, яка теоретично необхідна для проведення хімічної реакції, або повинна виділятись при самовільному проведенні хімічної реакції;
-передбачення до якого ступеня пройде реакція, перш ніж вона досягне стану рівноваги.