частицу и считали, что все многообразие мира есть не
что иное, как сочетание неизменных частиц – атомов.(Демокрит(Демокрит «существует предел деления атома», Аристотель « делимость вещества бесконечна»)
В XVIII веке трудами А. Лавуазье В XVIII веке трудами А. Лавуазье, М. В. Ломоносова была доказана реальность существования неделимой частицы - атома.
В 1833 году при исследовании явления электролиза М. Фарадей установил, что ток в растворе электролита - это упорядоченное движение заряженных частиц – ионов. Фарадей определил минимальный заряд иона, который был назван элементарным электрическим зарядом. Его приближенное значение оказалось равным e = 1,60·10–19 Кл.
В 1869 году Д. И. Менделеев разработал периодическую систему элементов, в которой впервые был поставлен вопрос о единой природе атомов.
1879 год - открытие катодных лучей.
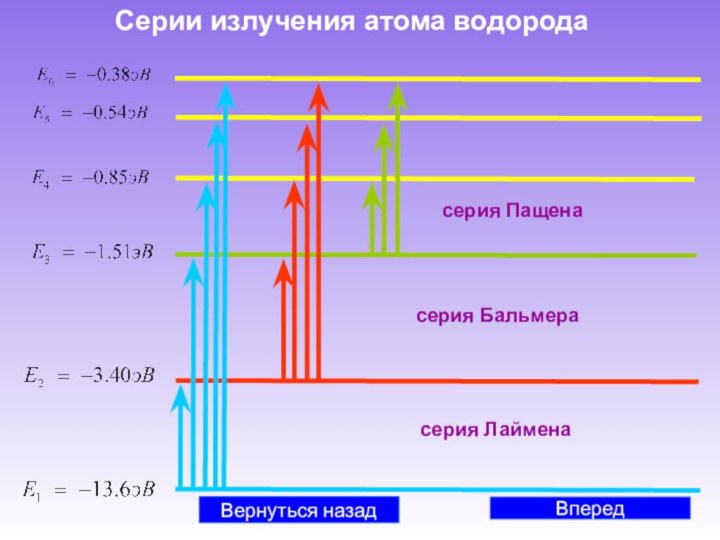
В начале XIX века были открыты дискретные спектральные линии в излучении атомов водорода в видимой части спектра. Впоследствии, в 1885 г., И. Бальмером были установлены математические закономерности, связывающие длины волн этих линий.
1895 год - открытие рентгеновских лучей.
В 1896 году А. Беккерель В 1896 году А. Беккерель обнаружил явление испускания атомами невидимых проникающих излучений, названное радиоактивностью.
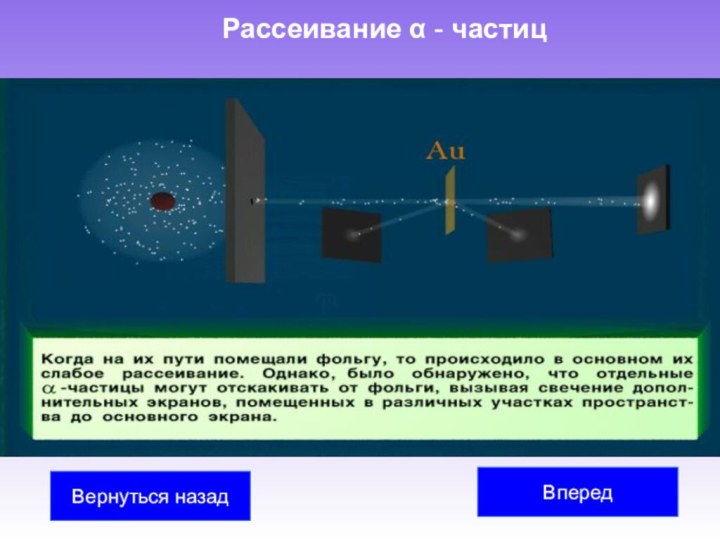
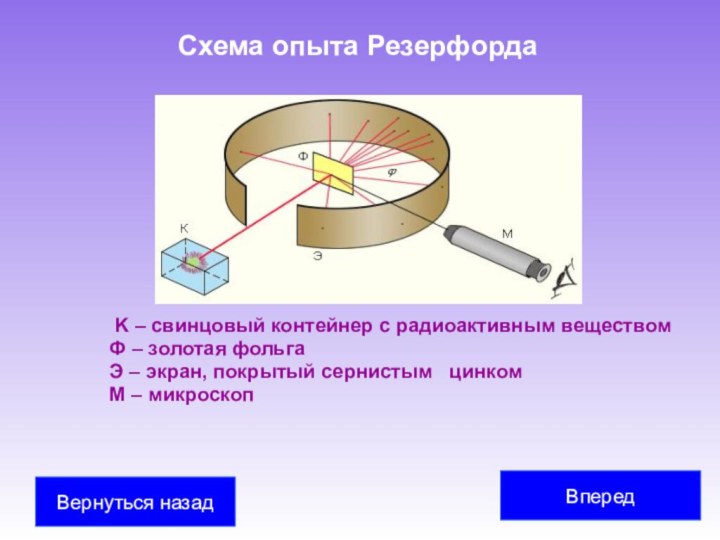
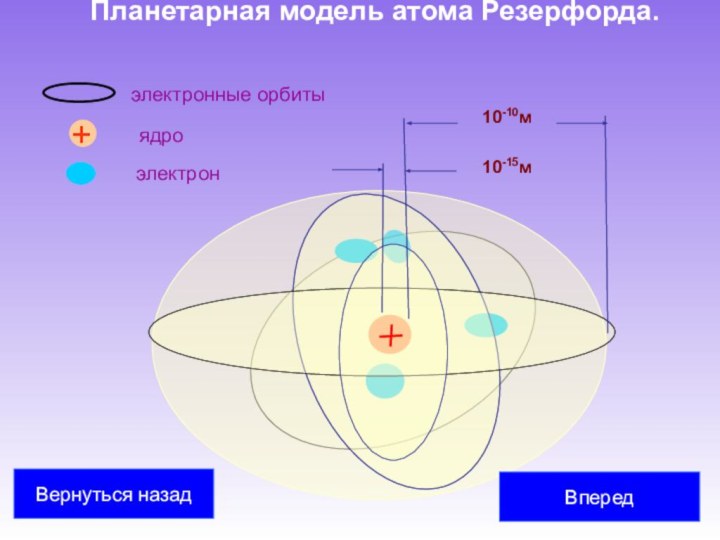
Учеными М. Склодовская-Кюри Учеными М. Склодовская-Кюри, П. Кюри Учеными М. Склодовская-Кюри, П. Кюри, Э. Резерфорд Учеными М. Склодовская-Кюри, П. Кюри, Э. Резерфорд было обнаружено, что атомы радиоактивных веществ испускают три вида излучений различной физической природы (альфа-, бета- и гамма-лучи).
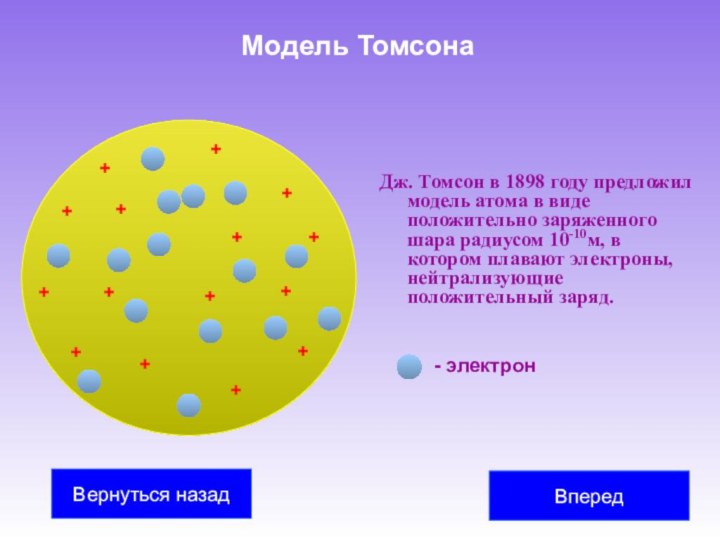
В 1897 году Дж. Томсон открыл электрон и измерил отношение e / m заряда электрона к массе. Опыты Томсона подтвердили вывод о том, что электроны входят в состав атомов.
Таким образом, на основании всех известных к началу XX века экспериментальных фактов можно было сделать вывод о том, что атомы вещества имеют сложное внутреннее строение. Они представляют собой электронейтральные системы, причем носителями отрицательного заряда атомов являются легкие электроны, масса которых составляет лишь малую долю массы атомов. Основная часть массы атомов связана с положительным зарядом.
Перед наукой встал вопрос о внутреннем строении атомов.
Вперед
Вернуться назад