- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Электрохимические методы. (Лекция 3)
Содержание
- 2. Преимущества ЭХ методовВысокая чувствительность (пределы определения до 10-9 г), воспроизводимость, возможностью автоматизации измерений,доступность измерительных приборов.
- 3. ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫпотенциометрические методы (измерение напряжения между электродами),
- 4. Сущность потенциометрического метода. Типы электродовУравнение НернстаЭлектрод сравнения
- 5. серебряный, ртутный, и водородный электроды Е =
- 6. Стеклянный электрод: Водород, растворенный в металле, образует
- 7. Потенциометрическое титрование точка стехиометричности устанавливается по изменению
- 8. Схема потенциометрической установки для определения ионов натрияв
- 9. Кулонометрия q/nF = т/М,
- 10. прямая кулонометрия Если исследуемый компонент восстанавливается на
- 11. ПОЛЯРОГРАФИЯРисунок 6.1 - Схема полярографической установки:I -
- 12. Основы полярографического метода анализа Eа -
- 13. Общая характеристика полярографической волны Восстановление Сd2+ происходит
- 14. Скачать презентацию
- 15. Похожие презентации
Преимущества ЭХ методовВысокая чувствительность (пределы определения до 10-9 г), воспроизводимость, возможностью автоматизации измерений,доступность измерительных приборов.













Слайд 3
ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ
потенциометрические методы (измерение напряжения между электродами),
полярография
(измерение силы тока в процессе электролиза),
кондуктометрия (измерение электропроводности),
кулонометрия (измерение количества электричества), выделении исследуемого элемента в виде простого вещества путем электролиза (электрогравиметрия)
Слайд 4
Сущность потенциометрического метода. Типы электродов
Уравнение
Нернста
Электрод сравнения хлорсеребряный:
1
- серебряная проволока 1 - асбестовое волокно
2 - хлорид
серебра 2 - раствор KCl (насыщенный)3 - раствор KCl (насыщенный) 3 - отверстие для контакта
4 – асбестовое волокно 4 - раствор KCl (насыщенный), AgCl (тв.)
5 - отверстие для ввода раствора KCl
Слайд 5
серебряный, ртутный, и водородный электроды
Е = 0,059
lg аH+, откуда
Е = -0,059paH+ (или -0,059 рН).
Мn+ + ne ↔ M
Н2 ↔ 2Н+ + 2е.
Слайд 6
Стеклянный электрод:
Водород, растворенный в металле, образует с катионами
Н+ окислительно-восстановительную систему:
1 – стеклянная мембрана
2 - внутренний
раствор3 - вспомогательный электрод (хлорсеребряный)
4 - стеклянный корпус
5 – токоподвод
Н2 ↔ 2Н+ + 2е.
Слайд 7
Потенциометрическое титрование
точка стехиометричности устанавливается по изменению потенциала
индикаторного электрода, обусловленному изменением концентрации одного из реагирующих компонентов.
Слайд 8
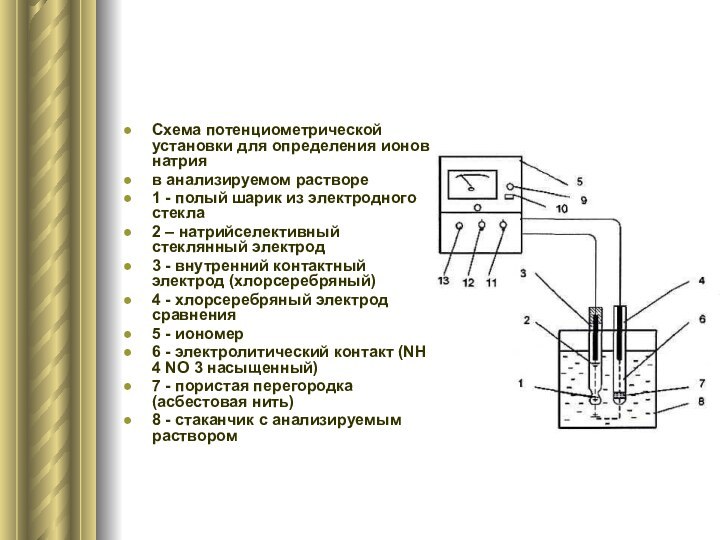
Схема потенциометрической установки для определения ионов натрия
в анализируемом
растворе
1 - полый шарик из электродного стекла
2 – натрийселективный
стеклянный электрод3 - внутренний контактный электрод (хлорсеребряный)
4 - хлорсеребряный электрод сравнения
5 - иономер
6 - электролитический контакт (NH 4 NO 3 насыщенный)
7 - пористая перегородка (асбестовая нить)
8 - стаканчик с анализируемым раствором
Слайд 9
Кулонометрия
q/nF = т/М,
(4)
где q -
количество электричества, (А·с) (вычисляется по произведению силы тока (в амперах) и времени (в секундах). М — масса выделившегося вещества, г; n — число электронов, участвующих в реакции выделения вещества; F — постоянная Фарадея, равная 9,65 ·104 Кл/моль.
Слайд 10
прямая кулонометрия
Если исследуемый компонент восстанавливается на катоде,
выбирается потенциал на 0,05-0,2В отрицательнее, чем потенциал полуволны.
It = I0 ·exp (-K· t), (5) где It , I0 - сила тока в момент отсчета и в начале электродной реакции соответственно; К - константа, зависящая от скорости диффузии, площади поверхности электрода и объема раствора.
Слайд 11
ПОЛЯРОГРАФИЯ
Рисунок 6.1 - Схема полярографической установки:
I - гальванический
элемент; II - приспособление для поляризации электрода и
регистрации тока;1 - анод; 2 - катод; 3 - вольтметр; 4 - потенциометр; 5 - аккумулятор; 6 – выключатель.
Рисунок 6.2 - Электролитическая установка:
1 - капилляр; 2 - полихлорвиниловый шланг; 3 - груша с ртутью; 4 - штатив; 5- электролизер
Слайд 12
Основы полярографического метода анализа
Eа -
Eк = U,
где Еа и Ек - потенциалы
анода и катода соответственно; U - напряжение.
Eк = -U
KNO3 +
Cd(NО3)2
Полярографическая волна
Кривая, выражающая зависимость силы тока от приложенной разности потенциалов, называется полярографической волной.
Слайд 13
Общая характеристика полярографической волны
Восстановление Сd2+ происходит в
несколько стадий:
1) диффузия ионов к поверхности электрода;
2)
передача электронов от электрода к иону (собственно процесс восстановления); 3) удаление продуктов восстановления от поверхности электрода (растворение металлического кадмия в ртути).
Сила предельного диффузионного тока :
Id = kc
Полярограмма восстановления ионов меди, свинца и цинка в растворе нитратов