Слайд 2
Поглощение и излучение света, характеристики
Iпр=I0-(ΣI0KΔι)(Δι)→0 =I0e-Kι
Пропускание: Т= Iпр/I0=e-Kι
K
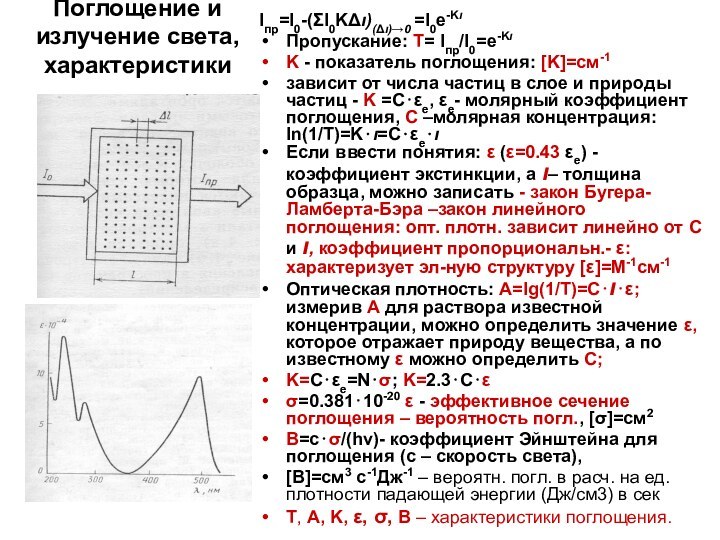
- показатель поглощения: [K]=см-1
зависит от числа частиц в слое
и природы частиц - K =С⋅εе, εе- молярный коэффициент поглощения, С –молярная концентрация: ln(1/T)=K⋅ι=С⋅εе⋅ι
Если ввести понятия: ε (ε=0.43 εе) - коэффициент экстинкции, а ι– толщина образца, можно записать - закон Бугера-Ламберта-Бэра –закон линейного поглощения: опт. плотн. зависит линейно от С и ι, коэффициент пропорциональн.- ε: характеризует эл-ную структуру [ε]=М-1см-1
Оптическая плотность: А=lg(1/T)=С⋅ι⋅ε; измерив А для раствора известной концентрации, можно определить значение ε, которое отражает природу вещества, а по известному ε можно определить С;
K=С⋅εе=N⋅σ; K=2.3⋅С⋅ε
σ=0.381⋅10-20 ε - эффективное сечение поглощения – вероятность погл., [σ]=см2
B=с⋅σ/(hν)- коэффициент Эйнштейна для поглощения (с – скорость света),
[В]=см3 с-1Дж-1 – вероятн. погл. в расч. на ед. плотности падающей энергии (Дж/см3) в сек
Т, А, K, ε, σ, B – характеристики поглощения.
Слайд 3
Молекулярные орбитали,
электронные состояния
молекул
s,p,d -Орбитали – одноэлектронные
волновые функции электронов в атоме;
σ, π, d –
связывающие орбитали в молекуле, образованные s,p,d электронами, участвующими в связи,
n - несвязывающая орбиталь, образованная локализованными электронами, не участвующими в связи. (σ*, π*, d* –разрыхляющие – «отталкивательные» орбитали)
Волновые функции – орбитали - характеризуют электронные состояния молекул, определяемые 4 квантовыми числами:
n-главное квантовое число - квантуется энергия,
l – орбитальное квантовое число - квантуется момент количества движения
m- магнитное квантовое число, квантуется проекция момента;
S – спиновое квантовое число – квантуется суммарный спин.
Решив уравнение Шредингера, можно определить собственную энергию: НэлΨэл=ЕэлΨэл - набор энергетических уровней с разными квантовыми числами.
Два электрона в молекуле не могут иметь одинаковые квантовые числа (пр.Паули)
Слайд 4
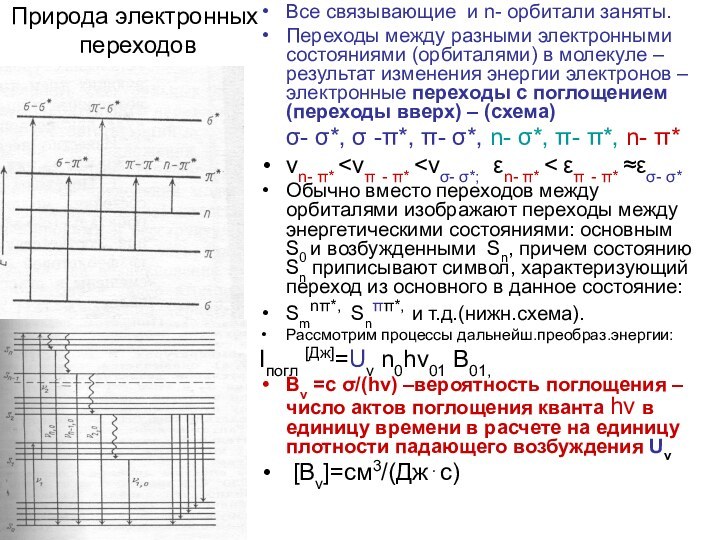
Природа электронных
переходов
Все связывающие и n- орбитали заняты.
Переходы
между разными электронными состояниями (орбиталями) в молекуле – результат
изменения энергии электронов – электронные переходы с поглощением (переходы вверх) – (схема)
σ- σ*, σ -π*, π- σ*, n- σ*, π- π*, n- π*
νn- π* <νπ - π* <νσ- σ*; εn- π* < επ - π* ≈εσ- σ*
Обычно вместо переходов между орбиталями изображают переходы между энергетическими состояниями: основным S0 и возбужденными Sn, причем состоянию Sn приписывают символ, характеризующий переход из основного в данное состояние:
Smnπ*, Snππ*, и т.д.(нижн.схема).
Рассмотрим процессы дальнейш.преобраз.энергии:
Iпогл [Дж]=Uν n0hν01 B01,
Bν =с σ/(hν) –вероятность поглощения – число актов поглощения кванта hν в единицу времени в расчете на единицу плотности падающего возбуждения Uν
[Bν]=см3/(Дж⋅с)
Слайд 5
Природа электронных
переходов
Спонтанное излучение (самопроизвольные переходы вниз)
Iизл =γn1hν10
А10 ; А10 =const⋅B01 : к-т Эйнштейна для спонтанного
излучения А10=krad - вероятность спонтанного излучения –люминесценции –число актов излучения в ед. времени при условии, что каждая возбужденная молекула излучает спонтанно, т.е. γ=1, [А]= с-1
Формула Боуэна-Уокса:
А10=krad ≈2.9⋅10-9⋅ν2max ⋅ εmax ⋅ Δν1/2
τrad - время жизни молекулы в возбужденном состоянии при отсутствии безызлучательных процессов; τrad =1/krad ; при γ=1,
Реальное время жизни возбужденного состояния:
τизл=1/(krad+kd)≈10-7 –10-10 с, kd-константа безызлучат. дезактивации.
Квантовый выход люминесценции: по определению: γ=Nизл/Nпогл
γ =krad/(krad+kd)=τизл/τrad ; при γ=1, kd=0
Правило Каша: Для сложных молекул люминесценция наблюдается из нижнего электронно-возбужденного состояния (верхние дезактивируются безызлучат.)
Слайд 6
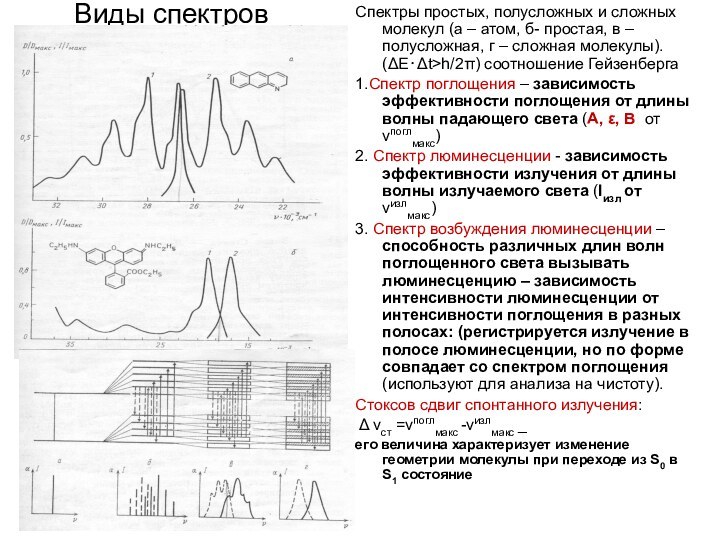
Виды спектров
Спектры простых, полусложных и сложных молекул (а
– атом, б- простая, в – полусложная, г –
сложная молекулы). (ΔЕ⋅Δt>h/2π) соотношение Гейзенберга
1.Спектр поглощения – зависимость эффективности поглощения от длины волны падающего света (А, ε, В от νпоглмакс)
2. Спектр люминесценции - зависимость эффективности излучения от длины волны излучаемого света (Iизл от νизлмакс)
3. Спектр возбуждения люминесценции –способность различных длин волн поглощенного света вызывать люминесценцию – зависимость интенсивности люминесценции от интенсивности поглощения в разных полосах: (регистрируется излучение в полосе люминесценции, но по форме совпадает со спектром поглощения (используют для анализа на чистоту).
Стоксов сдвиг спонтанного излучения:
Δ νст =νпоглмакс -νизлмакс _
его величина характеризует изменение геометрии молекулы при переходе из S0 в S1 состояние
Слайд 7
Разделение молекул по сложности
Теренин А.Н., Непорент Б.С.:
W–

вероятность перераспределения электронно-колебательной энергии внутри молекулы по колебательным степеням
свободы ≈ зависит от запаса Екол :
Простые молекулы - W – относительно мала (большие расстояния между уровнями)
Полусложные – при малом запасе Екол W – мала, а при больших значениях (высокие колебательные состояния, уровни сближаются) W – велика, т.е. они становятся сложными.
Сложные – при любом запасе Екол W велика, т.е. существенно превышает величину, обратную длительности нахождения молекулы в индивидуальном колебательном состоянии.
Прежде, чем такая молекула, находясь в возбужденном электронно-колебательном состоянии на разрыхляющей молекулярной орбитали, может претерпевать распад, двигаясь по координате реакции (т.е. подвергаясь удлинению возбужденной связи в результате колебания), она передает колебательную энергию на другие связи, переходя в нижнее электронно-колебательное состояние и оставаясь при этом стабильной.
Слайд 8
Положение атомов в разных колебательных состояниях молекулы
Волновые функции
ψ (пунктир) и амплитуды вероятности (сплошная линия) рассчитанные для
гармонического осциллятора.
Наибольшая вероятность нахождения ядер на нулевом колебательном уровне соответствует равновесному расстоянию.
Наибольшая вероятность нахождения ядер в более высоких колебательных состояниях ближе к поверхности потенциальной кривой.
Слайд 9
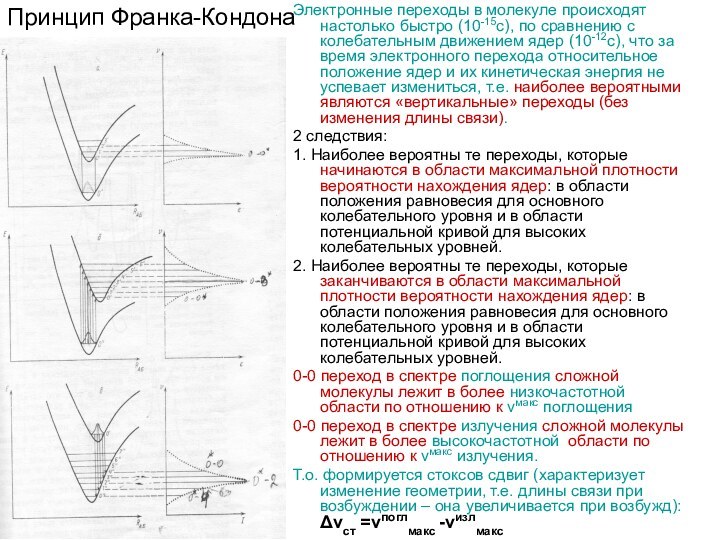
Принцип Франка-Кондона
Электронные переходы в молекуле происходят настолько быстро
(10-15с), по сравнению с колебательным движением ядер (10-12с), что
за время электронного перехода относительное положение ядер и их кинетическая энергия не успевает измениться, т.е. наиболее вероятными являются «вертикальные» переходы (без изменения длины связи).
2 следствия:
1. Наиболее вероятны те переходы, которые начинаются в области максимальной плотности вероятности нахождения ядер: в области положения равновесия для основного колебательного уровня и в области потенциальной кривой для высоких колебательных уровней.
2. Наиболее вероятны те переходы, которые заканчиваются в области максимальной плотности вероятности нахождения ядер: в области положения равновесия для основного колебательного уровня и в области потенциальной кривой для высоких колебательных уровней.
0-0 переход в спектре поглощения сложной молекулы лежит в более низкочастотной области по отношению к νмакс поглощения
0-0 переход в спектре излучения сложной молекулы лежит в более высокочастотной области по отношению к νмакс излучения.
Т.о. формируется стоксов сдвиг (характеризует изменение геометрии, т.е. длины связи при возбуждении – она увеличивается при возбужд): Δνст =νпоглмакс -νизлмакс
Слайд 10
Фосфоресценция, природа триплетного состояния
Люминесценция – флуоресценция и фосфоресценция:
Флуоресценция:
жидкие растворы, пары, спонтанный переход S1 → S0 τизл=10-7
– 10-10с
фосфоресценция: замороженные растворы (77К), τизл=101 – 10-4с, более длинноволновая область.
Схема Яблонского-Теренина-Льюиса-Каша
S0[↑↓] +hνпогл=S1[↑][↓]
S1[↑][↓] →T [↑][↑]+hνфл → S0[↑↓]
T [↑][↑] →S0[↑↓] + hνфос
Мультиплетность M=2S+1: уровень расщепляется в магнитном поле:
S=0 –синглет
S=1 –триплет
kвк – внутренняя конверсия: ΔМ=0
Kst – интеркомбинационная конверсия: ΔМ≠0, переход запрещен, но запрещение частично снимается за счет спин-орбитального взаимодействия
kd=(kвк+kst), как правило, kвк≅ 108-105с-1
kst≅ 106с-1
γ=krad /(krad+kвк+kst)
Слайд 11
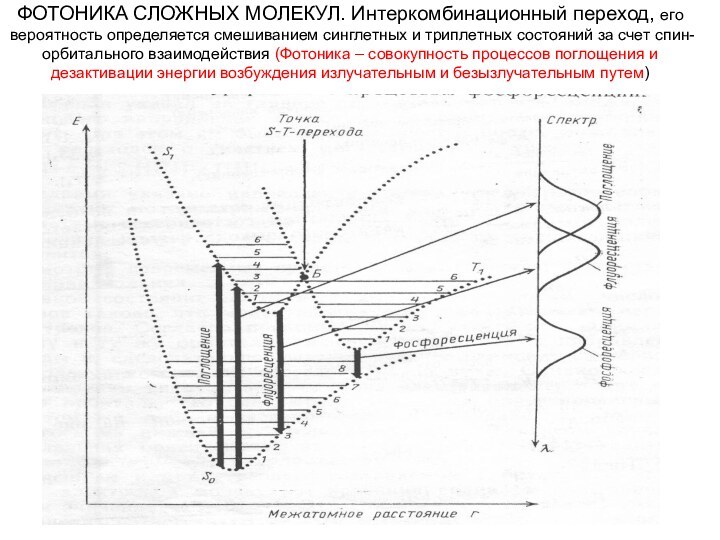
ФОТОНИКА СЛОЖНЫХ МОЛЕКУЛ. Интеркомбинационный переход, его вероятность определяется
смешиванием синглетных и триплетных состояний за счет спин-орбитального взаимодействия
(Фотоника – совокупность процессов поглощения и дезактивации энергии возбуждения излучательным и безызлучательным путем)
Слайд 12
Примеры применения электронной спектроскопии при исследовании строения вещества
1.

Количественный анализ: на основании закона Бугера-Ламберта-Бэра определение концентрации известного
вещества – С=А/(ι⋅ε) с высокой точностью (погрешность не выше 1 %) – используется при изучении кинетики химических реакций.
2. Качественный анализ: можно анализировать неизвестную структуру благодаря наличию в структуре определенных групп – хромофоров.
Основные типы хромофоров (рис.):
а. Диеновые системы: π-π* полоса в области 215-270 нм; введение алкильных заместителей вне системы двойных связей не изменяет спектр(3), введение заместителей в диеновую систему (от 1 к 2, 4, 5) вызывает батохромный сдвиг 7-10 нм, переход от циклич.(6) к трансоидной (7 и 5) вызывает гипсохромный сдвиг 15 нм: можно анализировать неизвестную структуру.
б. Полиеновые системы: Увеличение числа двойных связей – цепи сопряжения вызывает батохромный сдвиг π-π* полосы: на 50, 40, 30, 20 нм для каждой последующей двойной связи и увеличение ее интенсивности: от 217нм и 21000 М-1см-1 до 452 нм и 140000 М-1см-1.
Т.о., решение прямой задачи и анализ результатов предполагает решение обратной задачи - установление структуры по спектрам.
Слайд 13
Примеры применения электронной спектроскопии при исследовании строения вещества
(продолжение)
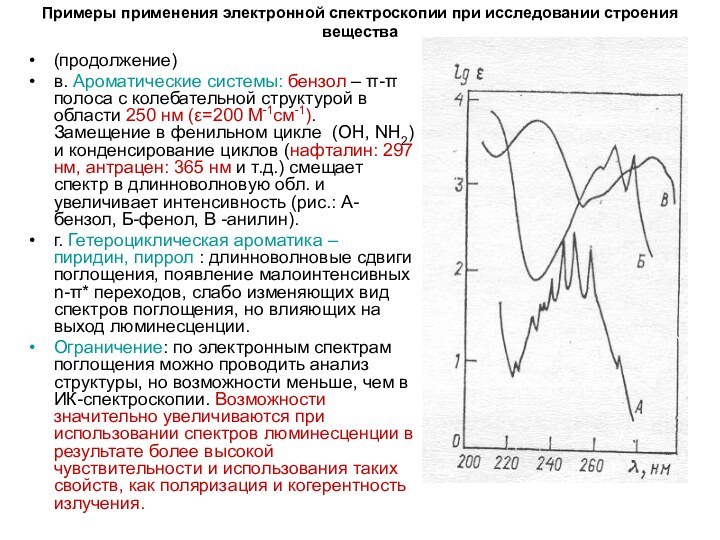
в.
Ароматические системы: бензол – π-π полоса с колебательной структурой
в области 250 нм (ε=200 М-1см-1). Замещение в фенильном цикле (ОН, NH2) и конденсирование циклов (нафталин: 297 нм, антрацен: 365 нм и т.д.) смещает спектр в длинноволновую обл. и увеличивает интенсивность (рис.: А-бензол, Б-фенол, В -анилин).
г. Гетероциклическая ароматика – пиридин, пиррол : длинноволновые сдвиги поглощения, появление малоинтенсивных n-π* переходов, слабо изменяющих вид спектров поглощения, но влияющих на выход люминесценции.
Ограничение: по электронным спектрам поглощения можно проводить анализ структуры, но возможности меньше, чем в ИК-спектроскопии. Возможности значительно увеличиваются при использовании спектров люминесценции в результате более высокой чувствительности и использования таких свойств, как поляризация и когерентность излучения.
Слайд 14
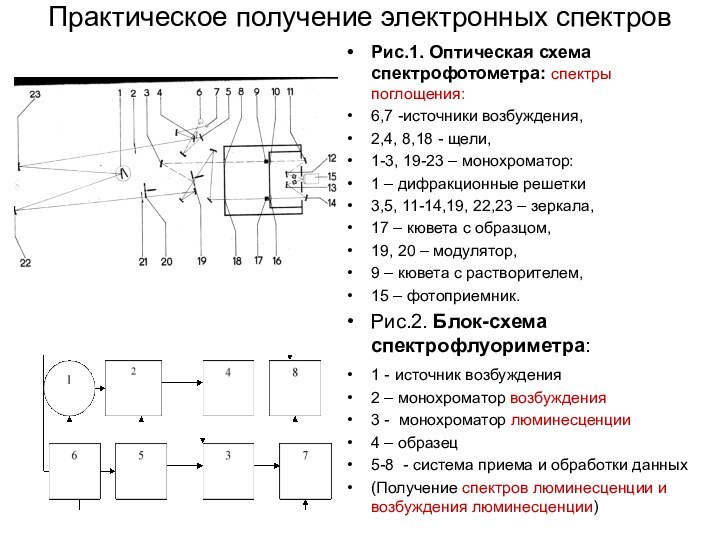
Практическое получение электронных спектров
Рис.1. Оптическая схема спектрофотометра: спектры
поглощения:
6,7 -источники возбуждения,
2,4, 8,18 - щели,
1-3, 19-23
– монохроматор:
1 – дифракционные решетки
3,5, 11-14,19, 22,23 – зеркала,
17 – кювета с образцом,
19, 20 – модулятор,
9 – кювета с растворителем,
15 – фотоприемник.
Рис.2. Блок-схема спектрофлуориметра:
1 - источник возбуждения
2 – монохроматор возбуждения
3 - монохроматор люминесценции
4 – образец
5-8 - система приема и обработки данных
(Получение спектров люминесценции и возбуждения люминесценции)
Слайд 15
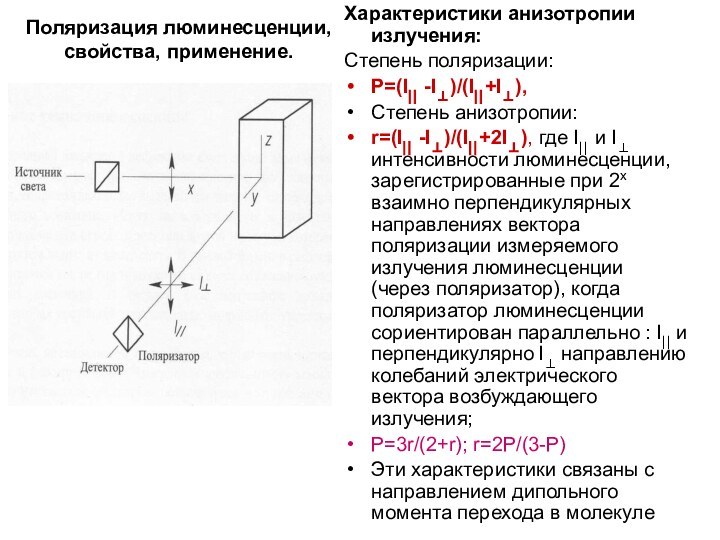
Поляризация люминесценции, свойства, применение.
Свет – поперечная эл-магн.волна. Естественный

свет- вектор электрического поля принимает различные направления (изотропия -а)
Поляризованный
свет – строго определенные направления вектора Е, получен при прохождении естеств.света через поляризатор (анизотропия - б). Если поставить поляризатор между источником и кюветой с раствором, происходит возбуждение поляризованным светом (вектор Е в вертикальной плоскости).
Поглощение и излучение каждой молекулы анизотропно, т.е. направление дипольного момента перехода (электрического вектора) имеет строго определенное направление (определяется изменением распределения электронной плотности в молекуле в процессе перехода). Каждой молекулой поглощается часть возбуждающего поляризованного излучения (проекция дипольного момента перехода на выбранное направление - Z). Если поставить поляризатор после кюветы, то в зависимости от его направления на приемник попадает свет люминесценции, поляризованный в вертикальной (I⎜⎜) или в горизонтальной плоскости (I⊥). Поскольку в растворе молекулы не сориентированы, поэтому в ансамбле молекул анизотропия уменьшается (в твердых пленках), либо исчезает полностью (в газовой и жидкой фазах).
Слайд 16
Поляризация люминесценции, свойства, применение.
Характеристики анизотропии излучения:
Степень поляризации:
P=(I⎜⎜ -I⊥)/(I⎜⎜+I⊥),
Степень анизотропии:
r=(I⎜⎜ -I⊥)/(I⎜⎜+2I⊥), где I⎜⎜ и I⊥ интенсивности
люминесценции, зарегистрированные при 2х взаимно перпендикулярных направлениях вектора поляризации измеряемого излучения люминесценции (через поляризатор), когда поляризатор люминесценции сориентирован параллельно : I⎜⎜ и перпендикулярно I⊥ направлению колебаний электрического вектора возбуждающего излучения;
Р=3r/(2+r); r=2P/(3-P)
Эти характеристики связаны с направлением дипольного момента перехода в молекуле
Слайд 17
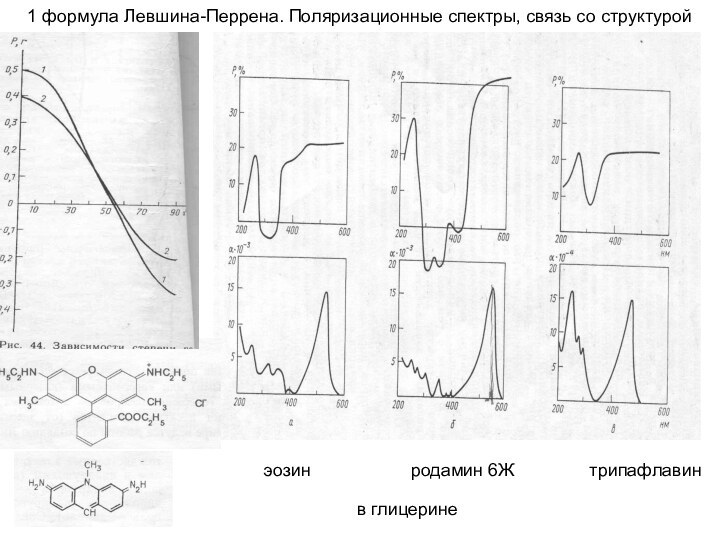
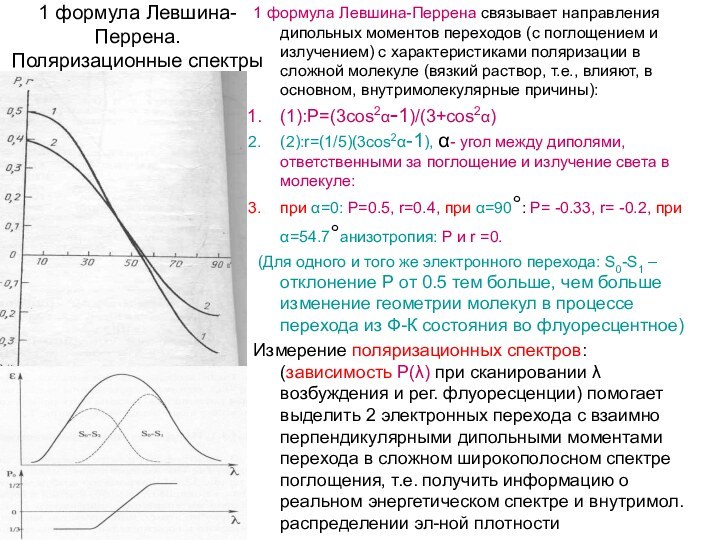
1 формула Левшина-Перрена. Поляризационные спектры
1 формула Левшина-Перрена связывает
направления дипольных моментов переходов (с поглощением и излучением) с
характеристиками поляризации в сложной молекуле (вязкий раствор, т.е., влияют, в основном, внутримолекулярные причины):
(1):P=(3cos2α-1)/(3+cos2α)
(2):r=(1/5)(3cos2α-1), α- угол между диполями, ответственными за поглощение и излучение света в молекуле:
при α=0: Р=0.5, r=0.4, при α=90°: Р= -0.33, r= -0.2, при α=54.7°анизотропия: P и r =0.
(Для одного и того же электронного перехода: S0-S1 –отклонение Р от 0.5 тем больше, чем больше изменение геометрии молекул в процессе перехода из Ф-К состояния во флуоресцентное)
Измерение поляризационных спектров: (зависимость Р(λ) при сканировании λ возбуждения и рег. флуоресценции) помогает выделить 2 электронных перехода с взаимно перпендикулярными дипольными моментами перехода в сложном широкополосном спектре поглощения, т.е. получить информацию о реальном энергетическом спектре и внутримол. распределении эл-ной плотности
Слайд 18
1 формула Левшина-Перрена. Поляризационные спектры, связь со структурой
эозин родамин 6Ж трипафлавин
в глицерине

![Электронная спектроскопия Поглощение и излучение света, характеристикиIпр=I0-(ΣI0KΔι)(Δι)→0 =I0e-KιПропускание: Т= Iпр/I0=e-KιK - показатель поглощения: [K]=см-1зависит](/img/tmb/15/1422192/0cb5f14f96638809204caf7c29b3fa33-720x.jpg)