Слайд 2
КЛАССИФИКАЦИЯ КРИСТАЛЛОВ ПО ТИПАМ СИЛ СВЯЗИ
Классификация кристаллов

по кристаллическим системам дает представление о геометрических характеристиках кристалла,
но не затрагивает вопроса о природе сил, удерживающих атомы (молекулы или ионы) в определенных местах друг относительно друга — в узлах кристаллической решетки.
Можно произвести классификацию кристаллов по другому принципу, а именно: в зависимости от физической природы сил, действующих между частицами кристалла. Тогда мы получим четыре типа кристаллов (и кристаллических решеток): ионные, атомные, металлические и молекулярные. (Существует другая классификация кристаллов по типам сил связи, принятая в США, по которой кристаллы могут быть разделены на пять групп: молекулярные, ионные, валентные, валентно-молекулярные, металлические). Классификация кристаллов, основанная на типах, сил связи, позволяет сделать некоторые обобщения относительно свойств и поведения кристаллов, чего нельзя сделать, рассматривая только геометрию решеток.
До сих пор мы не учитывали природу сил, удерживающих частицы в строго упорядоченном положении. На самом деле необходимо учитывать природу этих сил, так как она определяет энергию связи в решетке и основные их свойства. Рассмотрим силы взаимодействия и соответственно энергию связи для 2-х частичной модели.
Пусть мы имеем частицы одна, из которых расположена в начале координат, а вторая расположена в ∞ и из ∞ приближается к первой частицы.
Слайд 4
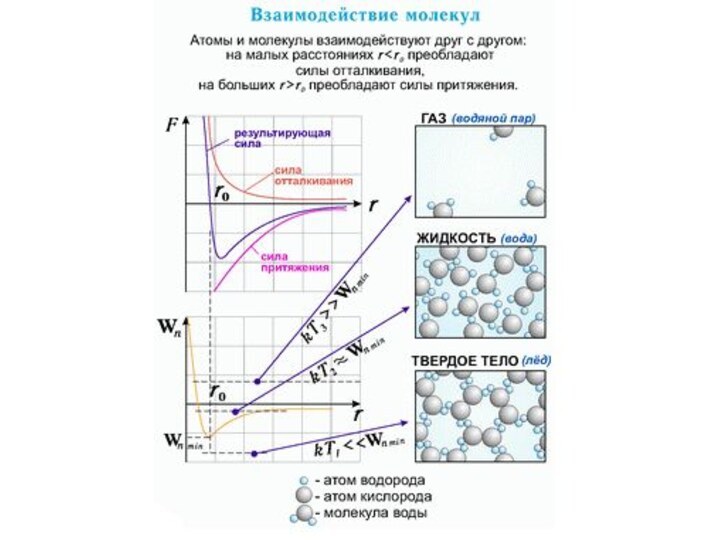
Взаимодействие частиц
Силы, действующие между двумя молекулами, зависят от
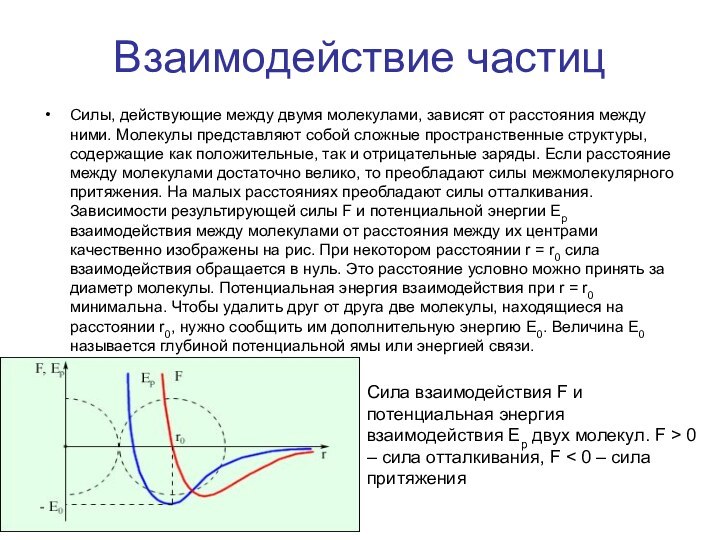
расстояния между ними. Молекулы представляют собой сложные пространственные структуры,
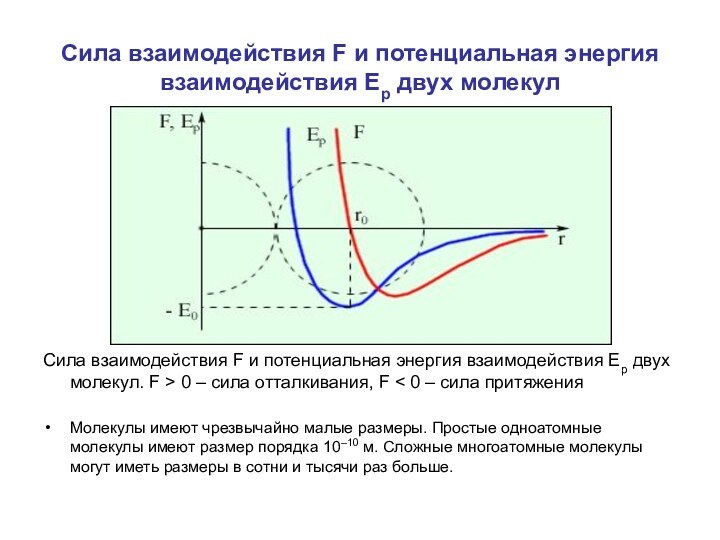
содержащие как положительные, так и отрицательные заряды. Если расстояние между молекулами достаточно велико, то преобладают силы межмолекулярного притяжения. На малых расстояниях преобладают силы отталкивания. Зависимости результирующей силы F и потенциальной энергии Ep взаимодействия между молекулами от расстояния между их центрами качественно изображены на рис. При некотором расстоянии r = r0 сила взаимодействия обращается в нуль. Это расстояние условно можно принять за диаметр молекулы. Потенциальная энергия взаимодействия при r = r0 минимальна. Чтобы удалить друг от друга две молекулы, находящиеся на расстоянии r0, нужно сообщить им дополнительную энергию E0. Величина E0 называется глубиной потенциальной ямы или энергией связи.
Сила взаимодействия F и потенциальная энергия взаимодействия Ep двух молекул. F > 0 – сила отталкивания, F < 0 – сила притяжения
Слайд 5
Сила взаимодействия F и потенциальная энергия взаимодействия Ep
двух молекул
Сила взаимодействия F и потенциальная энергия взаимодействия Ep
двух молекул. F > 0 – сила отталкивания, F < 0 – сила притяжения
Молекулы имеют чрезвычайно малые размеры. Простые одноатомные молекулы имеют размер порядка 10–10 м. Сложные многоатомные молекулы могут иметь размеры в сотни и тысячи раз больше.
Слайд 6
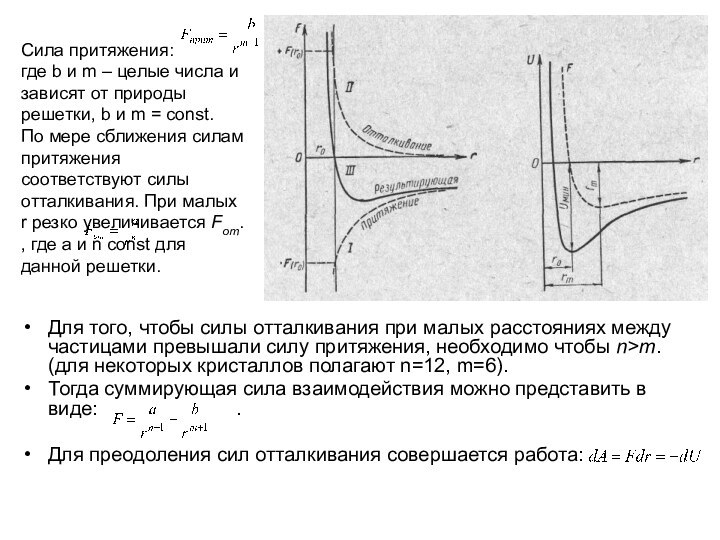
Сила притяжения:
где b и m – целые числа и зависят
от природы решетки, b и m = const.
По мере сближения силам притяжения соответствуют силы отталкивания. При малых r резко увеличивается Fот. , где a и n const для данной решетки.
Для того, чтобы силы отталкивания при малых расстояниях между частицами превышали силу притяжения, необходимо чтобы n>m. (для некоторых кристаллов полагают n=12, m=6).
Тогда суммирующая сила взаимодействия можно представить в виде: .
Для преодоления сил отталкивания совершается работа:
Слайд 7
Суммарная потенциальная энергия взаимодействия системы 2-х частиц U
может быть получена из формулы сил взаимодействия:
где , , .
Соответственно, мы можем найти значения (равновесное состояние) r0, который соответствует наибольшему периоду кристаллической решетки: .
Энергия связи есть энергия, которая необходима подвести к кристаллу, чтобы разъединить его на отдельные составляющие .
Слайд 8
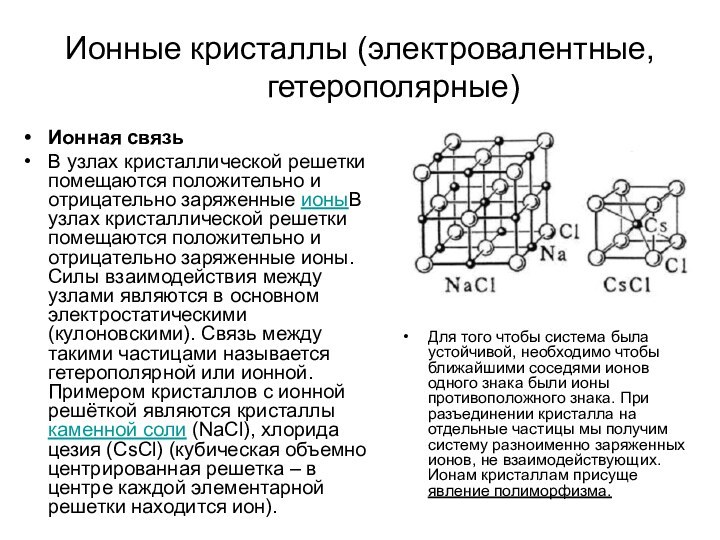
Ионные кристаллы (электровалентные, гетерополярные)
Ионная связь
В узлах кристаллической решетки
помещаются положительно и отрицательно заряженные ионыВ узлах кристаллической решетки
помещаются положительно и отрицательно заряженные ионы. Силы взаимодействия между узлами являются в основном электростатическими (кулоновскими). Связь между такими частицами называется гетерополярной или ионной. Примером кристаллов с ионной решёткой являются кристаллы каменной соли (NaCl), хлорида цезия (СsСl) (кубическая объемно центрированная решетка – в центре каждой элементарной решетки находится ион).
Для того чтобы система была устойчивой, необходимо чтобы ближайшими соседями ионов одного знака были ионы противоположного знака. При разъединении кристалла на отдельные частицы мы получим систему разноименно заряженных ионов, не взаимодействующих. Ионам кристаллам присуще явление полиморфизма.
Слайд 9
Атомные кристаллы (ковалентные, гомеополярные)
Система из двух атомов водорода
схематически изображена на рис. Протоны - на схеме обозначены
буквами а и b, a электроны — цифрами 1 и 2. Расстояния между элементами схемы обозначены буквой r с соответствующими индексами, не требующими пояснений. Плотность электронного облака, описывающего состояние электрона в атоме водорода, очень быстро падает с увеличением расстояния, поэтому при больших расстояниях между протонами r атомы можно рассматривать, как изолированные, и энергию системы, состоящей из двух удаленных атомов, можно считать равной 2Е0, где Е0 — энергия изолированного атома в невозбужденном состоянии.
В узлах кристаллической решетки распложены нейтральные атомы. Силы взаимодействия между атомами называется обменными. Рассмотрим природу этих сил на примере молекулы водорода H2 (2 атома).
Слайд 11
По мере уменьшения расстояния r увеличивается степень перекрытия

электронных облаков, т. е. увеличивается вероятность перехода электрона к
«чужому» протону.
Расчет показывает, что при r≈ 50 А электрон сможет побывать у «чужого» протона примерно один раз за 1012 лет.
Сблизим атомы на расстояние r≈ 2А. В этом случае электрон первого атома, может перейти ко второму, 1014 раз в сек.
Поэтому теряет смысл говорить о принадлежности данного электрона к данному атому. Фактически образуется общая пара электронов для двух атомов. Обобществление электронов приводит к перераспределению электронной плотности в пространстве между ядрами атомов и вне ядер. Плотность электронного облака в пространстве между ядрами становится больше плотности, которая бы получилась при простом сложении отдельных плотностей. И наоборот в пространстве вне ядер оказывается, что суммарная плотность электронного облака будет меньше той, которая бы получилась при сложении плотностей электронных облаков отдельных атомов.
Такое перераспределение электронной плотности сказывается на изменении энергии системы и проявляется в появлении сил взаимодействия нейтральных атомов. Атомным кристаллам также присуще явление полиморфизма. Главным отличительным признакам этих кристаллов является обобществление электронов (общие пары).
Слайд 12
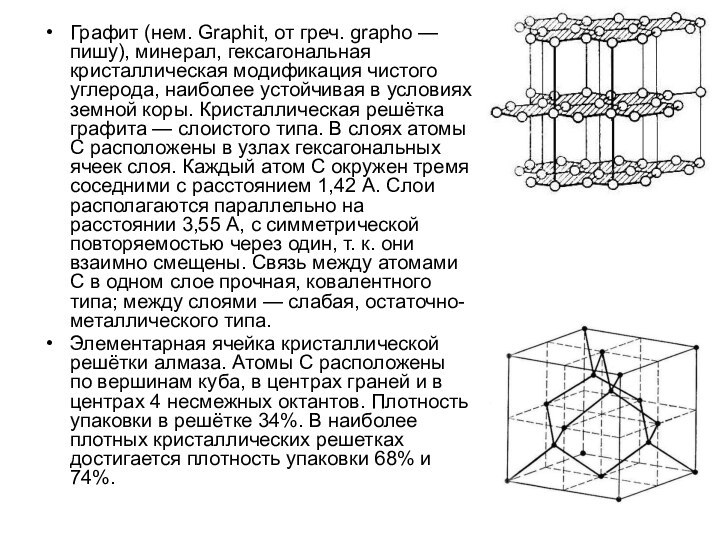
Графит (нем. Graphit, от греч. grapho — пишу),
минерал, гексагональная кристаллическая модификация чистого углерода, наиболее устойчивая в
условиях земной коры. Кристаллическая решётка графита — слоистого типа. В слоях атомы С расположены в узлах гексагональных ячеек слоя. Каждый атом С окружен тремя соседними с расстоянием 1,42 A. Слои располагаются параллельно на расстоянии 3,55 A, с симметрической повторяемостью через один, т. к. они взаимно смещены. Связь между атомами С в одном слое прочная, ковалентного типа; между слоями — слабая, остаточно-металлического типа.
Элементарная ячейка кристаллической решётки алмаза. Атомы С расположены по вершинам куба, в центрах граней и в центрах 4 несмежных октантов. Плотность упаковки в решётке 34%. В наиболее плотных кристаллических решетках достигается плотность упаковки 68% и 74%.
Слайд 13
Металлические кристаллы (металлы)
В узлах кристаллической решетки металлов расположены

положительно заряженные ионы металлов. Внешние валентные электроны, в отличие
от атомных кристаллов, являются общими для всей решетки в целом (образуют электронное облако). Если бы такого «электронного облака» не было бы, то за счет электростатических сил отталкивания такая система не была бы устойчивой. Электронный газ обладает цементирующим действием, обеспечивая устойчивость самой решетки. Металлам присуще поликристаллическая структура, за счет того, они состоят из отдельных кристаллических зерен, расположенных хаотически. Металлы бывают текстурированными в том случае, если за счет внешних факторов в кристаллических зернах будет наблюдаться упорядоченность.
Большинство чистых металлов имеют координационное число К=12, либо К=8. Многим металлам присуще явление полиморфизма, они могут существовать в 4 различных α-, β-, γ-, δ- кристаллических модификациях, устойчивых в различных интервалах температур.
Слайд 14
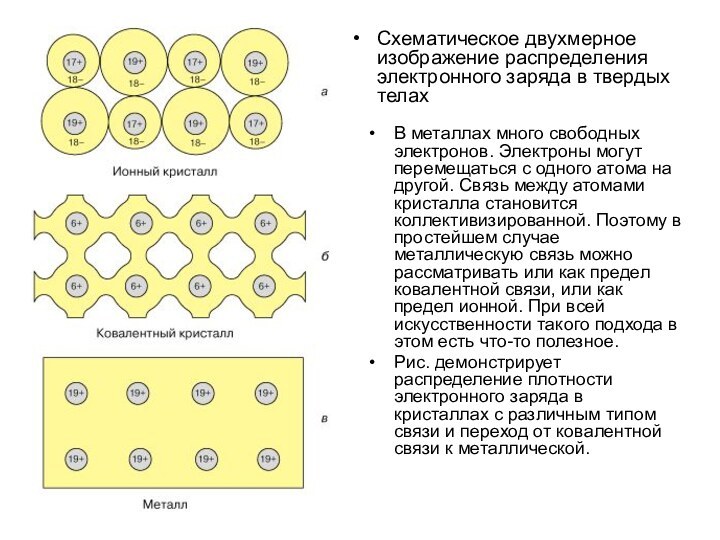
Схематическое двухмерное изображение распределения электронного заряда в твердых
телах
В металлах много свободных электронов. Электроны могут перемещаться с
одного атома на другой. Связь между атомами кристалла становится коллективизированной. Поэтому в простейшем случае металлическую связь можно рассматривать или как предел ковалентной связи, или как предел ионной. При всей искусственности такого подхода в этом есть что-то полезное.
Рис. демонстрирует распределение плотности электронного заряда в кристаллах с различным типом связи и переход от ковалентной связи к металлической.
Слайд 15
Молекулярные кристаллы
В узлах кристаллической решетки находятся устойчивые молекулы,
которые сохраняют индивидуальность не только в газообразной, но и
в жидкой и твердой фазах (Н2, N2, С12, Br2 , I2 , CH4, СО2, Н2О). Молекулы удерживаются в узлах решетки довольно слабыми вандерваальсовыми силами, природа которых сводится к взаимодействию между молекулярными диполями.
Различают три вида взаимодействия молекул, связанных силами Ван-дер-Ваальса.
Слайд 16
Ориентационное
1. Если молекулы данного вещества являются электрическими диполями,
то силы электростатического взаимодействия между ними будут стремиться расположить
молекулы в определенном порядке, которому соответствует минимум потенциальной энергии системы (рис.). Такой тип взаимодействия полярных молекул, зависящий от их ориентации, называется ориентационным.
Тепловое движение молекул стремится нарушить упорядоченное расположение молекул, поэтому энергия ориентационного взаимодействия уменьшается с повышением температуры.
Слайд 17
Поляризационное
2. Неполярные молекулы некоторых веществ обладают высокой
поляризуемостью, поэтому под влиянием внешнего электрического поля (например, при
приближении полярной молекулы) у таких молекул возникает наведенный (индуцированный) электрический момент. При сближении такие индуцированные диполи будут взаимодействовать друг с другом аналогично взаимодействию жестких диполей. Такое взаимодействие называют индукционным или поляризационным.
Энергия индукционного взаимодействия не зависит от температуры.
Слайд 18
Дисперсионное
3. Возможен другой вид взаимодействия между нейтральными

молекулами, получивший название дисперсионного. Поясним механизм возникновения дисперсионных сил
на примере взаимодействия двух атомов водорода, когда они находятся достаточно близко друг к другу, но расстояние между атомами значительно больше того, при котором перекрываются электронные облака и возникают ощутимые силы обменного взаимодействия. Атом водорода представляет собою динамическую систему, которая только в среднем, является электрически нейтральной. В каждый же отдельный момент времени система протон—электрон обладает мгновенным дипольным моментом, равным произведению заряда электрона на радиус его орбиты. Если в двух близко расположенных атомах водорода электроны движутся синхронно и мгновенные значения их дипольных моментов совпадают по направлению (рис.а), то между этими нейтральными атомами возникнет сила притяжения, если же мгновенные дипольные моменты атомов противоположны, то они будут отталкиваться (рис. б). Энергетически более выгодной является конфигурация, соответствующая возникновению сил притяжения.
Вообще, в молекулярных кристаллах могут одновременно проявляться все три вида взаимодействия. Большая доля энергии взаимодействия приходится на ориентационный и дисперсионный эффекты и меньшая — на индукционный.
Слайд 19
КРИСТАЛЛЫ С ВОДОРОДНЫМИ СВЯЗЯМИ
В особый класс по типу
связи выделяются кристаллы с водородными связями, хотя водородная связь
является одним из видов межмолекулярного взаимодействия.
Водородная связь между двумя молекулами осуществляется водородным атомом, который, будучи химически связан с одной молекулой (например, через гидроксил), одновременно взаимодействует с атомом кислорода другой молекулы.
В этих схемах водородная связь обозначена точками, R — углеводородный радикал.
Водородная связь наблюдается не только в конденсированных (твердом и жидком) состояниях, но также и в газообразном.
Слайд 20
СОПОСТАВЛЕНИЕ РАЗЛИЧНЫХ ТИПОВ СВЯЗЕЙ
Классификация кристаллов по типам связи
весьма условна. Многие тела трудно отнести к тому или
иному классу кристаллов по типу связи. Но, тем не менее, приближенная классификация кристаллов по типам связи полезна, хотя бы в том смысле, что знание преобладающего типа связи позволяет оценить энергию связи кристалла. Под энергией связи понимается энергия, необходимая для разъединения твердого тела на отдельные атомы, молекулы или ионы (в зависимости от типа кристалла: ковалентные и металлические кристаллы нужно разделить на атомы, ионные — на ионы, молекулярные и кристаллы с водородными связями — на молекулы).
Слайд 21
СОПОСТАВЛЕНИЕ РАЗЛИЧНЫХ ТИПОВ СВЯЗЕЙ