- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Гибридизация атомных орбиталей
Содержание
- 2. Лайнус Карл Полинг
- 3. Гибридизация атомных орбиталей – изменение формы и энергии
- 4. Различные орбитали, несильно отличающиеся энергиями, образуют соответствующее
- 5. В гибридизации участвуют не только связывающие электроны, но и неподеленные электронные пары.
- 6. По сравнению с атомными орбиталями гибридные более
- 7. Гибридная орбиталь больше вытянута по одну сторону
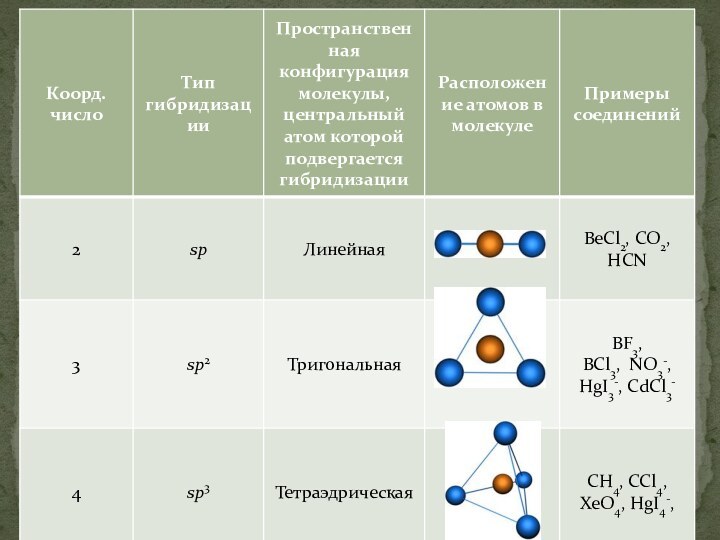
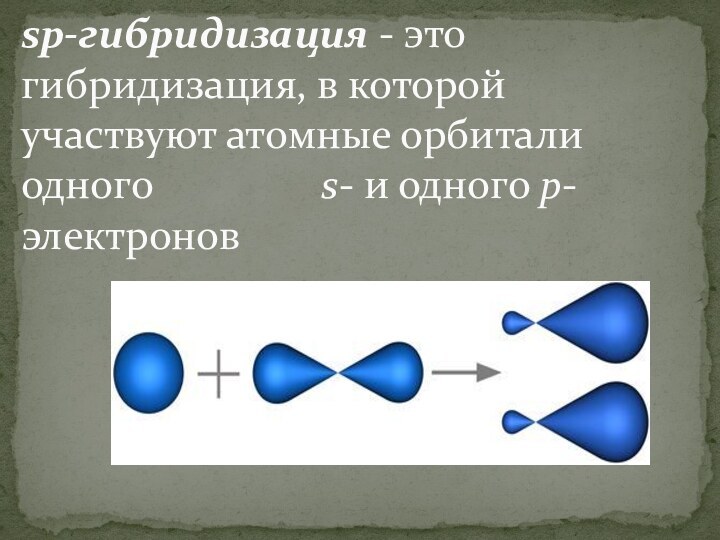
- 9. sp-гибридизация - это гибридизация, в которой участвуют атомные
- 11. Представление о sp-гибридизации орбиталей можно применить для
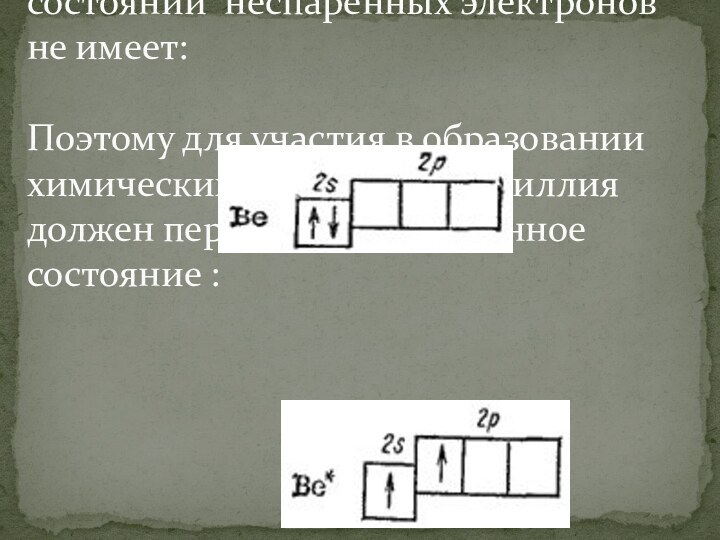
- 12. Образование молекулы фторида бериллия . Каждый атом
- 13. Атом бериллия в
- 14. при затрате некоторой энергии вместо исходных s-
- 15. Примеры химических соединений, для которых характерна sp-гибридизация: BeCl2, BeH2,CO, CO2, HCN, карбин, ацетиленовые углеводороды (алкины).
- 16. sp2-гибридизация – гибридизация, в которой участвуют атомные орбитали одного s- и двух p-электронов
- 17. В результате гибридизации образуются три гибридные sp2 орбитали, расположенные
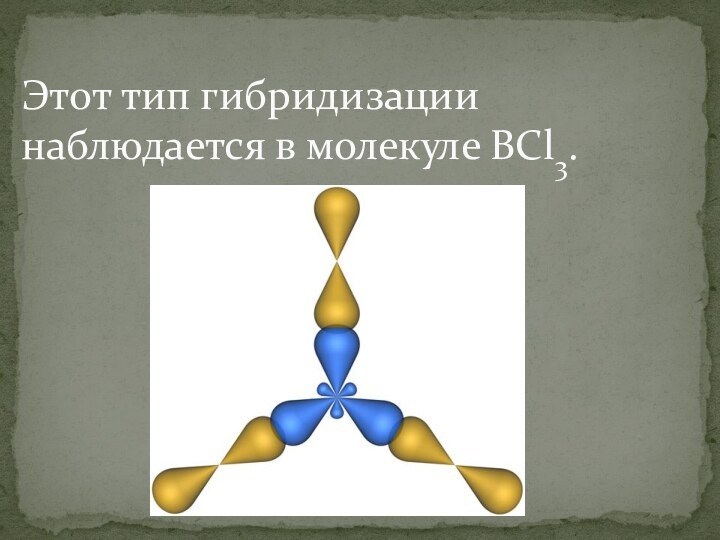
- 18. Этот тип гибридизации наблюдается в молекуле BCl3.
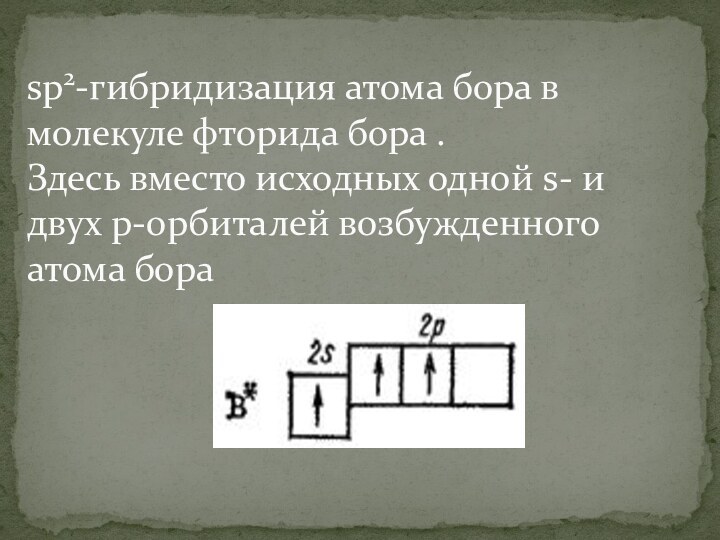
- 19. sp2-гибридизация атома бора в молекуле фторида бора .
- 20. образуются три равноценные sp2-орбитали. Поэтому молекула построена в
- 21. Примеры соединений, в которых наблюдается sp2-гибридизация: SO3, BCl3,
- 22. sp3-гибридизация – гибридизация, в которой участвуют атомные орбитали одного s- и трех p-электронов
- 23. Четыре sp3-гибридные орбитали симметрично ориентированны в пространстве под углом 109°28'
- 24. не всегда пространственная конфигурация молекулы
- 25. Валентность атома азота – III, его пять
- 26. кислород в молекуле воды находится в sp3 гибридном состоянии, а форма молекулы - угловая, угол связи составляет 104°27′.
- 27. Скачать презентацию
- 28. Похожие презентации
Лайнус Карл Полинг