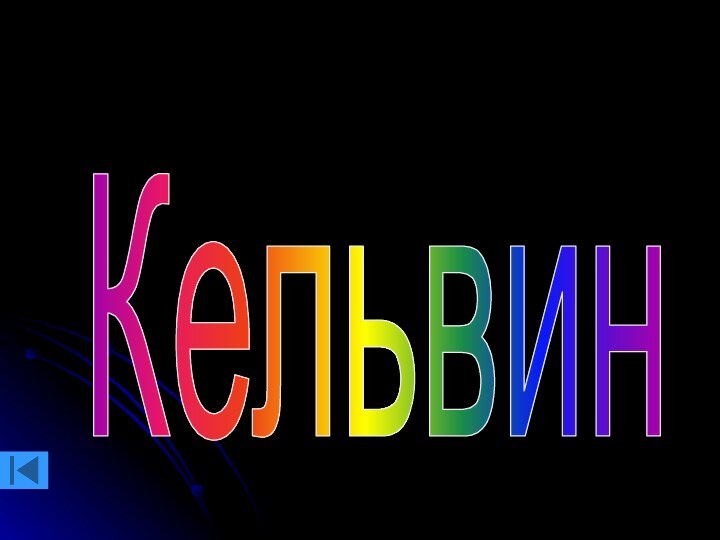Слайд 2
Содержание.
Молекулярная физика
Основы молекулярно-кинетической теории строения вещества (МКТ)
Температура
и внутренняя энергия тела
Характеристика газообразного состояния вещества
Понятие моли вещества,
постоянная Авогадро,
Давление
Понятие вакуума, идеального газа. Основное уравнение МКТ газов
Абсолютная (термодинамическая) шкала температур
Кроссворд.
Слайд 3
Молекулярная физика
МОЛЕКУЛЯРНАЯ ФИЗИКА, раздел физики, изучающий физические свойства
тел в различных агрегатных состояниях на основе рассмотрения их
молекулярного строения. В зависимости от молекулярного строения тел, сил межмолекулярного взаимодействия и характера теплового движения частиц, молекулярная физика изучает особенности процессов фазового равновесия и фазовых переходов веществ — кристаллизацию и плавление, испарение и конденсацию и др., явления переноса — диффузию, теплопроводность, внутреннее трение, а также поверхностные явления на границах раздела различных фаз.
Разделами молекулярной физики являются физика газообразного состояния вещества, физика конденсированного состояния вещества (жидкости и твердые тела), физические явления в поверхностных слоях различных соприкасающихся фаз и др. Из молекулярной физики выделились в самостоятельные разделы физика твердого тела, физическая химия, молекулярная биология и т. д.
Слайд 4
Задачи молекулярной физики решаются методами статистической физики, термодинамики

и физической кинетики. Они связаны с изучением движения и
взаимодействия частиц (атомов, молекул, ионов), составляющих физические тела.
Первым сформировавшимся разделом молекулярной физики была кинетическая теория газов. В процессе ее развития была создана классическая статистическая физика, которая наряду с термодинамическим методом легла в основу методов теоретического исследования в молекулярной физике.
Статистический метод, используемый и развитый в молекулярной физике, состоит в изучении совокупностей большого числа частиц, участвующих в тепловом движении и образующих физические тела, находящиеся в различных агрегатных состояниях. Законы поведения совокупностей большого числа частиц, исследуемых статистическими методами, называются статистическими закономерностями. Математическим аппаратом метода является теория случайных величин и процессов. То есть статистический метод является методом исследования систем, состоящих из большого количества частиц, и использующий статистические закономерности и средние значения физических величин, характеризующих всю совокупность частиц.
Слайд 5
Статистический подход является по сути молекулярно-кинетической теорией, основанной

на определенных представлениях о строении вещества. Задачей статистической механики
является установление законов поведения макроскопических систем, состоящих из большого числа частиц, на основе известных динамических законов поведения отдельных частиц. При этом статистическая механика дает возможность установить связь между макроскопическими параметрами большой системы и средними значениями микроскопических величин, характеризующих отдельные молекулы. Так как макроскопические параметры системы зависят от движения молекул, задачей статистической физики заключается в том, чтобы выразить свойства системы в целом через характеристики отдельных молекул.
Термодинамический метод исследования систем, состоящих из большого числа частиц, отличается от статистического тем, что оперирует величинами, характеризующими систему в целом, такими как, например, температура и давление. Термодинамические методы не рассматривают процессы, происходящие на микроуровне.
Слайд 6
Термодинамический метод исследования систем, состоящих из большого числа

структурных элементов, строится на основе применения к системам нескольких
принципов, гипотез, аксиом, которые либо являются обобщением опыта, либо их применение не противоречит ему. Термодинамика представляет собой феноменологическую теорию, основанную на небольшом числе установленных законов, таких, как, например, закон сохранения энергии. В методе не рассматривают микроструктуру систем и механизм совершающихся в них микропроцессов. Основные понятия термодинамики вводятся на основе физического эксперимента, при этом связь между различными макроскопическими параметрами устанавливается опытным путем. Поэтому результаты и методы термодинамики могут быть применимы для любых систем без конкретизации деталей их устройств. Термодинамический подход дает возможность решать конкретные задачи, не имея сведений о свойствах атомов или молекул.
На основе общих теоретических представлений молекулярной физики получили развитие такие специальные области науки, как физика металлов, физика полимеров, физика плазмы, кристаллофизика, физико-химическую механика, физико-химия дисперсных систем и поверхностных явлений, теория тепло- и массопереноса. При всём различии объектов и методов исследования сохраняется основная идея молекулярной физики - описание макроскопических свойств вещества, исходя из особенностей микроскопической (молекулярной) картины его строения.
Слайд 7
Основы молекулярно-кинетической теории строения вещества (МКТ)
Основные положения МКТ:
Все
вещества состоят из молекул, между которыми имеются межмолекулярные промежутки.
Молекулы
непрерывно и хаотично движутся.
Между молекулами на небольших расстояниях действуют силы межмолекулярного взаимодействия (силы притяжения и отталкивания). Природа этих сил электромагнитная.
Слайд 8
Явления, подтверждающие основные положения МКТ:
диффузия
Брауновское движение
Наличие упругих
сил при изменении объёма и форма тела.
Слайд 9
Температура и внутренняя энергия тела
Температурой (t°) называют физическую
величину, характеризующую степень нагретости тела.
t° – это мера кинетической
энергии молекул газа.
Внутренняя энергия тела – сумма кинетической и потенциальной энергии всех частиц тела.
Слайд 10
ТЕМПЕРАТУРА (от лат. temperatura — надлежащее смешение, нормальное

состояние), физическая величина, характеризующая состояние термодинамического равновесия системы. Температура
всех частей изолированной системы, находящейся в равновесии, одинакова. Если система не находится в равновесии, то между ее частями, имеющими различную температуру, происходит теплообмен. Более высокой температурой обладают те тела, у которых средняя кинетическая энергия молекул (атомов) выше. Измеряют температуру термометрами на основе зависимости какого-либо свойства тела (объема, электрического сопротивления и т. п.) от температуры. Теоретически температура определяется на основе второго начала термодинамики как производная от энергии тела по его энтропии. Так, определяемая температура всегда положительна, ее называют абсолютной температурой или температурой по термодинамической температурной шкале(обозначается Т). За единицу абсолютной температуры в СИ принят кельвин (К). Значения температуры по шкале Цельсия ( t, °С) связаны с абсолютной температурой соотношением t= T-273,15K (1 °С=1 К).
Слайд 11
Характеристика газообразного состояния вещества
Основные свойства:
Летучесть, т. е. газ
занимает весь предоставленный ему объём.
Хорошая сжимаемость.
Объяснение свойств на основе
МКТ: огромное межмолекулярные промежутки и очень слабые силы межмолекулярного взаимодействия.
Молекулы газов движутся поступательно до столкновения с другими молекулами или со стенками сосуда.
V=400-500м/с.
Слайд 12
Моль – это порция вещества, в которой содержится
одинаковое число молекул.
Число молекул в 1 моле вещества постоянно
и называется постоянной Авогадро.
NА=6,02*1023 молек/моль
Число молекул в 1 м3 любого газа постоянно и называется постоянной
m0=m/N или m0= м/N
m – масса газа
m0 – масса 1 молекулы
N – число молекул
м - масса 1 моля вещества
V=m/м или V=N/NА
Число молей вещества.
Понятие моли вещества, постоянная Авогадро
Слайд 13
МОЛЬ, единица количества вещества СИ, обозначается моль. В
1 моле содержится столько молекул (атомов, ионов или каких-либо
др. структурных элементов вещества), сколько атомов содержится в 0,012 кг 12С (углерода с атомной массой 12), т. е. 6,022·1023
АВОГАДРО ПОСТОЯННАЯ (обозначается NА), число молекул или атомов в 1 моле вещества, NА=6,022.1023 моль-1; название в честь А. Авогадро.
Слайд 14
Давление
ДАВЛЕНИЕ, физическая величина, характеризующая интенсивность нормальных (перпендикулярных к
поверхности) сил F, с которыми одно тело действует на
поверхность S другого (напр., фундамент здания на грунт, жидкость на стенки сосуда и т. п.). Если силы распределены вдоль поверхности равномерно, то давление p = F/S. Давление измеряется в Па или в кгс/см2 (то же, что ат), а также в мм рт. ст., атм и др.
Молекулы газа, двигаясь хаотично, сталкиваются со стенками сосуда , создавая тем самым давление.
P=F/S
Давление измеряется отношением суммарной силой удара всех молекул к площади поверхности сосуда.
[p]=Н/м = Па(паскаль)
Слайд 15
Миллиметр ртутного столба = 1 мм рт ст
=133 Па
Техническая атмосфера
1 ат = 9,8*104 Па
Физическая атмосфера
1 атм
= 760 мм рт ст =1*105 Па-нормальное атмосферное давление.
P=pgh
- давление, создаваемое столбом жидкости.
P = m/v (кг/м)
Слайд 16
Вакуумом называют состояние газа ниже атмосферного.
ВАКУУМ в квантовой
теории поля, низшее энергетическое состояние квантового поля. Среднее число
частиц — квантов поля — в вакууме равно нулю, однако в вакууме может происходить рождение виртуальных частиц, которые влияют на физические процессы (что обнаружено экспериментально).
ВАКУУМ (от лат. vacuum — пустота), состояние газа при давлениях p, более низких, чем атмосферное. Различают низкий вакуум (в вакуумных приборах и установках ему соответствует область давлений p выше 100 Па), средний (0,1 Па < p < 100 Па), высокий (10-5 Па < p < 0,1 Па), и сверхвысокий (p < 10-5 Па). Понятие «вакуум» применимо к газу в откаченном объеме и в свободном пространстве, напр. к космосу.
Понятие вакуума, идеального газа. Основное уравнение МКТ газов.
Слайд 17
Идеальным газом называют физическую модель газа, молекулы которого
приняты за материальные точки, а силы межмолекулярного взаимодействия принебригают.
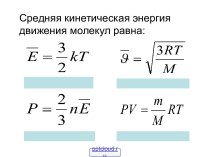
Основное
уравнение МКТ:
P=2/3nоEпост
Давление газа прямопропорционально числу его молекул единицы объёма (концентрации молекул) и средней кинетической энергии поступательного движения молекул газа.
Слайд 18
ИДЕАЛЬНЫЙ ГАЗ, теоретическая модель газа; в которой пренебрегают

размерами частиц газа, не учитывают силы взаимодействия между частицами
газа, предполагая, что средняя кинетическая энергия частиц много больше энергии их взаимодействия, и считают, что столкновения частиц газа между собой и со стенками сосуда абсолютно упругие.
Существуют модель классического идеального газа, свойства которого описываются законами классической физики, и модель квантового идеального газа, подчиняющегося законам квантовой механики. Обе модели идеального газа справедливы для реальных классических и квантовых газов при достаточно высоких температурах и разряжениях.
В модели классического идеального газа газ рассматривают как совокупность огромного числа одинаковых частиц (молекул), размеры которых пренебрежимо малы. Газ заключен в сосуд, и в состоянии теплового равновесия никаких макроскопических движений в нем не происходит. Т. е. это газ, энергия взаимодействия между молекулами которого значительно меньше их кинетической энергии, а суммарный объем всех молекул значительно меньше объема сосуда. Молекулы движутся по законам классической механики независимо друг от друга, и взаимодействуют между собой только во время столкновений, которые носят характер упругого удара. Давление идеального газа на стенку сосуда равно сумме импульсов, переданных за единицу времени отдельными частицами при столкновениях со стенкой, а энергия — сумме энергий отдельных частиц.
Слайд 19
Состояние идеального газа характеризуют три макроскопические величины: P

— давление, V — объем, Т — температура. На
основе модели идеального газа были теоретически выведены ранее установленные опытным путем экспериментальные законы (закон Бойля— Мариотта, закон Гей-Люссака, закон Шарля, закон Авогадро). Эта модель легла в основу молекулярно-кинетических представлений (см. Кинетическая теория газов).
Установленная опытным путем связь между давлением, объемом и температурой газа приближенно описывается уравнением Клапейрона, которое выполняется тем точнее, чем ближе газ по свойствам к идеальному. Классический идеальный газ подчиняется уравнению состояния Клапейрона p = nkT, где р — давление, n - число частиц в единице объема, k — Больцмана постоянная, Т — абсолютная температура. Уравнение состояния и закон Авогадро впервые связали макрохарактеристики газа — давление, температуру, массу — с массой его молекулы.
В идеальном газе, где молекулы не взаимодействуют между собой, энергия всего газа является суммой энергий отдельных молекул и для одного моля одноатомного газа эта энергия U =3/2(RT), где R — универсальная газовая постоянная. Эта величина не связана с движением газа как целого и является внутренней энергией газа. Для неидеального газа внутренняя энергия представляет сбой сумму энергий отдельных молекул и энергии их взаимодействия.
Частицы классического идеального газа распределены по энергиям согласно распределению Больцмана (см. Больцмана статистика).
Слайд 20
Модель идеального газа можно использовать при изучении реальных

газов, так как в условиях, близких к нормальным, а
также при низких давлениях и высоких температурах реальные газы близки по свойствам к идеальному газу.
В современной физике понятие идеальный газ применяют для описания любых слабовзаимодействующих частиц и квазичастиц, бозонов и фермионов. Внеся поправки, учитывающие собственный объем молекул газа и действующие межмолекулярные силы, можно перейти к теории реальных газов.
При понижении температуры Т газа или увеличении его плотности n до определенного значения становятся существенными волновые (квантовые) свойства частиц идеального газа. Переход от классического идеального газа к квантовому происходит при таких значениях Т и n, при которых длины волн де Бройля частиц, движущихся со скоростями порядка тепловых, сравнимы с расстоянием между частицами.
В квантовом случае различают два вида идеального газа: если частицы газа одного вида имеют спин, равный единице, то к ним применяют статистику Бозе — Эйнштейна, если частицы имеют спин, равный Ѕ, то применяют статистику Ферми — Дирака. Применение теории идеального газа Ферми — Дирака к электронам в металлах позволяет объяснить многие свойства металлического состояния.
Слайд 21
Абсолютная (термодинамическая) шкала температур.
Английский физик Кельвин предложил шкалу
температур, в которой за начало отсчета принят абсолютный нуль,
т. е. t°=-273°C
На шкале Кельвина нет отрицательных температур.
T = t°+273
t°=T-273
КЕЛЬВИН, единица термодинамической температуры, равная 1/273,16 части термодинамической температуры тройной точки воды. Обозначается К, до 1968 именовалась градус Кельвина ( °К), названа в честь У. Томсона (Кельвина). Единица Международной практической температурной шкалы; одна из основных единиц СИ. 1К = 1 °С.
Слайд 23
ТЕРМОДИНАМИЧЕСКАЯ ТЕМПЕРАТУРНАЯ ШКАЛА (Кельвина шкала), абсолютная шкала температур,
не зависящая от свойств термометрического вещества (начало отсчета —
абсолютный нуль температуры). Построение термодинамической температурной шкалы основано на втором начале термодинамики и, в частности, на независимости кпд Карно цикла от природы рабочего тела. Единица термодинамической температуры — кельвин (К) — определяется как 1/273,16 часть термодинамической температуры тройной точки воды.
Слайд 24
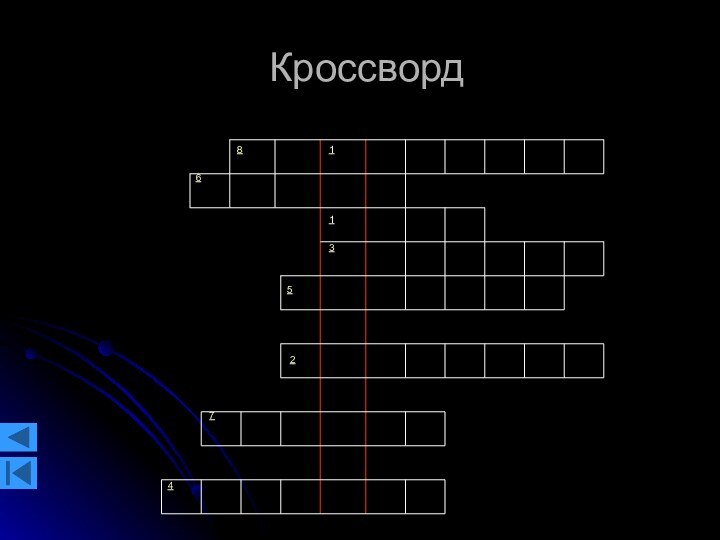
Кроссворд
По вертикали:
Физическая величина, характеризующая степень нагретости тела.
По
горизонтали:
Что называют порцией вещества, в которой содержится одинаковое число
молекул.
Что создают молекулы газа, двигаясь хаотично и сталкиваясь со стенками сосуда.
В чём измеряется давление.
На что нужно поделить силу, при нахождении давления газа.
Кто придумал шкалу температур без отрицательных значений.
На что необходимо поделить массу, при нахождении плотности.
Состояние газа ниже атмосферного.
Как называется свойство, когда газ занимает весь предоставленный ему объём.