- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Молекулярная физика
Содержание
- 2. Основные положения МКТВсе вещества состоят из молекул,
- 3. Качественный анализ МКТ1 положение МКТ доказывается наблюдением
- 4. Количественный анализ МКТNА = 6,02 * 1023
- 5. ТЕМПЕРАТУРАТемпература – мера средней кинетической энергии молекул.В
- 6. Уравнение состояния идеального газа Уравнение Менделеева -
- 7. ГАЗОВЫЕ ЗАКОНЫКоличественные зависимости между двумя параметрами газа
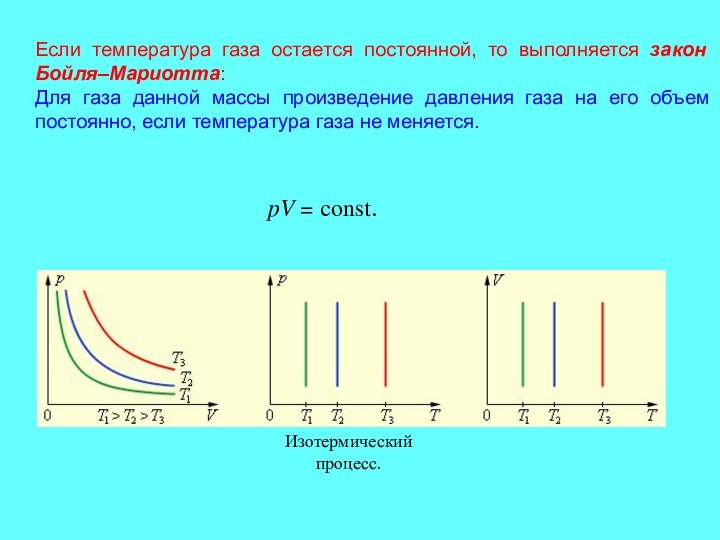
- 8. Если температура газа остается постоянной, то выполняется
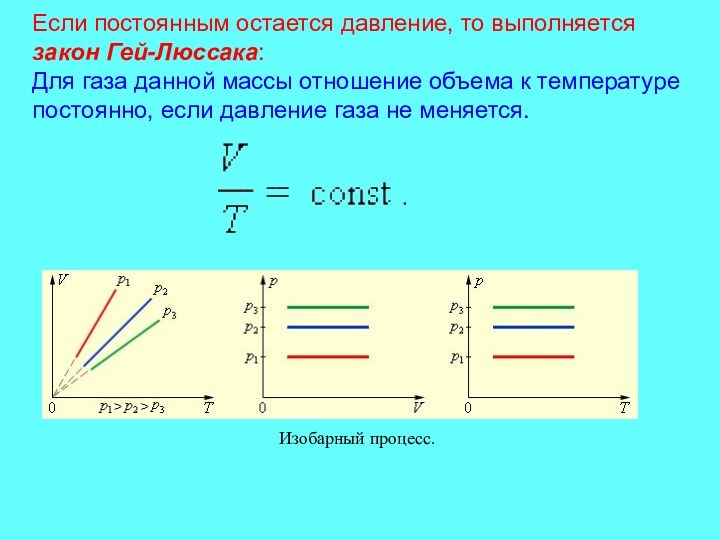
- 9. Если постоянным остается давление, то выполняется закон
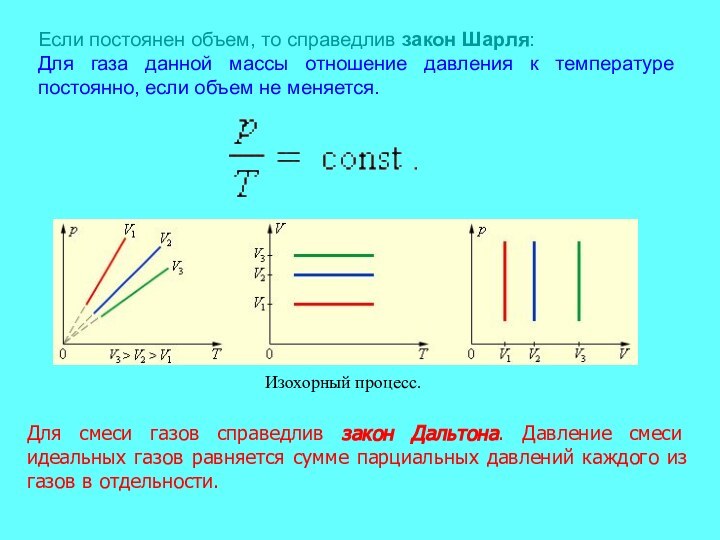
- 10. Если постоянен объем, то справедлив закон Шарля:
- 11. Найди соответствие величины и формулы Величина1. Масса
- 12. Скачать презентацию
- 13. Похожие презентации
Основные положения МКТВсе вещества состоят из молекул, которые разделены промежутками.Молекулы беспорядочно движутся. Между молекулами есть силы взаимодействия.









Слайд 3
Качественный анализ МКТ
1 положение МКТ доказывается наблюдением за
молекулами с помощью ионного проектора или электронного микроскопа и
явлением диффузии – перемешиванием газов, жидкостей и твердых тел при непосредственном контакте.2 положение МКТ доказывается с помощью диффузии и броуновского движения – теплового движения взвешенных в жидкости или в газе частиц.
3 положение МКТ доказывается с помощью давления на стенки сосуда, силы упругости.
Слайд 4
Количественный анализ МКТ
NА = 6,02 * 1023 –
постоянная Авогадро.
M = m0 · NA.
Основное уравнение МКТ для газов
где n – концентрация
вещества, – среднеквадратичная скорость молекул, Eср – средняя кинетическая энергия поступательного движения молекул, k = 1,38·10–23 Дж/К – постоянная Больцмана
Слайд 5
ТЕМПЕРАТУРА
Температура – мера средней кинетической энергии молекул.
В физике
общепринятой является абсолютная температура T. Ее точка отсчета смещена относительно
шкалы Цельсия на 273,15 ºC, а единица шкалы – кельвин – совпадает с градусом Цельсия. Таким образом,p = nkT.
k – постоянная Больцмана = 1,38*10-23 Дж/К
1000 373К
00 273К
-2730 0К
Шкалы
Цельсия кельвина
Слайд 6
Уравнение состояния идеального газа
Уравнение Менделеева - Клапейрона
Здесь ν
– количество вещества, R = 8,31 Дж/(моль·К) – универсальная газовая постоянная.
Слайд 7
ГАЗОВЫЕ ЗАКОНЫ
Количественные зависимости между двумя параметрами газа при
фиксированном значении третьего называют газовыми законами.
T=const; Изотермический процесс.
P=const;
Изобарный процесс.V=const; Изохорный процесс.
Слайд 8 Если температура газа остается постоянной, то выполняется закон
Бойля–Мариотта: Для газа данной массы произведение давления газа на
его объем постоянно, если температура газа не меняется.Слайд 9 Если постоянным остается давление, то выполняется закон Гей-Люссака:
Для газа данной массы отношение объема к температуре постоянно,
если давление газа не меняется.
Слайд 10
Если постоянен объем, то справедлив закон Шарля:
Для
газа данной массы отношение давления к температуре постоянно, если
объем не меняется.Для смеси газов справедлив закон Дальтона. Давление смеси идеальных газов равняется сумме парциальных давлений каждого из газов в отдельности.
Слайд 11
Найди соответствие величины и формулы
Величина
1. Масса молекулы
2.
молярная масса
3. количество вещества
4. число Авогадро
5. постоянная Больцмана
6.
универсальная газовая постоянная7. уравнение состояния идеал. Газа
8. основное уравнение МКТ
9. число молекул
10.уравнение Клапейрона
11.закон Шарля
12.закон Гей-Люссака
13.энергия движения молекул
14.закон Бойля-Мариотта
формула
1. NA=6,02*1023
2. k=1,38*10-23Дж/К
3. R=8,3 Дж/моль.К
4. M=Mr*10-3кг/моль
5. m0=M/NA
6. υ=m/M
7. E=1,5kT
8. p=nkT
9. p=m0nv2/3
10. V1/T1=V2/T2
11. pV=mRT/M
12. pV/T=R
13. p1V1=p2V2
14. p1/T1=p2/T2