методы исследования
Молекулярная физика и термодинамика
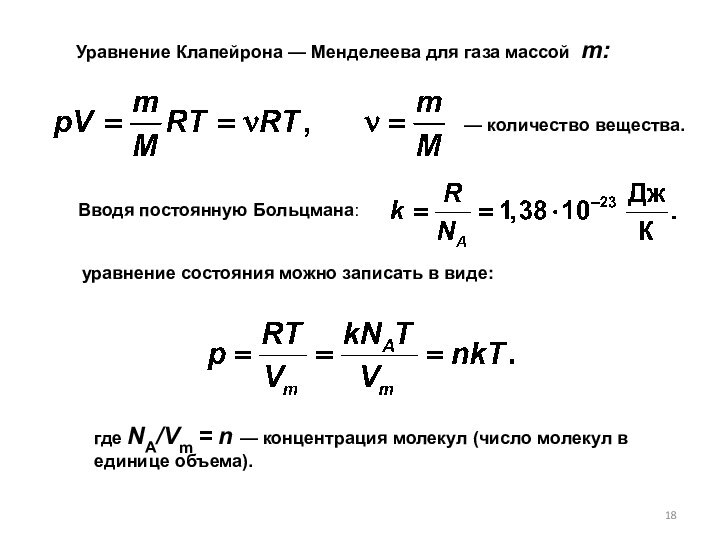
— разделы физики, в которых изучаются зависимости свойств тел от их строения, взаимодействия между частицами и характера движения частиц. Молекулярная физика — раздел физики, изучающий строение и свойства вещества исходя из молекулярно-кинетических представлений.
Основа молекулярной физики — это представление, что все тела состоят из молекул, находящихся в непрерывном хаотическом движении.
Явления в молекулярной физике изучаются с помощью статистического метода.
Статистический метод – это метод исследования систем, состоящих из большого числа частиц и использующий статистические закономерности динамических характеристик этих частиц (скорости, энергии и т. д.).