- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Обратимые и необратимые процессы. Необратимость тепловых процессов. Второй закон термодинамики
Содержание
- 2. Закон сохранения энергии утверждает, что количество
- 3. Из первого закона термодинамики направленность и тем
- 4. Реальные тепловые процессы необратимы.
- 6. Примеры: При диффузии выравнивание концентраций происходит самопроизвольно.
- 7. Теплообмен, как показывает опыт, также является односторонне
- 8. Необратимым является также процесс превращения механической энергии во внутреннюю при неупругом ударе или при трении.
- 10. Существуют несколько формулировок второго закона термодинамики. Одна
- 12. Вечный двигатель первого рода — непрерывно или
- 13. Статистическое истолкование необратимости процессов в природеПронумеруем молекулы
- 15. Молекулы идеального газа движутся практически независимо друг
- 16. Но если взять реальное число молекул газа
- 17. Скачать презентацию
- 18. Похожие презентации
Закон сохранения энергии утверждает, что количество энергии при любых ее превращениях остается неизменным. Между тем многие процессы, вполне допустимые с точки зрения закона сохранения энергии, никогда не протекают в действительности.
















Слайд 3 Из первого закона термодинамики направленность и тем самым
необратимость тепловых процессов не вытекает.
Первый закон термодинамики требует
лишь, чтобы количество теплоты, отданное одним телом, в точности равнялось количеству теплоты, которое получит другое.
Слайд 6
Примеры:
При диффузии выравнивание концентраций происходит самопроизвольно.
Обратный же процесс сам по себе никогда не пойдет:
никогда самопроизвольно смесь газов, например, не разделится на составляющие ее компоненты. Следовательно, диффузия — необратимый процесс.Слайд 7 Теплообмен, как показывает опыт, также является односторонне направленным
процессом. В результате теплообмена энергия передается сама по себе
всегда от тела с более высокой температурой к телу с более низкой температурой. Обратный процесс передачи теплоты от холодного тела к горячему сам по себе никогда не происходит.Слайд 8 Необратимым является также процесс превращения механической энергии во
внутреннюю при неупругом ударе или при трении.
Слайд 10 Существуют несколько формулировок второго закона термодинамики. Одна из
них принадлежит немецкому учёному Р. Клаузису –
«Невозможен процесс,
единственным результатом которого был бы переход количества теплоты от холодного тела к горячему».Другими словами, теплообмен в замкнутой системе может происходить только в одном направлении – от горячего тела к холодному.
Слайд 12 Вечный двигатель первого рода — непрерывно или периодически
действующая машина, которая совершала бы работу, большую подводимой к
ней извне энергии, нарушает закон сохранения энергии, он же первое начало термодинамикиИз второго закона термодинамики вытекает невозможность создания вечного двигателя второго рода, т.е. двигателя, который бы совершал работу за счет охлаждения какого-либо одного тела.
Слайд 13
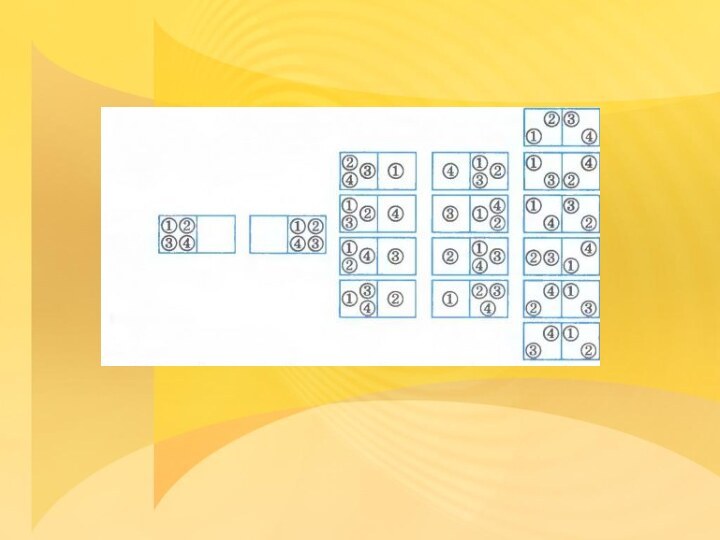
Статистическое истолкование необратимости процессов в природе
Пронумеруем молекулы цифрами
1, 2, 3, 4.
Возможны 16 различных микросостояний, все
они изображены на рисункеВероятность того, что все молекулы соберутся в левой половине сосуда, равна:
Вероятность же того, что молекулы распределятся поровну, будет в 6 раз больше:
Вероятность того, что в одной половине сосуда, например левой, будет три молекулы, а в другой соответственно одна молекула, равна
Большую часть времени молекулы будут распределены в половинках сосуда поровну: это наиболее вероятное состояние.
Слайд 15 Молекулы идеального газа движутся практически независимо друг от
друга. Для одной молекулы вероятность того, что она окажется
в левой половине сосуда, равна, очевидно, 1/2. Такова же вероятность и для другой молекулы. Эти события независимы, и вероятность того, что первая и вторая молекулы окажутся в левой половине сосуда, равна произведению вероятностей событии:1/2•1/2=1/4=1/22.Для трех молекул вероятность их нахождения в левой половине сосуда равна 1/23, а для четырех - 1/24. Именно такое значение вероятности мы и получили при детальном рассмотрении распределения молекул по сосуду.
Слайд 16 Но если взять реальное число молекул газа в
1 см3 при нормальных условиях (n=3•1019), то вероятность того,
что молекулы соберутся в одной половине сосуда объемом 1 см3, будет совершенно ничтожна:Таким образом, только из-за большого числа молекул в макросистемах процессы в природе оказываются практически необратимыми. В принципе обратные процессы возможны, но вероятность их близка к нулю. Не противоречит, строго говоря, законам природы процесс, в результате которого при случайном движении молекул все они соберутся в одной половине класса, а учащиеся в другой половине класса задохнутся. Но реально это событие никогда не происходило в прошлом и не произойдет в будущем. Слишком мала вероятность подобного события, чтобы оно когда-либо случилось за все время существования Вселенной в современном ее состоянии - около нескольких миллиардов лет.
По приблизительным оценкам, эта вероятность примерно такого же порядка, как и вероятность того, что 20 000 обезьян, хаотично ударяя по клавишам пишущих машинок, напечатают без единой ошибки «Войну и мир» Л. Н. Толстого. В принципе это возможно, но реально никогда не произойдет.





























