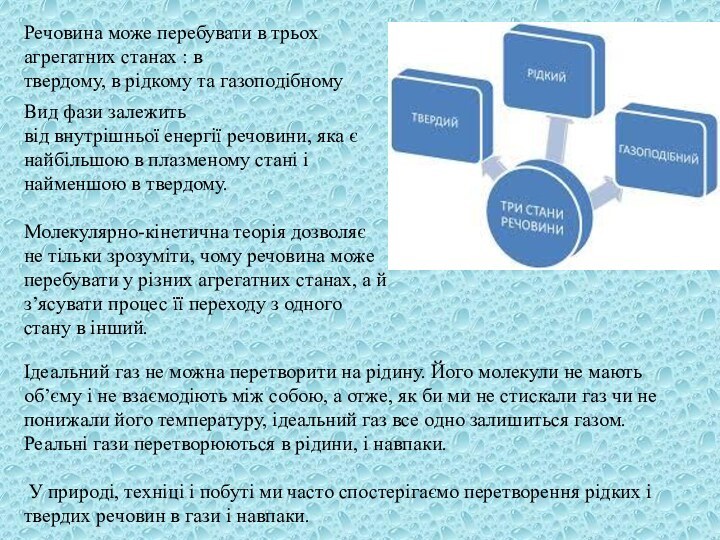
в
твердому, в рідкому та газоподібному
Вид фази залежить
від внутрішньої енергії речовини, яка є найбільшою в плазменому стані і
найменшою в твердому.
Молекулярно-кінетична теорія дозволяє не тільки зрозуміти, чому речовина може перебувати у різних агрегатних станах, а й з’ясувати процес її переходу з одного стану в інший.
Ідеальний газ не можна перетворити на рідину. Його молекули не мають об’єму і не взаємодіють між собою, а отже, як би ми не стискали газ чи не понижали його температуру, ідеальний газ все одно залишиться газом. Реальні гази перетворюються в рідини, і навпаки.
У природі, техніці і побуті ми часто спостерігаємо перетворення рідких і твердих речовин в гази і навпаки.