- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Перманганатометрия. Окислительно-восстановительное титрование. (Лекция 8)
Содержание
- 2. ПланСущность метода ОВТКлассификация методов ОВТТребования к реакциямКривые окислительно-восстановительного титрования ПерманганатометрияВозможности метода
- 3. Сущность метода Red1
- 4. Классификация Оксидиметрия – титрантом является раствор окислителя:- перманганатометрия
- 5. Требования к реакциям Реакции должны протекать практически
- 6. Реальные потенциалы редокс-пар рассчитывают по уравнению Нернста:
- 7. Реакции должны протекать достаточно быстро. Конечная точка титрования должна определяться четко и однозначно.
- 8. Если схематично обозначить окисленную и восстановленную формы
- 9. Кривые окислительно-восстановительного титрования Кривая титрования в
- 10. 5 Fe2+ - ē ⇄ Fe3+1
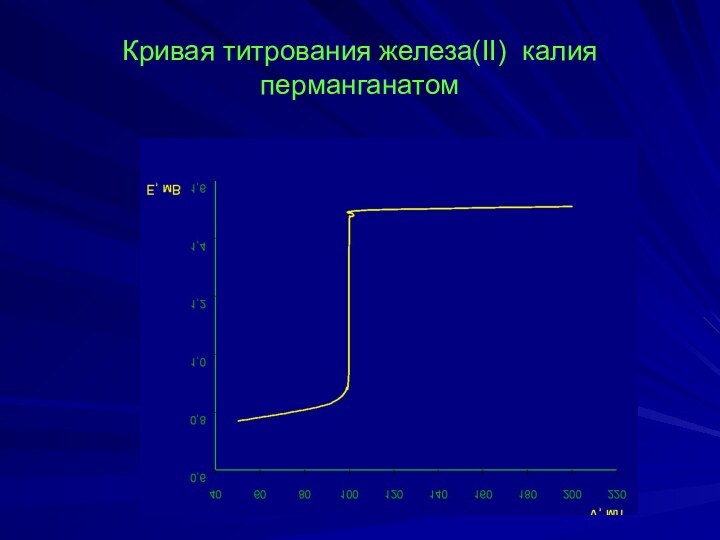
- 12. Кривая титрования железа(II) калия перманганатом
- 13. В сильнокислой среде в присутствии серной кислоты:MnO4-
- 14. В КТТ розовая окраска частично обесцвечивается
- 15. 4 MnO4- + 2 H2O ⮀ 4 MnO2 + 3 O2↑ + 4 OH-
- 16. Стандартизацию раствора КМnO4проводят по Na2C2O4, H2C2О4·2H2О, (NH4)2C2O4, As2O3, Fe(мет.), К4[Fe(CN)б], соли Мора (NH4)2SO4·FeSO4·6Н2О.
- 17. Стандартизация по H2C2О4·2H2О 2 MnO4- + 8 H+
- 18. Возможности методавосстановители: ионы низших степеней окисления (Fe2+,
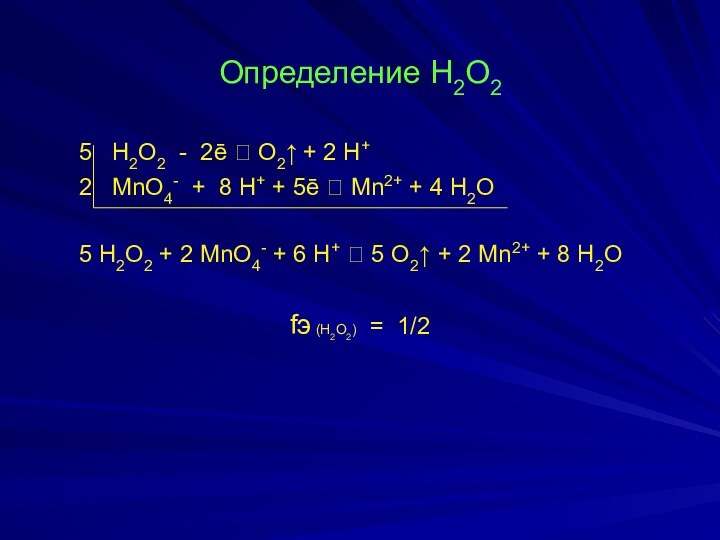
- 19. Определение Н2О2 5 Н2О2 - 2ē
- 20. Определение железа(II) в соли Мора (NH4)2Fe(SO4)2∙6H2O или
- 21. Скачать презентацию
- 22. Похожие презентации
ПланСущность метода ОВТКлассификация методов ОВТТребования к реакциямКривые окислительно-восстановительного титрования ПерманганатометрияВозможности метода














![Перманганатометрия. Окислительно-восстановительное титрование. (Лекция 8) Стандартизацию раствора КМnO4проводят по Na2C2O4, H2C2О4·2H2О, (NH4)2C2O4, As2O3, Fe(мет.), К4[Fe(CN)б], соли Мора (NH4)2SO4·FeSO4·6Н2О.](/img/tmb/15/1458141/859f601c9e997b89a4a2442f2278411c-720x.jpg)




Слайд 2
План
Сущность метода ОВТ
Классификация методов ОВТ
Требования к реакциям
Кривые окислительно-восстановительного
титрования
Слайд 4
Классификация
Оксидиметрия – титрантом является раствор окислителя:
- перманганатометрия (KMnO4);
-
дихроматометрия (K2Cr2O7);
- броматометрия (KBrO3);
- цериметрия (раствор солей церия(IV));
- йодхлорметрия
(ICl);- нитритометрия (NaNO2).
Редуктометрия – титрантом является раствор восстановителя:
- титанометрия (раствор солей титана(III));
- феррометрия (FeSO4);
- аскорбинометрия (С6Н8О6).
Слайд 5
Требования к реакциям
Реакции должны протекать практически до
конца.
- стандартные
ОВ потенциалы редокс-пар, участвующих в реакции;n1 и n2 – количество перераспределяемых электронов.
Слайд 6
Реальные потенциалы редокс-пар рассчитывают по уравнению Нернста:
- стандартный окислительно-восстановительный потенциал
данной редокс-пары;- количество электронов, принимающих участие в ОВР;
- универсальная газовая постоянная (8,314 Дж·моль-1 К-1);
- постоянная Фарадея (96500 Кл/моль);
- температура по шкале Кельвина (К);
aOx и aRed - активность окисленной и восстановленной
Слайд 7
Реакции должны протекать достаточно быстро.
Конечная
точка титрования должна определяться четко и однозначно.
Слайд 8 Если схематично обозначить окисленную и восстановленную формы индикатора
в виде IndOx и IndRed, то полуреакцию, отвечающую изменению
окраски можно представить:IndOx + nē ⇄ IndRed
ОВ потенциал редокс-пары IndOx/IndRed описывается уравнением Нернста:
интервал перехода окраски индикатора:
Слайд 9
Кривые окислительно-восстановительного титрования
Кривая титрования в редокс-метрии
– это графическое изображение изменения потенциала от объема прибавленного
титранта.До точки эквивалентности потенциал рассчитывают по определяемой редокс-паре.
В точке эквивалентности потенциал раствора рассчитывают по формуле:
После точки эквивалентности потенциал раствора
рассчитывают по редокс-паре титранта.
Слайд 10
5 Fe2+ - ē ⇄ Fe3+
1
MnO4- + 8 H+ + 5ē ⇄ Mn2+ +
4 H2O5 Fe2+ + MnO4- + 8 H+ ⇄ 5 Fe3+ + Mn2+ + 4 H2O
Кривая титрования железа(II) калия перманганатом
100,0 мл 0,1 н. раствора FeSO4 титруют 0,1 н. раствором KMnO4 с концентрацией ионов водорода [H+]=1 моль/л.
Слайд 11
= +0,77 В
= +1,51 В Точка начала скачка титрования:
ТЭ
После ТЭ:
Точка конца скачка титрования:
Скачок на кривой титрования находится в пределах потенциала 0,94-1,48 В.
До ТЭ
Слайд 13
В сильнокислой среде в присутствии серной кислоты:
MnO4- +
8 H+ + 5ē ⮀ Mn2+ + 4 H2O
Е˚MnO4-,
Н+/ Mn2+ = 1,51 Вfэ = 1/5
В нейтральной:
MnO4- + 2 H2O + 3ē ⮀ MnO2↓ + 4 OH-
Е˚MnO4-/MnO2↓, OH- = 0,59 В
fэ = 1/3
В щелочной среде:
MnO4- + ē ⮀ MnO42-
Е˚MnO4-/ MnО42- = 0,56 В
fэ = 1
Слайд 14
В КТТ розовая окраска частично обесцвечивается вследствие
реакции:
2 MnO4- + 3 Mn2+ + 2 H2O ⮀
5 MnO2↓ + 4 H+ реакция Гаярда
Слайд 16
Стандартизацию раствора КМnO4
проводят по
Na2C2O4, H2C2О4·2H2О, (NH4)2C2O4, As2O3,
Fe(мет.),
К4[Fe(CN)б], соли Мора (NH4)2SO4·FeSO4·6Н2О.
Слайд 17
Стандартизация по H2C2О4·2H2О
2 MnO4- + 8 H+ +
5ē ⮀ Mn2+ + 4 H2O
5 H2C2O4 -
2 ē ⮀ 2 CO2⭡ + 2 H+2 MnO4- + 5 H2C2O4 + 6 H+ ⮀ 2 Mn2+ + 10 CO2↑ + 8 H2O
fэ(H2C2О4•2H2О) = 1/2
H2C2О4 ⮀ CO2⭡ + СО⭡ + H2O
Слайд 18
Возможности метода
восстановители: ионы низших степеней окисления (Fe2+, Cr2+,
Sn2+, AsIII и др.), анионы (Cl-, Br-, S2-, SO32-,
SCN-, NO2- и др.), поли- и оксикарбоновые кислоты, альдегиды, сахара и др. чаще прямым способом титрования;окислители: Fe3+, CeIV, CrVI, BrO3-, S2O82- и др. способом обратного титрования;
вещества, не обладающие окислительно-восстановительными свойствами (индифферентные вещества): Ba2+, Ca2+, Sr2+, Zn2+ способом обратного и заместительного титрования.
Слайд 19
Определение Н2О2
5 Н2О2 - 2ē ⮀
О2↑ + 2 Н+
2 MnO4- + 8
H+ + 5ē ⮀ Mn2+ + 4 H2O5 H2O2 + 2 MnO4- + 6 H+ ⮀ 5 O2↑ + 2 Mn2+ + 8 H2O
fэ (Н2О2) = 1/2
Слайд 20 Определение железа(II) в соли Мора (NH4)2Fe(SO4)2∙6H2O или FeSO4∙7H2O
5 Fe2+- ē ⇄ Fe3+
1 MnO4- +
8 H+ + 5ē ⇄ Mn2+ + 4 H2O 5 Fe2+ + MnO4- + 8 H+ ⇄ 5 Fe3+ + Mn2+ + 4 H2O
fэ (Fe) = 1