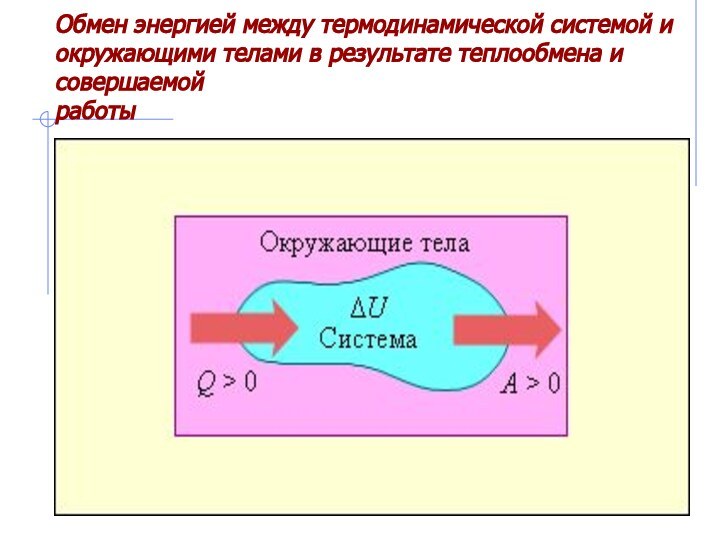
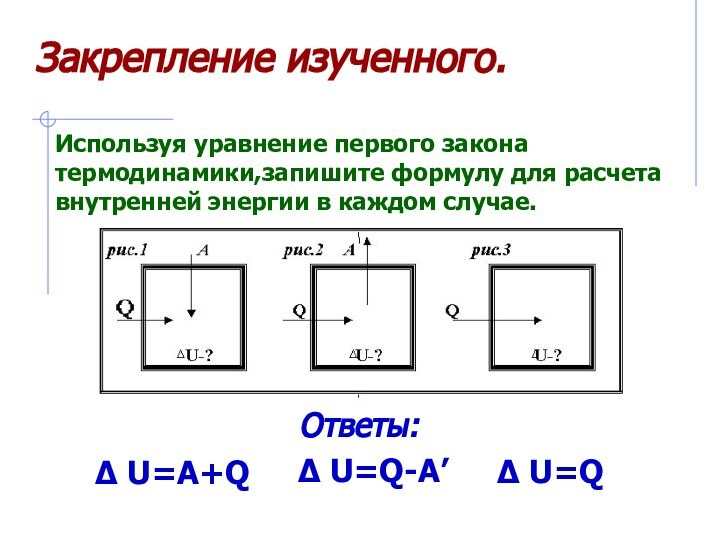
– первый закон термодинамики.
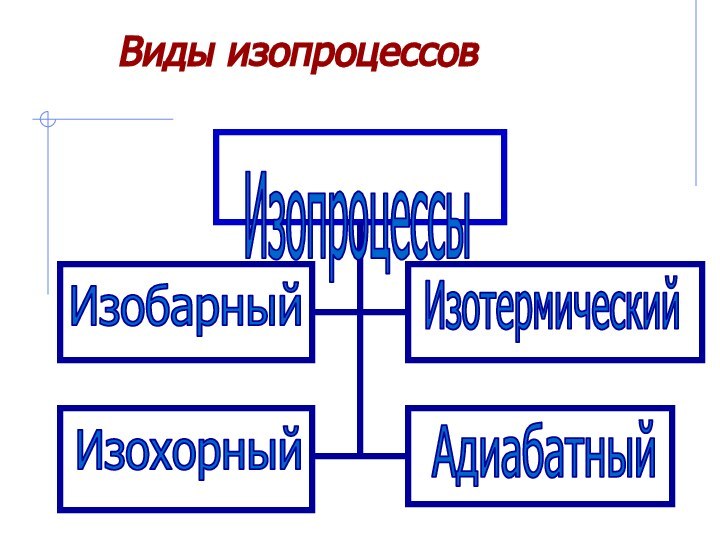
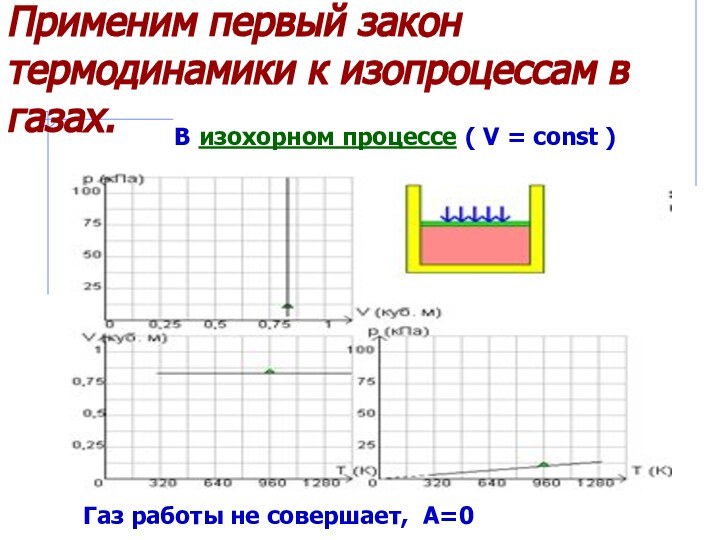
Рассмотреть изопроцессы в газах с энергетической
точки зрения, примененив к ним первый закон термодинамики.Дать понятие адиабатического процесса.
Цели