- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Поверхностные явления
Содержание
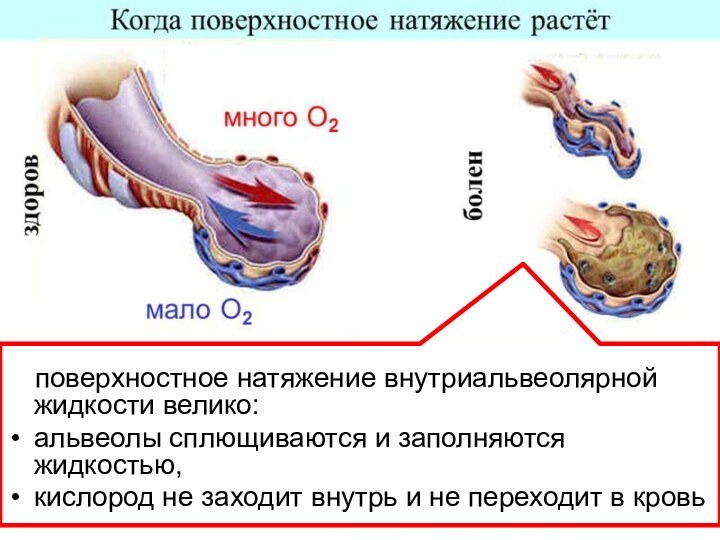
- 2. Поверхностные явления – эффекты и особенности
- 3. Молекулы на поверхности стремятся «втянуться» внутрь
- 4. Физический смысл поверхностного натяжения Энергетическая трактовка: поверхностное
- 5. Благодаря поверхностному натяжению капля жидкости в свободном падении принимает сферическую форму.
- 6. Факторы, влияющие на поверхностное натяжение1) ТемператураС
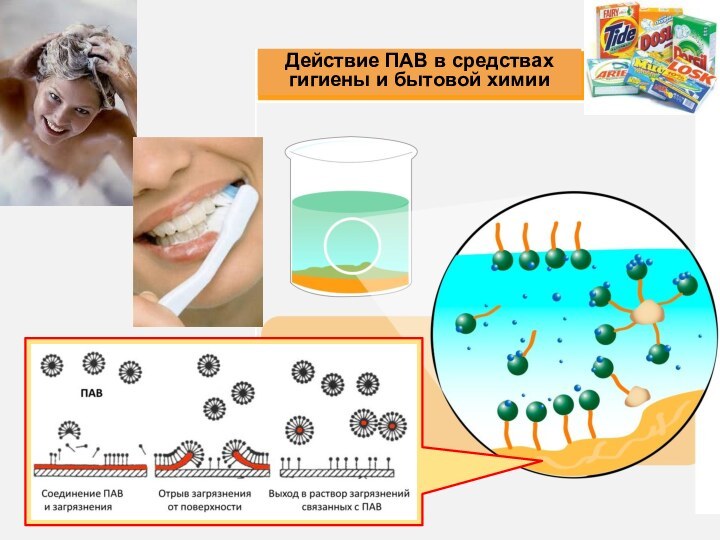
- 7. 3) Природа и концентрация растворенных веществ
- 8. ПИВ - неорганические вещества (электролиты)Ионы
- 9. неполярные части имеют углеводородную структуру (радикал); полярные
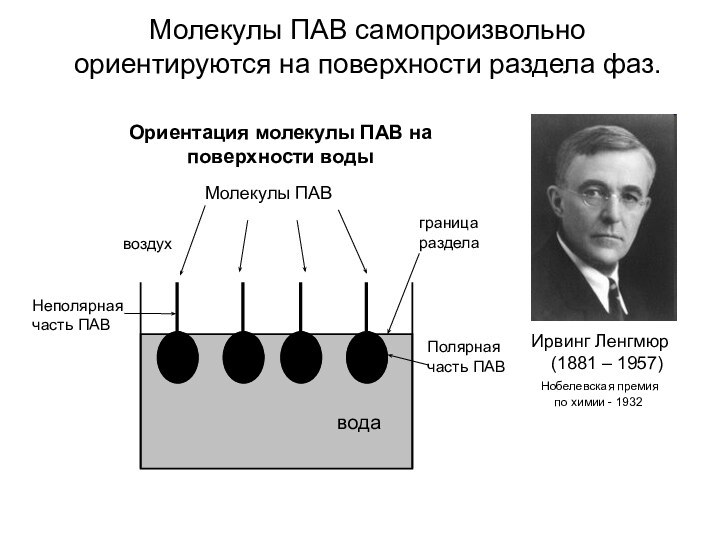
- 10. Молекулы ПАВ самопроизвольно ориентируются на
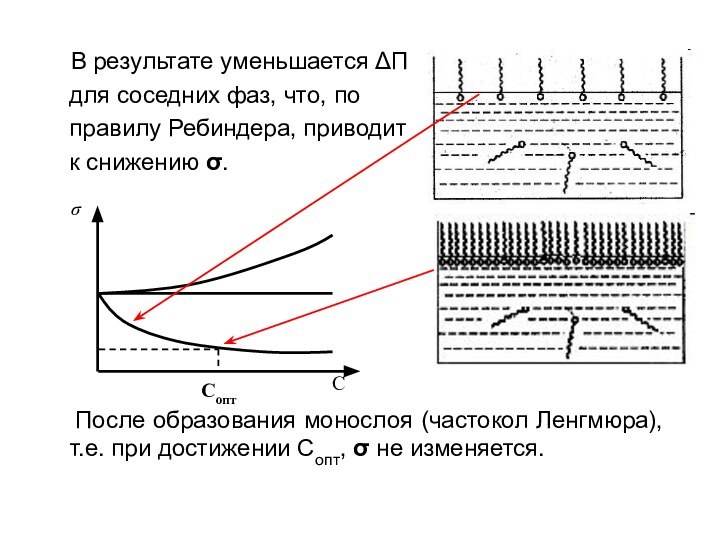
- 11. В результате уменьшается ΔП
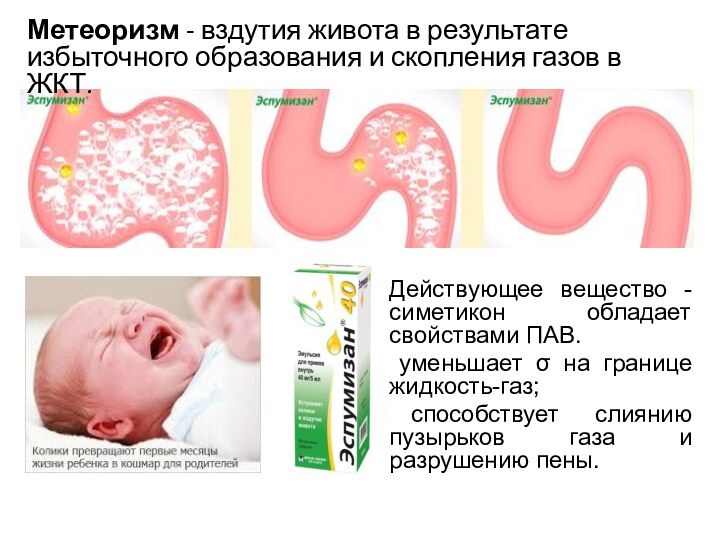
- 12. Действующее вещество - симетикон обладает свойствами ПАВ.
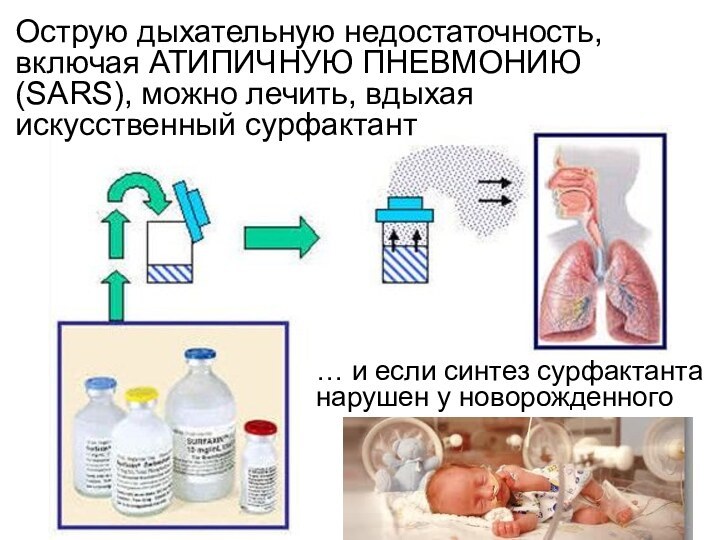
- 15. Острую дыхательную недостаточность, включая АТИПИЧНУЮ ПНЕВМОНИЮ (SARS),
- 17. Количественной мерой способности ПАВ понижать
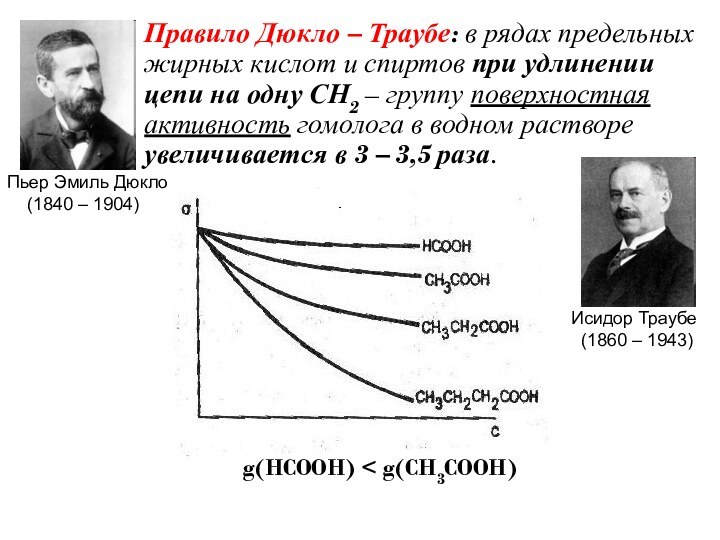
- 18. Правило Дюкло – Траубе: в рядах предельных
- 19. аБсорбция - самопроизвольный процесс
- 20. Адсорбция на подвижных границах (жидкость – газ;
- 21. Изотерма адсорбции Гиббса Уравнение адсорбции Гиббса:Для ПАВ:
- 22. Адсорбция на неподвижных границах (твердое тело
- 23. Физическая адсорбция (ФАд) возникает за счет ван-дер-ваальсовых
- 24. Адсорбция (Г) на подвижной и неподвижной границах
- 25. Адсорбция газов на твердой поверхностиЗависит от:природы поверхности:
- 26. 3) природы поглощаемого газа или пара. Лучше
- 27. ИЗОБРЕТЕНИЕ, КОТОРОЕ СПАСЛО ТЫСЯЧИ ЖИЗНЕЙВ 1915 году
- 28. Отличие от адсорбции газов –
- 29. Молекулярная (неэлектролитов) адсорбцияЗависит от:1) природы адсорбента. Полярные
- 30. Адсорбция ионов из растворов в зависимости от природы
- 31. Ионная адсорбцияПо сравнению с молекулярной адсорбцией более
- 32. Зависит от:1) природы адсорбента. Чем более полярный
- 33. Избирательная адсорбция ионовправило Панета – Фаянса
- 34. Ионообменная адсорбция Ионообменная адсорбция – процесс,
- 35. Катиониты – нерастворимые многоосновные кислоты; обменивают катионы.
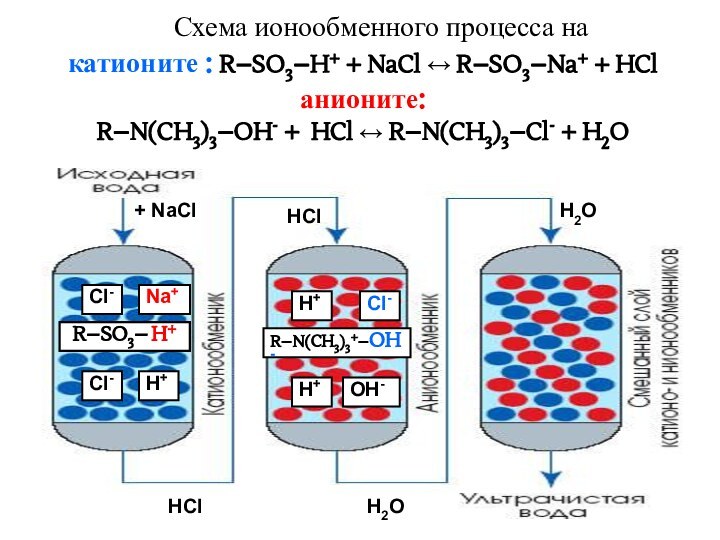
- 36. Схема ионообменного процесса на катионите : R–SO3–H+
- 37. Скачать презентацию
- 38. Похожие презентации
















Слайд 2 Поверхностные явления – эффекты и особенности поведения веществ,
которые наблюдаются на поверхности раздела фаз.
Слайд 3 Молекулы на поверхности стремятся «втянуться» внутрь –
поверхность раздела уменьшается, а поверхностная энергия увеличивается.
Поверхностная энергия и
поверхностное натяжение
В объеме жидкости результирующая сила действия на молекулу равна нулю. В поверхностном слое межмолекулярные силы не уравновешиваются и их равнодействующая не равна нулю.
Для выведения молекул на поверхность надо совершить работу.
Слайд 4
Физический смысл поверхностного натяжения
Энергетическая трактовка: поверхностное натяжение
равно работе, затраченной на образование единицы поверхности:
Силовое определение: поверхностное натяжение – это сила, действующая на поверхности по касательной к ней и стремящаяся сократить ее площадь до min ([Н/м]).
При 298 К воды = 71,9610-3 Дж/м2 = 71,9610-3 Н/м.
Дж/м2 = Нм/м2 = Н/м.
Слайд 5 Благодаря поверхностному натяжению капля жидкости в свободном падении
принимает сферическую форму.
Слайд 6
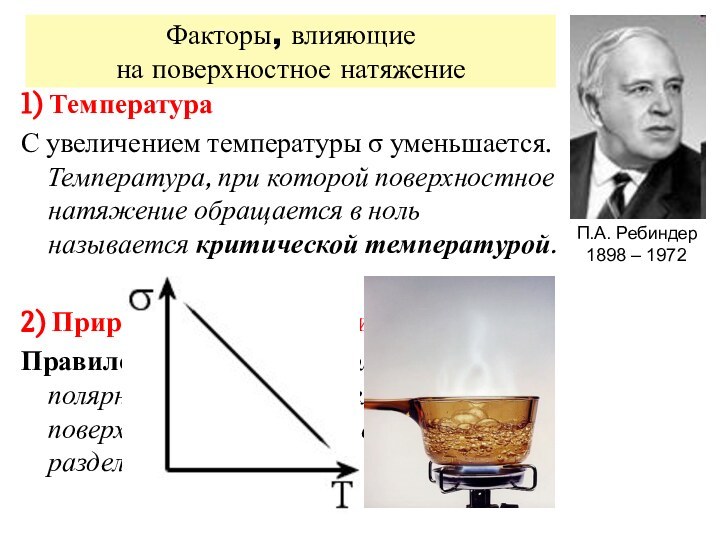
Факторы, влияющие
на поверхностное натяжение
1) Температура
С увеличением температуры
уменьшается.
Температура, при которой поверхностное натяжение обращается
в ноль называется критической температурой. 2) Природа фазообразующих веществ
Правило Ребиндера: чем больше разность полярностей (П) фаз, тем сильнее поверхностное натяжение на границе их раздела.
П.А. Ребиндер
1898 – 1972
Слайд 7
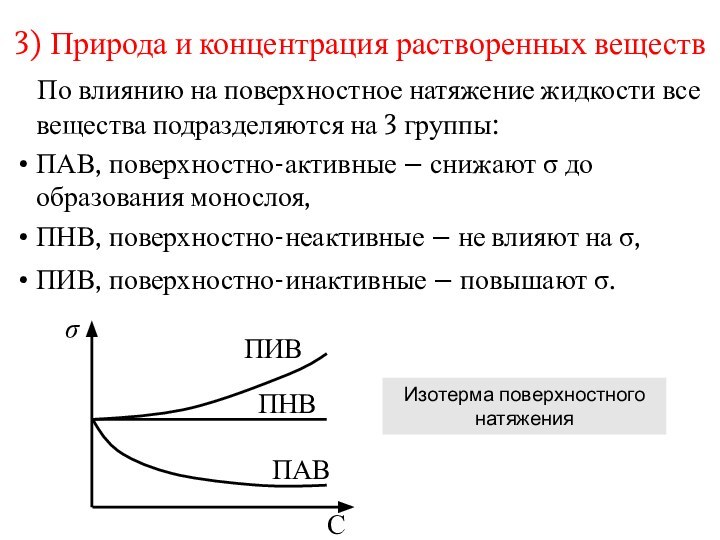
3) Природа и концентрация растворенных веществ
По
влиянию на поверхностное натяжение жидкости все вещества подразделяются на
3 группы:ПАВ, поверхностно-активные – снижают до образования монослоя,
ПНВ, поверхностно-неактивные – не влияют на ,
ПИВ, поверхностно-инактивные – повышают .
Изотерма поверхностного натяжения
Слайд 8
ПИВ - неорганические вещества (электролиты)
Ионы хорошо
гидратируются, поэтому втягиваются в глубину раствора и усиливают полярные
свойства системы.
В результате возрастает ΔП для соседних фаз, что, по правилу Ребиндера, приводит к увеличению .
Слайд 9
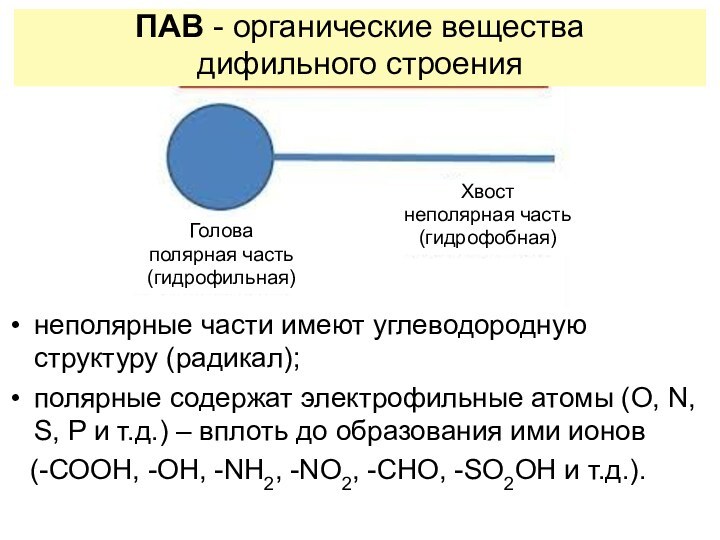
неполярные части имеют углеводородную структуру (радикал);
полярные содержат
электрофильные атомы (O, N, S, P и т.д.) –
вплоть до образования ими ионов(-СООН, -ОН, -NH2, -NO2, -CHO, -SO2OH и т.д.).
Слайд 10 Молекулы ПАВ самопроизвольно ориентируются на поверхности
раздела фаз.
Ирвинг Ленгмюр
(1881 – 1957)Нобелевская премия
по химии - 1932
Слайд 11
В результате уменьшается ΔП
для соседних фаз, что, по
правилу
Ребиндера, приводит к снижению .
После образования монослоя (частокол Ленгмюра), т.е. при достижении Сопт, не изменяется.
Сопт
Слайд 12
Действующее вещество - симетикон обладает свойствами ПАВ.
уменьшает σ на границе жидкость-газ;
способствует слиянию пузырьков газа
и разрушению пены.Метеоризм - вздутия живота в результате избыточного образования и скопления газов в ЖКТ.
Слайд 15 Острую дыхательную недостаточность, включая АТИПИЧНУЮ ПНЕВМОНИЮ (SARS), можно
лечить, вдыхая искусственный сурфактант
… и если синтез сурфактанта нарушен
у новорожденногоСлайд 17 Количественной мерой способности ПАВ понижать поверхностное
натяжение на границе раздела фаз служит поверхностная активность (g):
, (Джм/моль)g – понижение поверхностного натяжения раствора при изменении концентрации ПАВ на единицу.
Поверхностная активность зависит от хим. структуры веществ: природы полярной и строения неполярной частей молекулы.
Слайд 18 Правило Дюкло – Траубе: в рядах предельных жирных
кислот и спиртов при удлинении цепи на одну СН2
– группу поверхностная активность гомолога в водном растворе увеличивается в 3 – 3,5 раза.g(HCOOH) < g(CH3COOH)
Исидор Траубе
(1860 – 1943)
Пьер Эмиль Дюкло
(1840 – 1904)
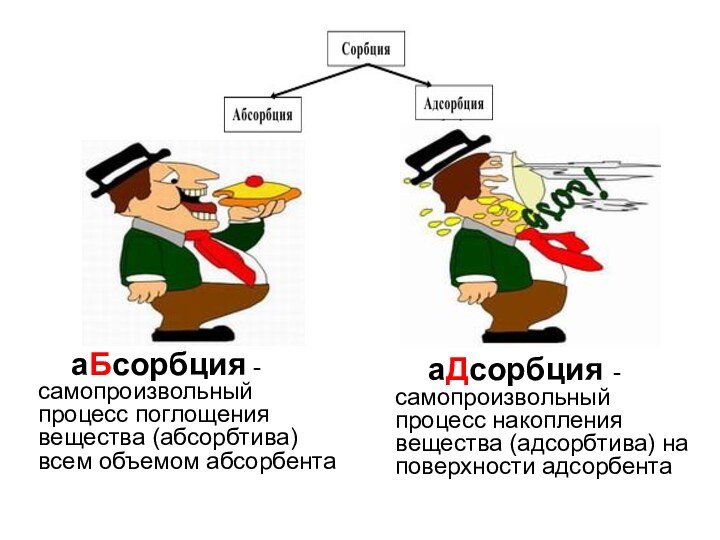
Слайд 19 аБсорбция - самопроизвольный процесс поглощения
вещества (абсорбтива) всем объемом абсорбента
аДсорбция -
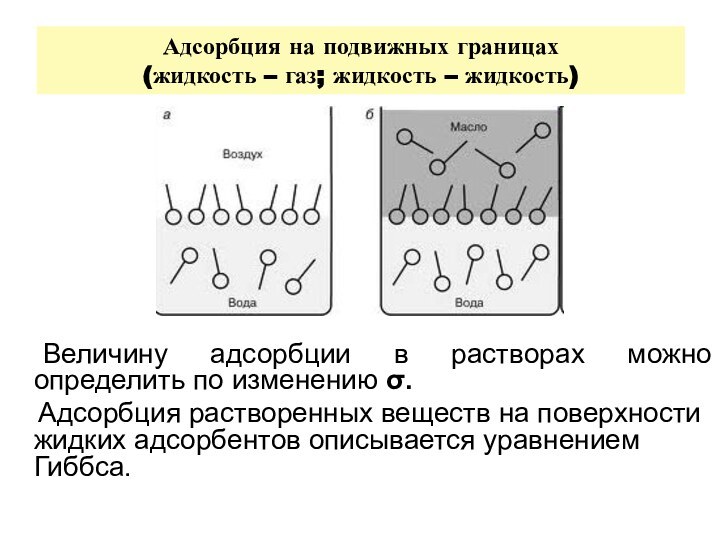
самопроизвольный процесс накопления вещества (адсорбтива) на поверхности адсорбентаСлайд 20 Адсорбция на подвижных границах (жидкость – газ; жидкость –
жидкость)
Величину адсорбции в растворах можно определить по
изменению . Адсорбция растворенных веществ на поверхности жидких адсорбентов описывается уравнением Гиббса.
Слайд 21
Изотерма адсорбции Гиббса
Уравнение адсорбции Гиббса:
Для ПАВ:
0; g >0;
Г > 0 – адсорбция положительна.
Для
ПИВ: > 0; g < 0;
Г < 0 – адсорбция отрицательна.
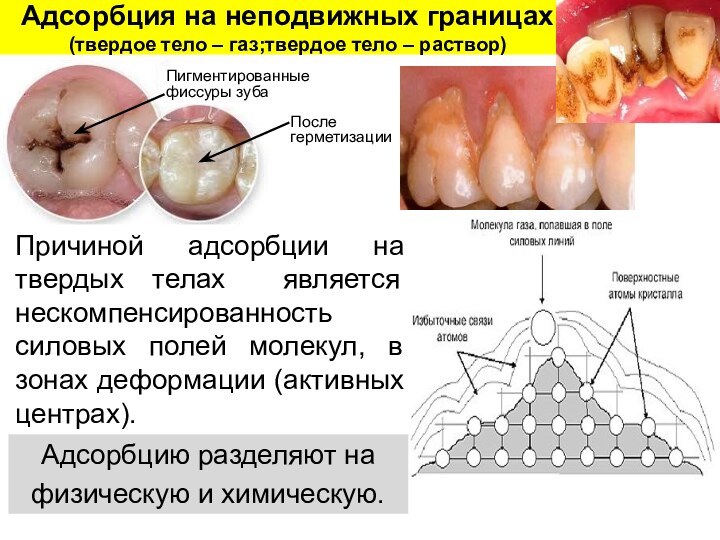
Слайд 22 Адсорбция на неподвижных границах (твердое тело – газ;твердое
тело – раствор)
Причиной адсорбции на твердых телах является нескомпенсированность
силовых полей молекул, в зонах деформации (активных центрах). Адсорбцию разделяют на
физическую и химическую.
Слайд 23 Физическая адсорбция (ФАд) возникает за счет ван-дер-ваальсовых взаимодействий
и происходит на активных центрах (во впадинах поверхности).
Химическая адсорбция (хемосорбция) (ХАд) осуществляется путем химического взаимодействия молекул адсорбента и адсорбата и приходится на выступы рельефа поверхности. Различия:
1. ФАд – обратима, а ХАд – необратима;
2. С увеличением t величина ФАд уменьшается, а
ХАд увеличивается.
Активные центры физической (а) и химической (б) адсорбции
Слайд 24 Адсорбция (Г) на подвижной и неподвижной границах раздела
описывается уравнением Ленгмюра
Г∞ – предельная адсорбция;
b – const,
равная отношению констант скоростей десорбции и адсорбции.
Слайд 25
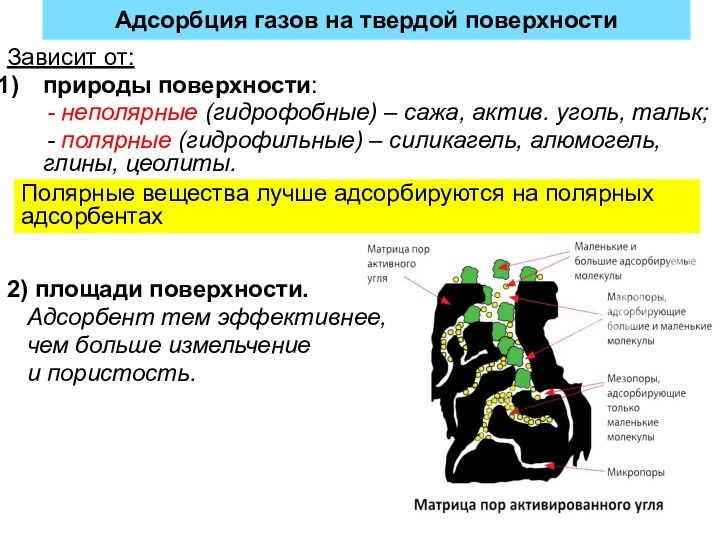
Адсорбция газов на твердой поверхности
Зависит от:
природы поверхности:
- неполярные (гидрофобные) – сажа, актив. уголь,
тальк;- полярные (гидрофильные) – силикагель, алюмогель, глины, цеолиты.
2) площади поверхности.
Адсорбент тем эффективнее,
чем больше измельчение
и пористость.
Полярные вещества лучше адсорбируются на полярных адсорбентах
Слайд 26
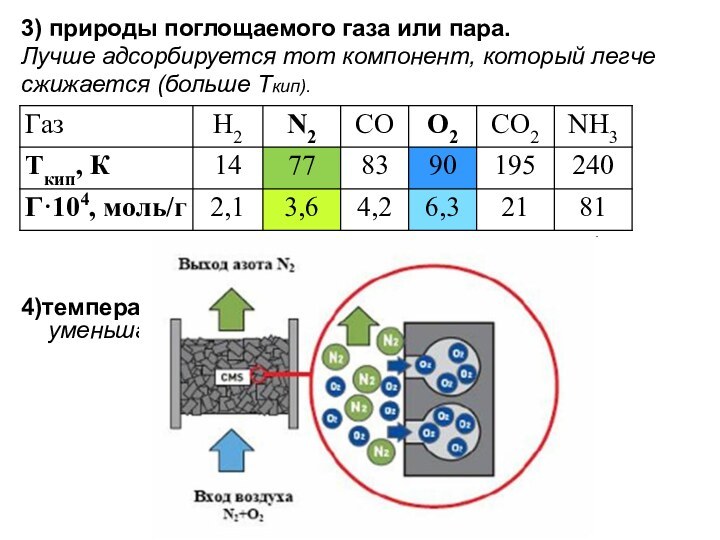
3) природы поглощаемого газа или пара.
Лучше адсорбируется
тот компонент, который легче
сжижается (больше Ткип).
4)температуры. С
повышением t адсорбция газов уменьшается.
Слайд 27
ИЗОБРЕТЕНИЕ, КОТОРОЕ СПАСЛО ТЫСЯЧИ ЖИЗНЕЙ
В 1915 году русский
химик-органик, академик АН СССР
ЗЕЛИНСКИЙ Н.Д. с инженером КУММАНТОМ А.
изобрели
ПРОТИВОГАЗЗелинский Н.Д.
(1861 – 1953)
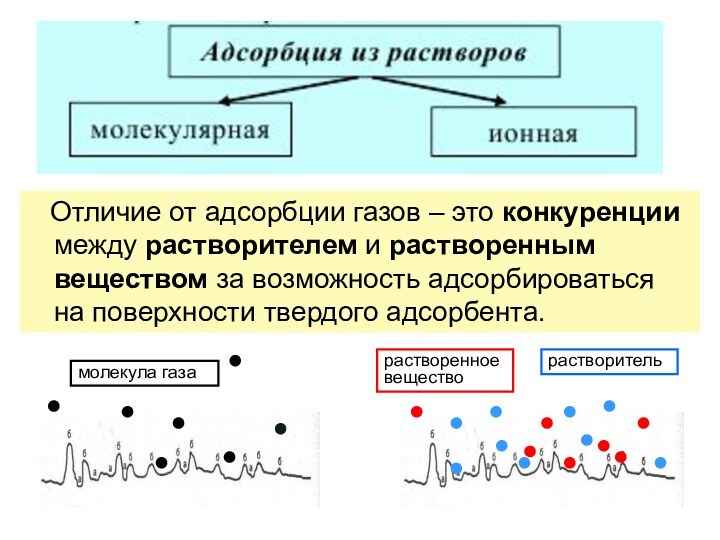
Слайд 28 Отличие от адсорбции газов – это
конкуренции между растворителем и растворенным веществом за возможность адсорбироваться
на поверхности твердого адсорбента.растворенное вещество
растворитель
молекула газа
Слайд 29
Молекулярная (неэлектролитов) адсорбция
Зависит от:
1) природы адсорбента. Полярные адсорбенты
поглощают полярные вещества.
2) природы растворителя. Чем хуже растворитель
смачивает поверхность и чем хуже растворяет вещество, тем лучше адсорбция растворенного вещества.3) температуры. При повышении t адсорбция веществ из растворов уменьшается.
Слайд 30
Адсорбция ионов из растворов
в зависимости от природы адсорбента
подразделяется на
ионную адсорбцию и
ионнообменную адсорбцию
Слайд 31
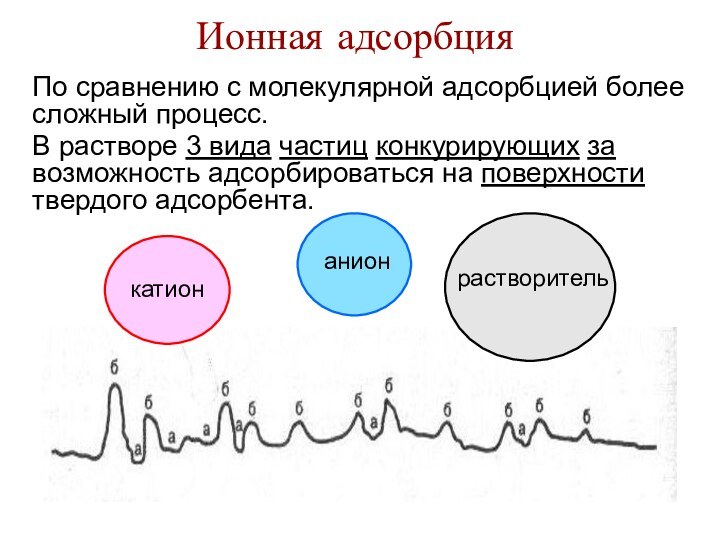
Ионная адсорбция
По сравнению с молекулярной адсорбцией более сложный
процесс.
В растворе 3 вида частиц конкурирующих за возможность адсорбироваться
на поверхности твердого адсорбента. анион
растворитель
катион
Слайд 32
Зависит от:
1) природы адсорбента. Чем более полярный адсорбент,
тем лучше адсорбция ионов.
2) природы иона:
а) чем больше
rиона, тем меньше адсорбция;Ионы одинакового заряда можно расположить в
лиотропные ряды: Li+ > Na+ > K+ > Rb+ > Cs+
Cl- > Br- > NO3- > SCN- > OH-
уменьшение гидратации, усиление адсорбционных свойств
б)чем больше zиона, тем сильнее адсорбция
Слайд 33
Избирательная адсорбция ионов
правило Панета – Фаянса
Например:
на AgI могут адсорбироваться Ag+ и I-, а также
изоморфные ионы: Cl-, Br-, CN-, CNS-. Обязательным является условие образования труднорастворимого соединения.Фридрих Адольф
Панет
1887 – 1958
на кристаллической поверхности адсорбируются те ионы, которые способны достроить кристаллическую решетку и дают труднорастворимое соединение с ионами, входящими в кристалл.
Казимир Фаянс
1887 – 1975
Слайд 34
Ионообменная адсорбция
Ионообменная адсорбция – процесс, при
котором твердый адсорбент обменивает свои ионы на ионы того
же знака из жидкого раствора.Сорбенты, способные к обмену ионов, называют ионообменниками или ионитами.
Ионообменные смолы – нерастворимые ВМС, способные набухать в водных растворах, поглощая значительное количество воды, и высвобождать ионы в процессе электролитической диссоциации.
Слайд 35
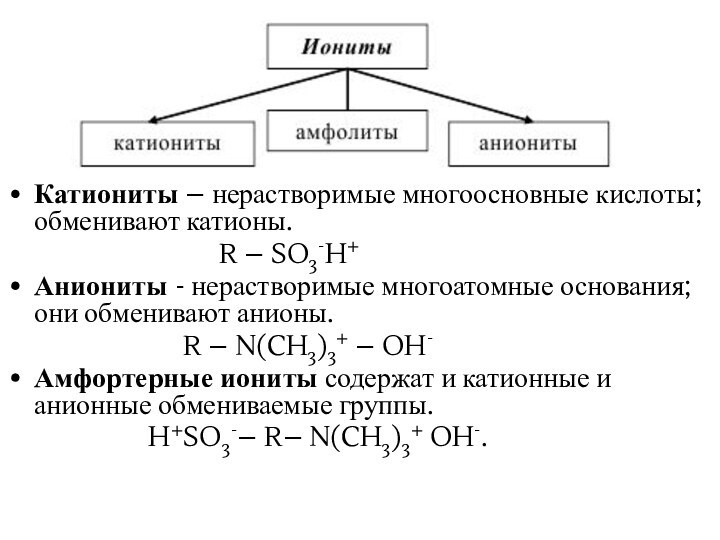
Катиониты – нерастворимые многоосновные кислоты; обменивают катионы.
R – SO3-H+
Аниониты - нерастворимые многоатомные основания; они обменивают анионы.
R – N(CH3)3+ – OH-
Амфортерные иониты содержат и катионные и анионные обмениваемые группы.
H+SO3-– R– N(CH3)3+ OH-.





























