- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Поверхностные явления. Лекция 15
Содержание
- 2. Тончайший мономолекулярный слой, расположенный на границе раздела
- 3. Поверхностное натяжение, адсорбция, адгезия и другие процессы,
- 4. Они осуществляются самопроизвольно за счет свободной поверхностной энергии.
- 5. Поверхностные явления играют важную роль вдыхании, пищеварении, экскреции.
- 6. Они протекают in vivo на развитых поверхностях
- 7. План15.1 Поверхностная энергия и поверхностное натяжение15.2 Адсорбция и ее виды15.3 Адсорбция на границе жидкость-газ
- 8. 15.1Энергетическое состояние молекул вещества в межфазном поверхностном слое и в глубине фазы различно.
- 9. Рассмотрим состояние молекул в однокомпонентной двухфазной системе: вода – водяной пар.
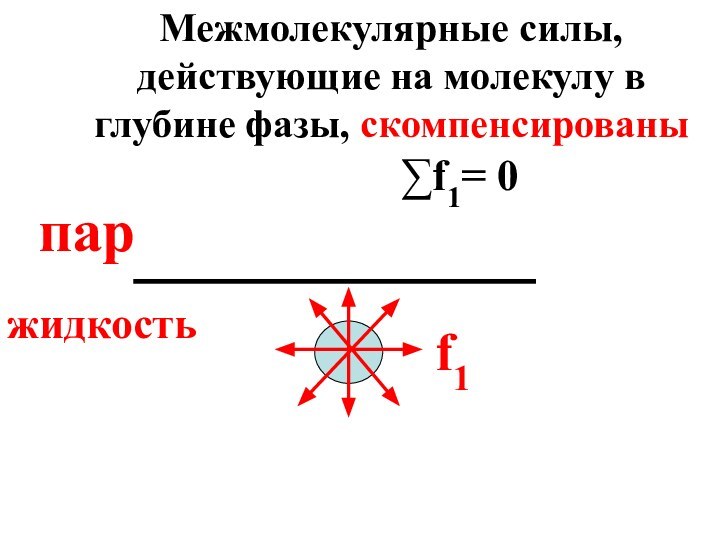
- 10. На молекулу воды, находящуюся в глубине фазы,
- 11. f1паржидкость∑f1= 0Межмолекулярные силы, действующие на молекулу в глубине фазы, скомпенсированы
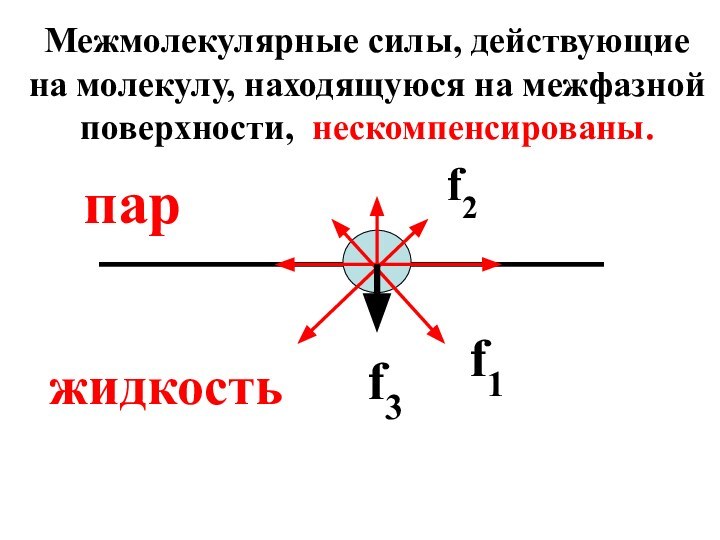
- 12. Молекула на границе раздела фаз в большей
- 13. f2f1f3паржидкостьМежмолекулярные силы, действующие на молекулу, находящуюся на межфазной поверхности, нескомпенсированы.
- 14. Сила f3 создает внутреннее (межмолекулярное) давление жидкости,
- 15. Вследствие нескомпенсированности сил межмолекулярного взаимодействия, поверхностный слой
- 16. где S – площадь поверхности раздела фаз, м2σ – коэффициент пропорциональности, называемый поверхностным натяжением.
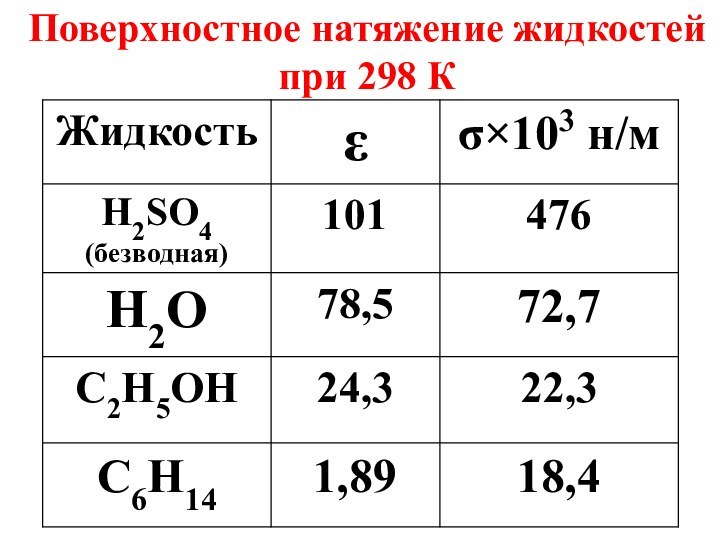
- 18. Поверхностное натяжение – важная характеристика жидкостей; оно
- 19. С увеличением температуры поверхностное натяжение жидкостей уменьшается, т.к. разрывается часть связей межмолекулярного взаимодействия.
- 20. Чем выше полярность жидкости, тем больше ее
- 21. Поверхностное натяжение жидкостей при 298 К
- 22. Поверхностное натяжение – важная характеристика биологических жидкостей. В норме σ крови равно 45,4×10-3 н/м.
- 23. Измерение поверхностного натяжения крови - важный диагностический тест.
- 24. Изменения σ сыворотки крови свидетельствует о наличии
- 25. Наиболее принятым методом определения поверхностного натяжения является сталогмометрический метод.
- 26. Согласно второму закону термодинамики Gs → min.
- 27. б) за счет адсорбции, т.к. при адсорбции уменьшается поверхностное натяжение жидкостей.
- 28. 15.2. Адсорбцией называется концентрирование какого-либо вещества в
- 29. Активирован-ный угольМолекулы газа
- 30. При адсорбции различают два понятия: Адсорбент, Адсорбат.
- 31. Адсорбент – вещество, на поверхности которого идет адсорбция. Адсорбат – вещество, которое концентрируется на поверхности адсорбента.
- 32. Адсорбция (Г) выражается в г/м2 или моль/м2
- 33. В зависимости от природы сил, действующих между адсорбентом и адсорбатом, различают физическую и химическую адсорбцию.
- 34. Физическая адсорбция обусловлена межмолекулярным взаимодействием (силы Ван-дер-Ваальса).
- 35. Для физической адсорбции характерны: обратимость: одновременно с
- 36. В соответствии с принципом Ле Шателье, протеканию
- 37. Химическая адсорбция (хемосорбция) осуществляется при взаимодействии адсорбента с адсорбатом с образованием химической (ковалентной) связи.
- 38. Энергия связи при хемосорбции составляет 40-400 кДж/моль, что делает ее практически необратимой, специфичной и локализованной.
- 39. Повышение температуры усиливает хемосорбцию,
- 40. По характеру межфазной поверхности
- 41. 15.3 При растворении в воде какого-либо вещества
- 42. Б) повышение ее поверхностного натяжения. Такие вещества
- 43. В) поверхностное натяжение жидкости не изменяется. Такие
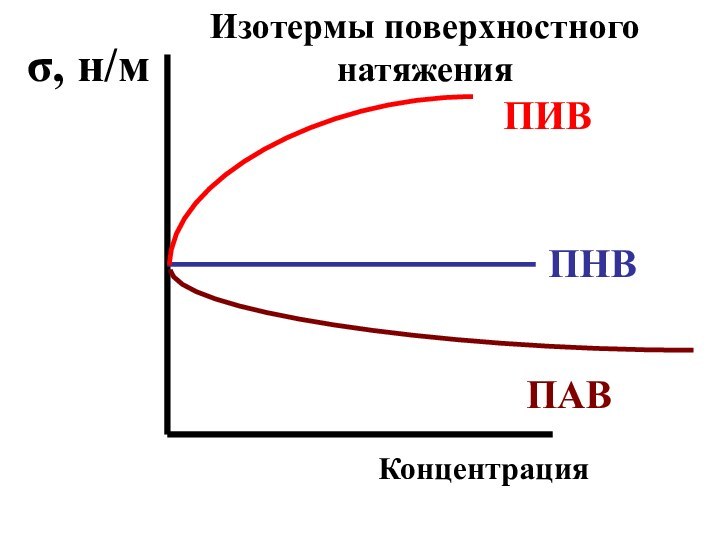
- 44. ПИВПНВПАВσ, н/мКонцентрацияИзотермы поверхностного натяжения
- 45. Поверхностно-активными (ПАВ) называются вещества, уменьшающие поверхностное натяжение жидкостей.
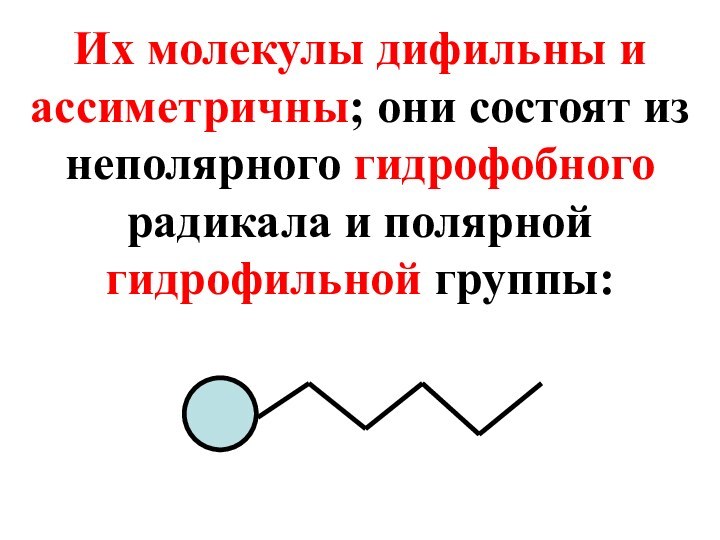
- 46. Их молекулы дифильны и ассиметричны; они состоят из неполярного гидрофобного радикала и полярной гидрофильной группы:
- 47. Классификация ПАВПАВЭлектролитыНеэлектролиты(ионогенные)(неионогенные)
- 48. Ионогенные ПАВ делятся на:Катионоактивные:Соли и гидроксиды алкиламмония
- 49. Например, цетилтриметил аммоний бромид, используемый как антисептик[CH3- (CH2)15N (CH3)3]Br
- 50. 2) Аниононоактивные:Соли карбоновых кислотR-COOMe,Соли сульфокислотR-SO3Me
- 51. К неионогенным ПАВ относятся:Карбоновые кислоты R-COOH, Сульфокислоты
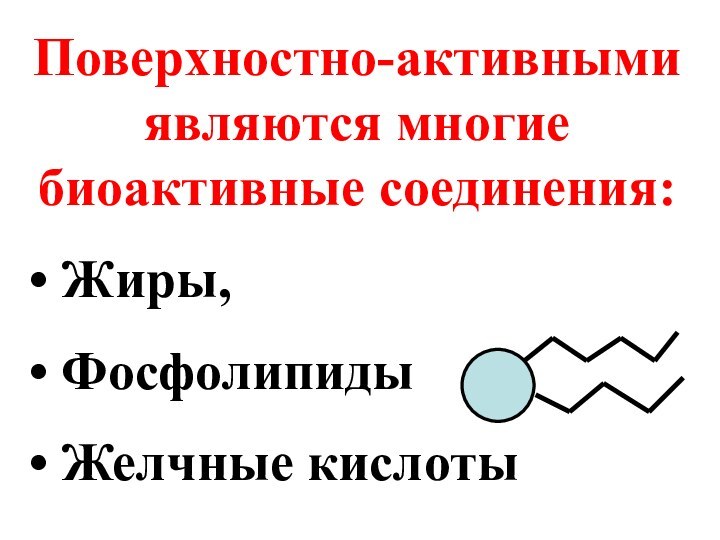
- 52. Поверхностно-активными являются многие биоактивные соединения: Жиры, Фосфолипиды Желчные кислоты
- 53. В соответствии с правилом «Подобное стремится к
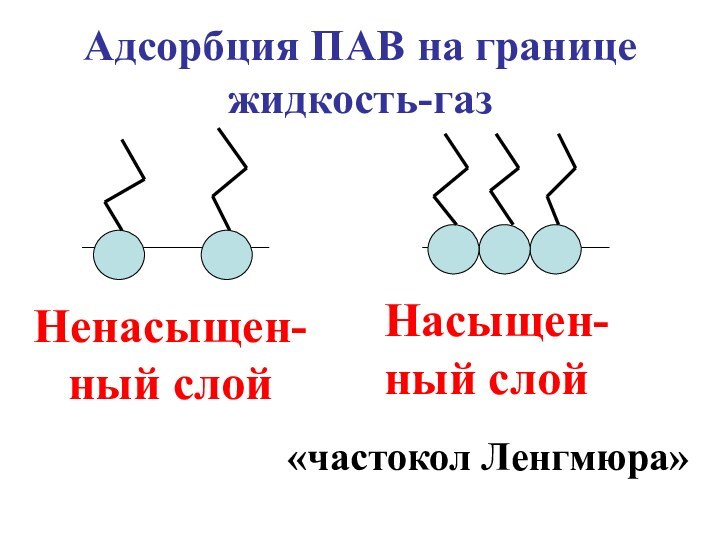
- 54. Насыщен-ный слойНенасыщен-ный слой«частокол Ленгмюра»Адсорбция ПАВ на границе жидкость-газ
- 55. Поскольку молекулы ПАВ менее полярны, чем молекулы воды, силы поверхностного натяжения в поверхностном слое уменьшаются.
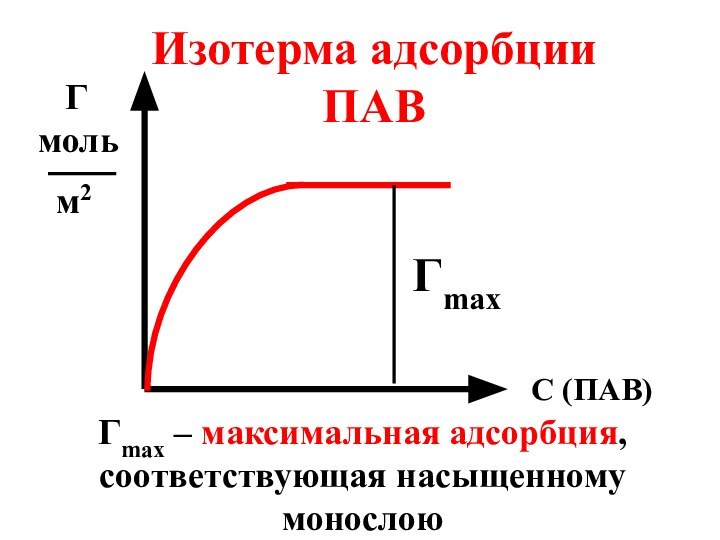
- 56. С (ПАВ) Г моль м2Изотерма адсорбции ПАВГmaxГmax – максимальная адсорбция, соответствующая насыщенному монослою
- 57. Зная Гmax можно рассчитатьа) длину молекулы ПАВ
- 58. б) площадь, занимаемую молекулой ПАВ на границе
- 59. Важнейшей характеристикой ПАВ является их поверхностная активность
- 60. Правило Дюкло-Траубе (1888): с увеличением длины гидрофобного
- 61. Правило выполняется для членов одного гомологического ряда: спиртов, аминов, карбоновых кислот и т.д.
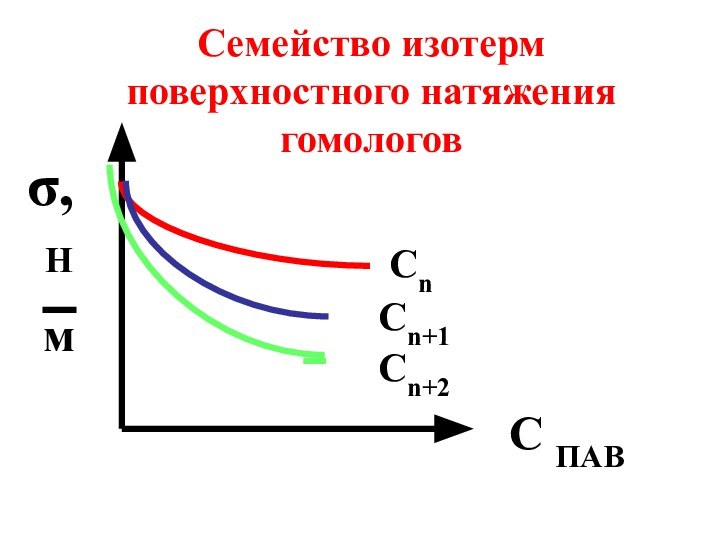
- 62. СnСn+1Сn+2C ПАВσ,НмСемейство изотерм поверхностного натяжения гомологов
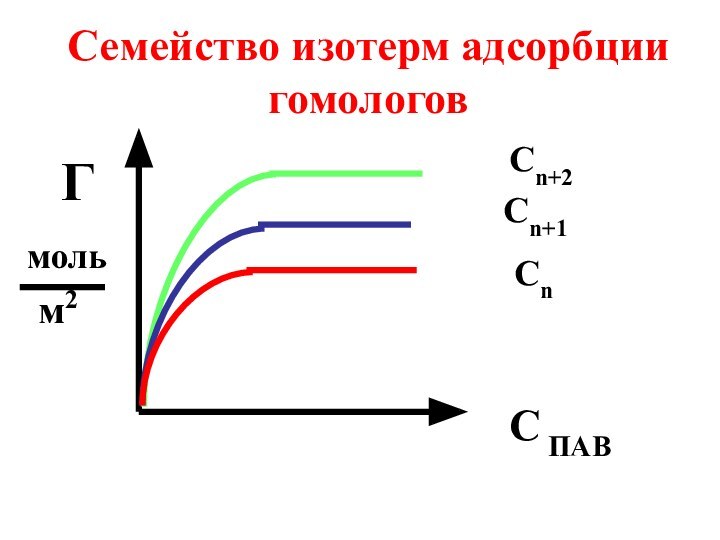
- 63. Семейство изотерм адсорбции гомологовС ПАВГмольм2Сn+2Сn+1Сn
- 64. Зависимость адсорбции ПАВ от их концентрации в растворе описывается уравнением Гиббса (1878):Г = dσdсC ПАВRT×
- 65. Влияние концентрации ПАВ на поверхностное натяжение растворов
- 66. Для расчета адсорбции ПАВ используется объединенное уравнение Гиббса-Шишковского:Г =aRTb×c1 + b×c×
- 67. Применение ПАВКак моющие средства: молекулы ПАВ
- 68. Жир
- 69. 2) Как антисептики в хирургии:антимикробная активность ионогенных
- 70. Обеззараживающее действие ПАВ объясняют их влиянием на
- 71. 3) Для производства липосомЛипосома (греч. «липос» -
- 73. Липосомы применяются для направленной доставки лекарственного препарата к пораженным органам и тканям.
- 74. Липосомы могут переносить широкий круг фармакологически активных
- 75. При этом препарат не отравляет здоровые ткани человека.
- 76. Как носители лекарств, наиболее широкое применение липосомы
- 77. Скачать презентацию
- 78. Похожие презентации
Тончайший мономолекулярный слой, расположенный на границе раздела двух фаз, накапливает огромный запас свободной поверхностной энергии (Gs).











































![Поверхностные явления. Лекция 15 Например, цетилтриметил аммоний бромид, используемый как антисептик[CH3- (CH2)15N (CH3)3]Br](/img/tmb/15/1422081/820adce41a1eb4b088f4735827aba650-720x.jpg)























Слайд 2 Тончайший мономолекулярный слой, расположенный на границе раздела двух
фаз, накапливает огромный запас свободной поверхностной энергии (Gs).
Слайд 3 Поверхностное натяжение, адсорбция, адгезия и другие процессы, протекающие
на границе раздела двух фаз, называются поверхностными явлениями.
Слайд 6
Они протекают in vivo на развитых поверхностях раздела:
поверхность кожи – 1,5 м2
эритроцитов – 3000 м2
альвеол – 1000 м2
Слайд 7
План
15.1 Поверхностная энергия и поверхностное натяжение
15.2 Адсорбция
и ее виды
15.3 Адсорбция на границе жидкость-газ
Слайд 8 15.1Энергетическое состояние молекул вещества в межфазном поверхностном слое
и в глубине фазы различно.
Слайд 10 На молекулу воды, находящуюся в глубине фазы, действуют
силы межмолекулярного взаимодействия (f1), причем их равнодействующая равна
нулю вследствие симметрии силового поля.
Слайд 11
f1
пар
жидкость
∑f1= 0
Межмолекулярные силы, действующие на молекулу в глубине
фазы, скомпенсированы
Слайд 12 Молекула на границе раздела фаз в большей степени
испытывает действие межмолекулярных сил со стороны жидкой фазы (f1),
чем со стороны газообразной (f2). Результирующий вектор силы (f3) направлен внутрь жидкости.
Слайд 13
f2
f1
f3
пар
жидкость
Межмолекулярные силы, действующие на молекулу, находящуюся на межфазной
поверхности, нескомпенсированы.
Слайд 14 Сила f3 создает внутреннее (межмолекулярное) давление жидкости, которое
для воды составляет 14 000 атм/см2.
Межмолекулярное давление-это причина
того, что жидкости практически несжимаемы.Слайд 15 Вследствие нескомпенсированности сил межмолекулярного взаимодействия, поверхностный слой имеет
избыточную свободную энергию (по сравнению с объемом жидкости):
Gs =
σ× S
Слайд 16
где S – площадь поверхности раздела фаз, м2
σ
– коэффициент пропорциональности, называемый поверхностным натяжением.
Слайд 17
Gs Дж Н
σ = , =
S м2 м
Поверхностное натяжение – это поверхностная энергия единицы площади поверхности раздела фаз.
Слайд 18 Поверхностное натяжение – важная характеристика жидкостей; оно зависит
а) от температуры,
б) от полярности среды.
Слайд 19 С увеличением температуры поверхностное натяжение жидкостей уменьшается, т.к.
разрывается часть связей межмолекулярного взаимодействия.
Слайд 20 Чем выше полярность жидкости, тем больше ее поверхностное
натяжение, т.к. с увеличением полярности возрастают силы межмолекулярного взаимодействия.
Слайд 22
Поверхностное натяжение – важная характеристика биологических жидкостей.
В
норме σ крови равно 45,4×10-3 н/м.
Слайд 24 Изменения σ сыворотки крови свидетельствует о наличии онкологических
заболеваний, анафилактическом шоке и других заболеваниях. Кроме того, поверхностное
натяжение уменьшается с возрастом.Слайд 25 Наиболее принятым методом определения поверхностного натяжения является сталогмометрический
метод.
Слайд 26 Согласно второму закону термодинамики Gs → min. Это
стремление реализуется:
а) за счет уменьшения площади поверхности (стремление жидкости
принять форму шара, слияние капель);Слайд 28 15.2. Адсорбцией называется концентрирование какого-либо вещества в поверхностном
слое в результате самопроизвольного перехода его из объема фазы.
Слайд 31 Адсорбент – вещество, на поверхности которого идет адсорбция.
Адсорбат – вещество, которое концентрируется на поверхности адсорбента.
Слайд 32 Адсорбция (Г) выражается в г/м2 или моль/м2 и
рассчитывается по формулам:
Г =
ν
S
m – масса адсорбата, г
ν – количество адсорбата, моль S – площадь поверхности адсорбента, м2Г =
m
S
Слайд 33 В зависимости от природы сил, действующих между адсорбентом
и адсорбатом, различают физическую и химическую адсорбцию.
Слайд 34 Физическая адсорбция обусловлена межмолекулярным взаимодействием (силы Ван-дер-Ваальса). Энергия
этих взаимодействий невелика и составляет ~4-40 кДж/моль.
Слайд 35
Для физической адсорбции характерны:
обратимость: одновременно с адсорбцией
протекает десорбция,
неспецифичность: она подчиняется правилу «подобное растворяется в
подобном»,экзотермичность (ΔадсН < О)
Слайд 36
В соответствии с принципом
Ле Шателье, протеканию физической
адсорбции способствует:
понижение температуры,
увеличение концентрации адсорбата,
повышение давления
в системе (при адсорбции газа или пара).Слайд 37 Химическая адсорбция (хемосорбция) осуществляется при взаимодействии адсорбента с
адсорбатом с образованием химической (ковалентной) связи.
Слайд 38 Энергия связи при хемосорбции составляет 40-400 кДж/моль, что
делает ее практически необратимой, специфичной и локализованной.
Слайд 40 По характеру межфазной поверхности
различают
адсорбцию, протекающую на границе раздела:А) жидкость/газ,
Б) жидкость/жидкость,
В) твердое тело/жидкость,
Г) твердое тело/газ
Слайд 41 15.3 При растворении в воде какого-либо вещества может
наблюдаться:
А) понижение ее поверхностного натяжения. Такие вещества называются поверхностно-активными
(ПАВ);Слайд 42 Б) повышение ее поверхностного натяжения. Такие вещества называются
поверхностно-инактивными (ПИВ); к ним относятся неорганические кислоты, основания и
соли;Слайд 43 В) поверхностное натяжение жидкости не изменяется. Такие вещества
называются поверхностно-неактивными (ПНВ). К
ним относятся глюкоза, сахароза и другие сахара.Слайд 45 Поверхностно-активными (ПАВ) называются вещества, уменьшающие поверхностное натяжение жидкостей.
Слайд 46 Их молекулы дифильны и ассиметричны; они состоят из
неполярного гидрофобного радикала и полярной гидрофильной группы:
Слайд 49
Например, цетилтриметил аммоний бромид, используемый как антисептик
[CH3- (CH2)15N
(CH3)3]Br
Слайд 51
К неионогенным ПАВ относятся:
Карбоновые кислоты R-COOH,
Сульфокислоты
R - SO3H,
Спирты
R - OH,Тиолы R - SH,
Амины R – NH2
Слайд 52
Поверхностно-активными являются многие биоактивные соединения:
Жиры,
Фосфолипиды
Желчные
кислоты
Слайд 53 В соответствии с правилом «Подобное стремится к подобному»,
гидрофобные радикалы направлены в неполярную фазу (воздух), а гидрофильные
группы – в полярную (вода). В результате ПАВы концентрируются на границе раздела двух фаз.Слайд 55 Поскольку молекулы ПАВ менее полярны, чем молекулы воды,
силы поверхностного натяжения в поверхностном слое уменьшаются.
Слайд 56
С (ПАВ)
Г моль
м2
Изотерма адсорбции ПАВ
Гmax
Гmax
– максимальная адсорбция, соответствующая насыщенному монослою
Слайд 57
Зная Гmax можно рассчитать
а) длину молекулы ПАВ (ℓ)
ℓ
=
Г max M
ρ
ρ – плотность ПАВ,
М- молярная масса
ПАВСлайд 58 б) площадь, занимаемую молекулой ПАВ на границе раздела
фаз (s):
s =
1
Г max NA
где NA – число
Авогадро
Слайд 59
Важнейшей характеристикой ПАВ является их поверхностная активность (g):
g
=
Δσ
ΔC
где Δσ – уменьшение поверхностного натяжения жидкости при
увеличении концентрации ПАВ на ΔССлайд 60 Правило Дюкло-Траубе (1888): с увеличением длины гидрофобного радикала
на группу -CH2- поверхностная активность ПАВ возрастает в 3-3,5
раза при одинаковой молярной концентрации.Слайд 61 Правило выполняется для членов одного гомологического ряда: спиртов,
аминов, карбоновых кислот и т.д.
Слайд 64 Зависимость адсорбции ПАВ от их концентрации в растворе
описывается уравнением Гиббса (1878):
Г =
dσ
dс
C ПАВ
RT
×
Слайд 65 Влияние концентрации ПАВ на поверхностное натяжение растворов описывается
уравнением Шишковского (1909):
σ = σо – а ln (1
+ b ×cПАВ)где a и b – параметры уравнения (табл.), σ – поверхностное натяжение раствора, σо -поверхностное натяжение растворителя