- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Реальные газы. Равновесие фаз
Содержание
- 2. Реальные газы –История проблемыТомас ЭндрюсВан дер Ваальс
- 3. Модель газа Ван дер ВаальсаИдеальный Газ Модель Ван дер Ваальса
- 4. Модель газа Ван дер ВаальсаИзотермы газа с учетом (пунктир) и без учета объема молекул
- 5. Модель газа Ван дер Ваальса
- 6. Модель газа Ван дер Ваальса
- 7. Модель газа Ван дер Ваальса
- 8. Модель газа Ван дер ВаальсаНа рисунке представлена
- 9. Модель газа Ван дер Ваальса
- 10. Модель газа Ван дер ВаальсаСостояния «левее» минимума
- 11. Модель газа Ван дер ВаальсаМодель Ван дер
- 12. Критические параметрыИзотерма EABD нам уже знакома, она описывает два агрегатных состояния вещества
- 13. Критические параметрыИзотерма NM соответствует высоким температурам, когда
- 14. Критические параметрыИзотерма HKF соответствует переходу от температур,
- 15. Критические параметры
- 16. Критические параметры
- 17. Критические параметры
- 18. Критические параметры
- 19. Изотермы реального газаУже в первых своих опытах
- 20. Изотермы реального газаЕсли изотермически сжимать газ, при
- 21. Изотермы реального газаЖирная кривая ALKG на рис.
- 22. Изотермы реального газаДля того чтобы найти давление,
- 23. Изотермы реального газаУчасток AB изотермы EGABCDLD в
- 24. Изотермы реального газаВ заключение этого раздела обратим
- 25. Изотермы реального газаРтуть находится в растянутом состоянии
- 26. Фазовые превращения и фазовые равновесияПри уменьшении температуры
- 27. Фазовые превращения и фазовые равновесияФазой называется физически
- 28. Фазовые превращения и фазовые равновесияПомимо этих превращений
- 29. Фазовые превращения и фазовые равновесияРассмотрим вначале вопрос
- 30. Фазовые превращения и фазовые равновесия
- 31. Фазовые превращения и фазовые равновесия
- 32. Фазовые превращения и фазовые равновесия
- 33. Фазовые превращения и фазовые равновесия
- 34. Фазовые превращения и фазовые равновесияЭто уравнение дает
- 35. Уравнение Клапейрона-Клаузиуса
- 36. Уравнение Клапейрона-Клаузиуса
- 37. Уравнение Клапейрона-Клаузиуса
- 38. Уравнение Клапейрона-Клаузиуса
- 39. Равновесие трех фазВыше мы обсудили кривую равновесия
- 40. Равновесие трех фазВсе эти кривые пересекаются, образуя
- 41. Равновесие трех фазТо, что при понижении температуры
- 42. Зависимость давления насыщенного пара от температуры
- 43. Зависимость давления насыщенного пара от температуры
- 44. Равновесие в химических реакцияхВсякая химическая реакция протекает,
- 45. Равновесие в химических реакциях
- 46. Равновесие в химических реакциях
- 47. Равновесие в химических реакциях
- 48. Равновесие в химических реакциях
- 49. Равновесие в химических реакциях
- 50. Равновесие в химических реакцияхЭти уравнения представляют собой
- 51. Скачать презентацию
- 52. Похожие презентации
Реальные газы –История проблемыТомас ЭндрюсВан дер Ваальс
















































Слайд 8
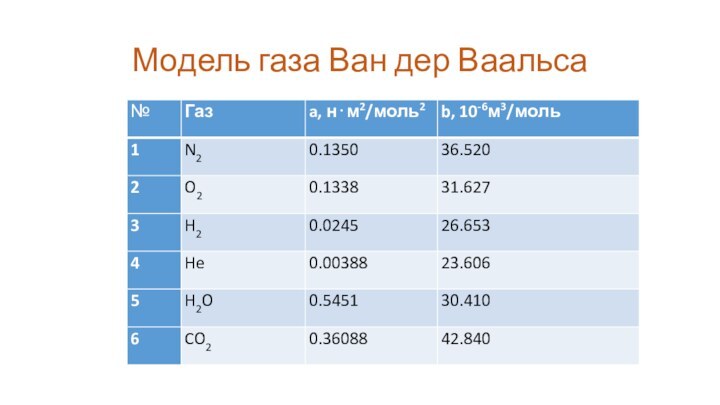
Модель газа Ван дер Ваальса
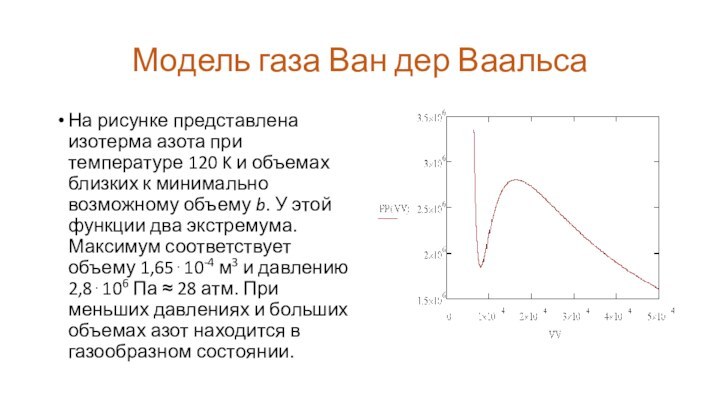
На рисунке представлена изотерма
азота при температуре 120 K и объемах близких к
минимально возможному объему b. У этой функции два экстремума. Максимум соответствует объему 1,65⋅10-4 м3 и давлению 2,8⋅106 Па ≈ 28 атм. При меньших давлениях и больших объемах азот находится в газообразном состоянии.
Слайд 10
Модель газа Ван дер Ваальса
Состояния «левее» минимума (при
объемах, меньших соответствующего минимуму объема 8,27⋅10-5 м3) соответствуют жидкому
азоту. Жидкость практически несжимаема, а потому малому изменению объема соответствует очень большое изменение давления.
Слайд 11
Модель газа Ван дер Ваальса
Модель Ван дер Ваальса
лишь качественно описывает поведение реальных газов. Процессы перехода вещества
из жидкого в газообразное состояние и обратно – испарение и конденсация – лежат за гранью ее возможностей. Тем не менее эта модель помогает пониманию этих процессов. Позже мы рассмотрим эти вопросы.
Слайд 12
Критические параметры
Изотерма EABD нам уже знакома, она описывает
два агрегатных состояния вещества
Слайд 13
Критические параметры
Изотерма NM соответствует высоким температурам, когда газ
ни при каких давлениях не превращается в жидкость. Это
означает, что пропорциональная температуре кинетическая энергия молекул становится настолько большой, что силы притяжения уже не в состоянии связать газ в жидкость.
Слайд 14
Критические параметры
Изотерма HKF соответствует переходу от температур, при
которых возможна конденсация газа в жидкость к температурам, при
которых она невозможна. Эта изотерма называется критической, а соответствующая ей температура – критической температурой. При росте температуры два экстремума изотермы сближаются и в конце концов сливаются и образуют точку перегиба K. Объем и давление, соответствующие этой точке, называются критическими объемом и давлением.
Слайд 19
Изотермы реального газа
Уже в первых своих опытах Томас
Эндрюс обнаружил, что изотермы углекислого газа имеют вид, представленный
на рисунке. В дальнейшем аналогичные результаты были получены и для других газов.
Слайд 20
Изотермы реального газа
Если изотермически сжимать газ, при температуре
ниже критической, то вначале при больших объемах давление будет
расти приблизительно в соответствии с уравнением состояния идеального газа. Начиная с некоторого объема давление при сжатии перестает расти. На изотерме этому явлению соответствует горизонтальный участок (например, GML). В это время в объеме происходит конденсация газа, Количество жидкости по мере сжатия увеличивается, а количество газа убывает. В точке L в объеме остается только жидкость, поэтому дальнейшее сжатие сопровождается резким ростом давления.
Слайд 21
Изотермы реального газа
Жирная кривая ALKG на рис. 14.4,
соединяющая концы горизонтальных участков изотерм, делит PV плоскость на
две области. Область между кривой ALKG и изобарой P = 0 соответствует двухфазным состояниям вещества. Это означает, что каждая точка этой области изображает такое состояние вещества, в котором оно не является физически однородным, а состоит из жидкости и ее насыщенного (находящегося в равновесии с жидкостью) пара. Область над кривой ALKG, напротив, соответствует однофазным состояниям. Каждая точка этой области изображает состояния физически однородного вещества.
Слайд 22
Изотермы реального газа
Для того чтобы найти давление, при
котором происходит конденсация газа при конкретном изотермическом процессе, обратим
внимание на заштрихованные площади выше и ниже изобары LCG. Их площади должны быть равны, и это определяет искомое давление. Это правило равенства площадей называют правилом Максвелла.
Слайд 23
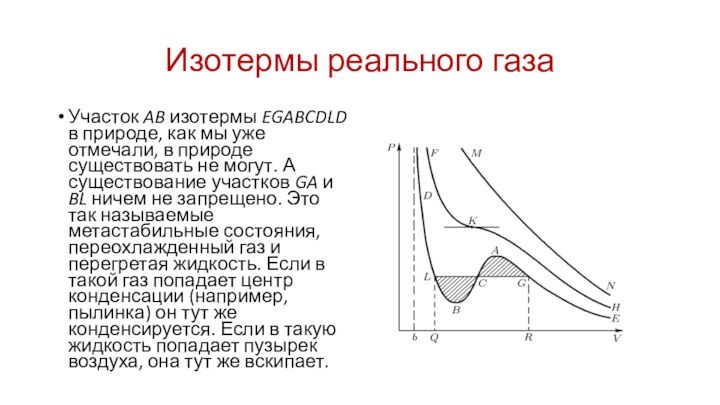
Изотермы реального газа
Участок AB изотермы EGABCDLD в природе,
как мы уже отмечали, в природе существовать не могут.
А существование участков GA и BL ничем не запрещено. Это так называемые метастабильные состояния, переохлажденный газ и перегретая жидкость. Если в такой газ попадает центр конденсации (например, пылинка) он тут же конденсируется. Если в такую жидкость попадает пузырек воздуха, она тут же вскипает.
Слайд 24
Изотермы реального газа
В заключение этого раздела обратим внимание
на еще одно любопытное явление.
На рисунке изображена изотерма азота
при температуре 100 K. На ней виден участок, где давление отрицательно. Это – метастабильное состояние жидкости, и это – растянутая жидкость.
Слайд 25
Изотермы реального газа
Ртуть находится в растянутом состоянии в
медицинском термометре (после прекращения контакта с телом), а также
в максимальном термометре, когда температура начинает понижаться после максимума. Именно поэтому медицинские и максимальные термометры приходится встряхивать перед повторным измерением. В растянутом состоянии может находиться и вода, однако это возможно только в том случае, если она тщательно очищена и дегазирована. В опытах с такой водой были получены кратковременные напряжения растяжения 23-28 МПа. Однако технически чистые жидкости, содержащие взвешенные твёрдые частицы и мельчайшие пузырьки газа, не выдерживают даже незначительных напряжений растяжения.
Слайд 26
Фазовые превращения и фазовые равновесия
При уменьшении температуры и
увеличении давления вещества испытывают скачкообразные изменения агрегатного состояния, переходя
из газообразного состояния в жидкое, а затем из жидкого в твердое. При изменении параметров в противоположном направлении происходит обратный переход: из твердого состояния в жидкое и газообразное. С этими переходами связано поглощение или выделение определенного количества теплоты – скрытой теплоты перехода. Изменение агрегатного состояния вещества – пример фазовых переходов.
Слайд 27
Фазовые превращения и фазовые равновесия
Фазой называется физически однородная
часть системы, отличающаяся своими физическими свойствами от других ее
частей и отделяющаяся от них четко выраженной границей. Переход из одной фазы в другую называется фазовым превращением, или фазовым переходом. Фаза и агрегатное состояние вещества – разные понятия. Различают твердое, жидкое, газообразное и плазменное агрегатные состояния. Фаз же может быть много: возможны различные кристаллические модификации одного вещества. Твердый углерод может существовать в виде графита и алмаза. Обе эти фазы отличаются друг от друга кристаллической структурой. При сильном ударном сжатии из графита получают алмазы. В приведенном примере скачком изменяется молярный объем и поглощается или выделяется теплота. Это фазовые переходы первого рода.
Слайд 28
Фазовые превращения и фазовые равновесия
Помимо этих превращений в
природе встречаются переходы, не связанные с поглощением или выделением
теплоты и резким изменением объема. Они проявляются в скачкообразном изменении теплоемкостей и других термодинамических коэффициентов. К этим переходам относится изменение симметрии кристаллической решетки, происходящее без изменения плотности и при отсутствии теплоты перехода. В качестве примера можно указать на фазовый переход в твердом сплаве CuZn. Этот сплав имеет кубическую форму решетки с центрированными гранями. При высокой температуре распределение атомов Cu и Zn в решетке хаотическое. Если медленно охлаждать сплав, то при некоторой температуре это хаотическое распределение атомов внезапно перестраивается: атомы Cu оказываются преимущественно в центрах граней, а атомы Zn – в вершинах куба. Резкий переход кристалла из неупорядоченного в частично упорядоченное состояние сопровождается изменением симметрии кристалла. Но с этой перестройкой не связано ни сколько-нибудь заметное изменение плотности сплава, ни сколько-нибудь заметное изменение плотности сплава, не происходит тепловыделение. Это фазовые переходы второго рода
Слайд 29
Фазовые превращения и фазовые равновесия
Рассмотрим вначале вопрос о
фазовых превращениях химически однородных веществ. Условие равновесия фаз можно
получить из теорем термодинамики. При равновесии системы температуры и давления всех ее фаз одинаковы. Если их поддерживать постоянными, то термодинамический потенциал Гиббса (далее для краткости – термодинамический потенциал) может только убывать. При равновесии он принимает минимальное значение. Этим положением мы и воспользуемся для вывода условия равновесия фаз.
Слайд 34
Фазовые превращения и фазовые равновесия
Это уравнение дает зависимость
давление насыщенного пара от температуры. Кривая DK называется кривой
равновесия жидкости и пара или кривой испарения.Точки слева от кривой испарения (большие давления, низкие температуры) представляют жидкую фазу вещества. Точки правее (высокие температуры) – соответствуют газу. Кривая DK заканчивается в точке K, в которой температура и давления равны критическим значениям. При более высокой температуре пар ни при каких давлениях не превращается в жидкость
Слайд 39
Равновесие трех фаз
Выше мы обсудили кривую равновесия пара
и жидкости. Такие же кривые равновесия существует между состояниями
в виде жидкости и твёрдого тела, твердого тела и газа. Их совокупность называют диаграммами состояния. На рисунке приведены кривые равновесия – диаграммы состояния - жидкость-пар, жидкость-твёрдое тело, твердое тело-газ.
Слайд 40
Равновесие трех фаз
Все эти кривые пересекаются, образуя так
называемую тройную точку. Только в ней при определённом давлении
и температуре могут сосуществовать в равновесии все три агрегатные состояния вещества. Для воды температура тройной точки лежит на 0,008 0С выше температуры плавления льда при атмосферном давлении. Давление насыщенного пара в тройной точке воды составляет 4,58 мм.рт.ст.
Слайд 41
Равновесие трех фаз
То, что при понижении температуры при
постоянном давлении, скажем атмосферном, газообразное состояние переходит в жидкое,
затем в твёрдое (прямая АВ), нам известно из повседневного опыта. Так, например, пары воды сначала конденсируются в воду, а затем замерзают, превращаясь в лед. Но если мы будем понижать температуру находясь ниже тройной точки – прямая СD, то пар превратится в лёд, минуя жидкую фазу. При движении в обратном направлении DC лед испарится, не превращаясь в жидкость. Существует возможность превратить лёд в жидкость при температурах ниже 0 0С, например, двигаясь по изотерме FE, находящейся левее тройной точки.
Слайд 44
Равновесие в химических реакциях
Всякая химическая реакция протекает, вообще
говоря, как в прямом, так и в обратном направлениях.
До наступления равновесия реакция в прямом направлении преобладает над обратной. При равновесии обе противоположные реакции идут с одинаковыми скоростями, так что масса вещества каждого сорта с течением времени не изменяется.Найдем условие химического равновесия.





























