Слайд 2
Производство контактной серной кислоты
Этот процесс был запатентован в
1831 г. англичанином Филипсом (Philips).
Смесь SO2 и воздуха
направляли на поверхность катализатора с последующей абсорбцией в 98,5-99 % серной кислоте.
Патент Филипса не находил промышленного применения почти 40 лет, так как не было достаточных знаний о газовых каталитических реакциях и не было особой потребности в концентрированной кислоте.
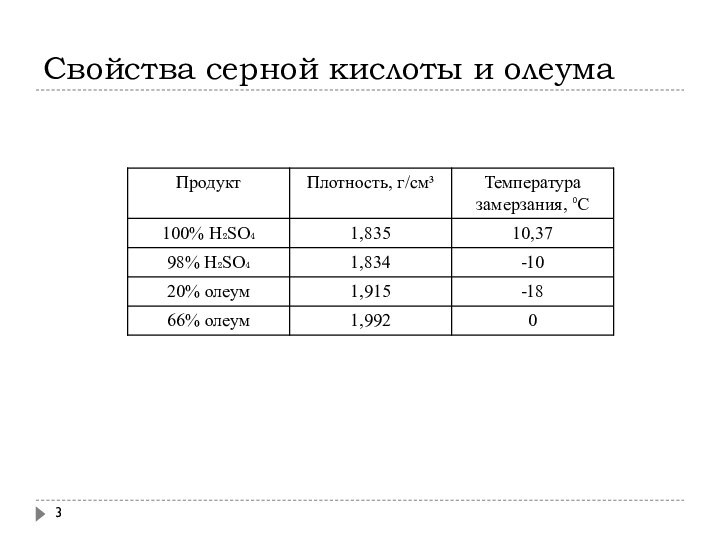
В настоящее время производят концентрированную Н2SO4, а также олеум (раствор SO3 в Н2SO4) с концентрациями, учитывающими условия складирования и транспорта, т.е. с минимальной температурой замерзания
Слайд 3
Свойства серной кислоты и олеума
Слайд 4
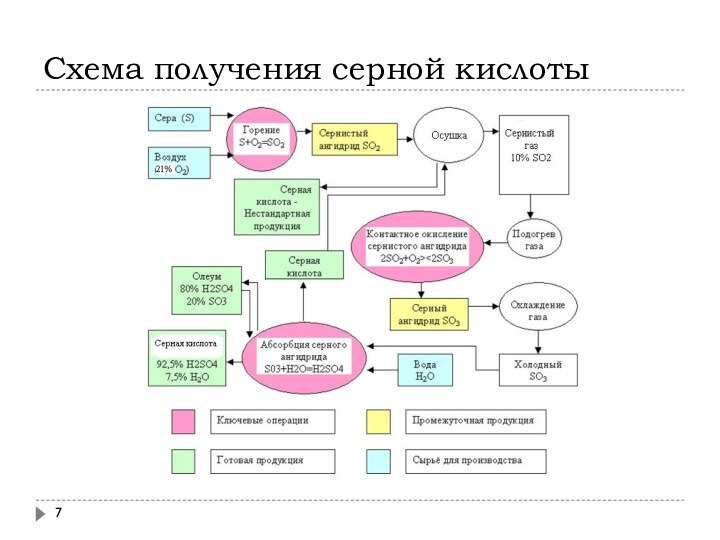
Основные стадии производства
Получение диоксида серы
а) Сжигание серы:
S (ж)
+ O2 (г) → SO2 (г); ΔH = -298,3
кДж
б) Обжиг колчедана
4FeS₂(т) + 11O₂(г) → 8SO₂(г)+ 2Fe₂O₃ (т);
Окисление SO2 в SO3:
SO2 + O2 ↔ SO3; ΔH = -98,3 кДж
Абсорбция SO3 серной кислотой:
SO3 (г)+ H2O (ж) ↔ Н2SO4 (ж); ΔH = -130,4 кДж
Слайд 5
Основная реакция - каталитическое окисление SO2 в SO3
- обратимая.
Степень конверсии SO2 в SO3 уменьшается с
повышением температуры, при более низких температурах (≤ 400ºС, когда можно достичь ≈ 100 %-ного равновесия) скорость реакции слишком мала.
В настоящее время процесс проводят в 4-5 слойных каталитических колоннах – каталитических аппаратах.
В качестве катализатора до 30-ых годов 20-го века использовали оксиды железа и Pt.
В настоящее время применяют ванадиевый катализатор - 7 % V2O5 на поверхности алюмосиликата.
Контактные яды – соединения мышьяка
Слайд 6
SO3 абсорбируется наилучшим образом не водой, а 98,3
%-ной серной кислотой.
Такой раствор имеет минимальное парциальное давление
как SO3, так и Н2О над раствором.
Процесс проводится в двух последовательных колоннах, первую как правило орошают олеумом (18,5-20 % SO3), вторую 98,3 %-ной Н2SO4.
Слайд 7
Схема получения серной кислоты
Слайд 8
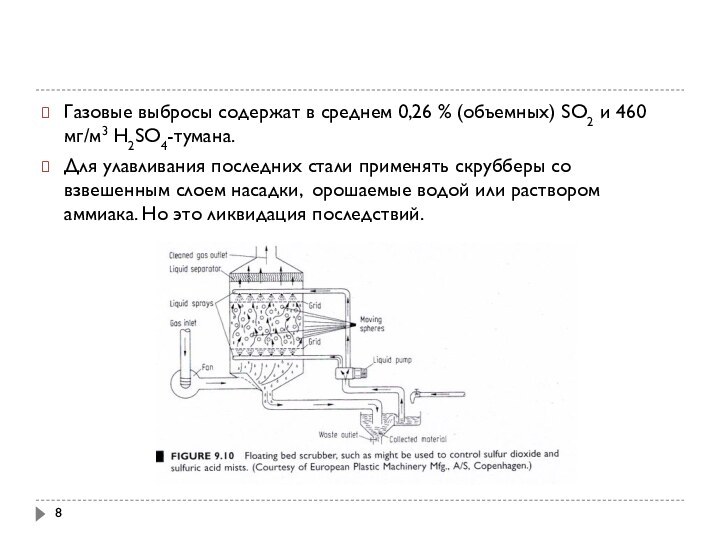
Газовые выбросы содержат в среднем 0,26 % (объемных)
SO2 и 460 мг/м3 Н2SO4-тумана.
Для улавливания последних стали
применять скрубберы со взвешенным слоем насадки, орошаемые водой или раствором аммиака. Но это ликвидация последствий.
Слайд 9
Получение серной кислоты с промежуточной абсорбцией
С точки зрения
принципа малоотходной технологии наибольший интерес представляет схема с промежуточной
абсорбцией. В этом случае газ после прохождения через 3-ий слой катализатора в контактной колонне выводят и направляют в колонну абсорбции с 98%-ной Н2SO4, а потом направляют обратно в контактную колонну перед 4-ым слоем катализатора.
Цель – выделить возможно большее количество SO3 до последней ступени катализатора, достигая тем самым сильный сдвиг направо равновесия реакции окисления SO2 в SO3. Степень конверсии оксида серы достигает в этом случае до 99,8-99,95 %.
Слайд 10
Схема получения серной кислоты
с промежуточной абсорбцией
Слайд 12
Азотная промышленность
Производство аммиака
Производство азотной кислоты
Исторически известны три метода
связывания азота и приведения его в форму, усвояемую растениями:
Электродуговой метод (60000 кВт·ч/т)
N2 + O2 → 2NO; 3000-4000ºС; ΔH = 179,2 кДж
Цианамидный метод (12000 кВт·ч/т)
CaC2 + N2 → CaCN2 + C; 1000ºС; ΔH = -284,9 кДж
Синтез аммиака (4000 кВт·ч/т )
N2 + 3H2 ↔ 2NH3; 400-600ºС; ΔH = -55,7 кДж
Слайд 13
Пристли (Priestly) и Кавендиш (Cavendish) в Англии пропускали
искры тока через воздух и получили нитраты, растворяя оксиды
азота в щелочном растворе.
Первый завод с применением электрической дуги ввели в строй в Ниагаре (США) в 1901 г.
В 1905 г. запустили промышленный процесс в Норвегии:
N₂ → NO → NO2 → Ca(NO3)
Цианамидный процесс в промышленном масштабе внедрили в 1905 г. в Италии.
Слайд 14
Немецкие химики Фриц Габер и Вальтер Нернст (Haber
& Nernst) работали над теоретическими основами синтеза аммиака NH3
10 лет и были в 1918 г. награждены Нобелевской премией по химии «за синтез аммиака из составляющих его элементов».
Карл Бош (K. Bosch ) – создатель промышленного способа синтеза аммиака
Первый завод синтеза аммиака (20-25 т NH3 в сутки, 200-225 атм) запустили в 1913 г. в Германии.
F. Haber
K. Bosch
Слайд 15
Синтез аммиака
Для синтеза NH3 надо иметь смесь N2
и H2 со стехиометрическим соотношением 1N2 : 3H2.
Водород
можно получить 4-мя способами:
Конверсией метана (СН4)
Конверсией СО, полученной при газификации твердого топлива (водяной газ)
Из коксового газа (~ 59 % Н2)
Электролизом воды
Источником азота является воздух
Слайд 16
Получение водорода
Конверсия метана
I ступень
СН4 + H2O ↔ CO
+ 3 H2; ΔH = 206 кДж
II ступень
СН4
+ 0,5 O2 ↔ CO + 2H2; ΔH = - 35 кДж
Конверсия СО
CO + H2O ↔ CO2 + H2; ΔH = - 41 кДж
Суммируя процесс конверсии метана с водяным паром:
СН4 + H2O ↔ CO2 + 3 H2; ΔH = 165 кДж
Условия конверсии метана: 800-1000ºС в присутствии Ni-Al2O3 катализатора при давлении 30 атм. Остаточное содержание метана в газе 0,5%
Условия конверсии СО: в присутствии Zn-Cr-Cu катализатора, температура 200-400ºС, давление 30 атм. Остаточное содержание СО в газе 0,2-0,4 %.
Слайд 17
Синтез аммиака
N2 + 3 H2 ↔ 2NH3 (г);
ΔH = -55,6 кДж
Выход NH3 увеличивается значительно при повышенных
давлениях.
Катализатором является металлическое дисперсное железо.
В качестве промоторов (веществ, увеличивающих активность катализатора) добавляют оксиды Al, Zr, Si.
Слайд 18
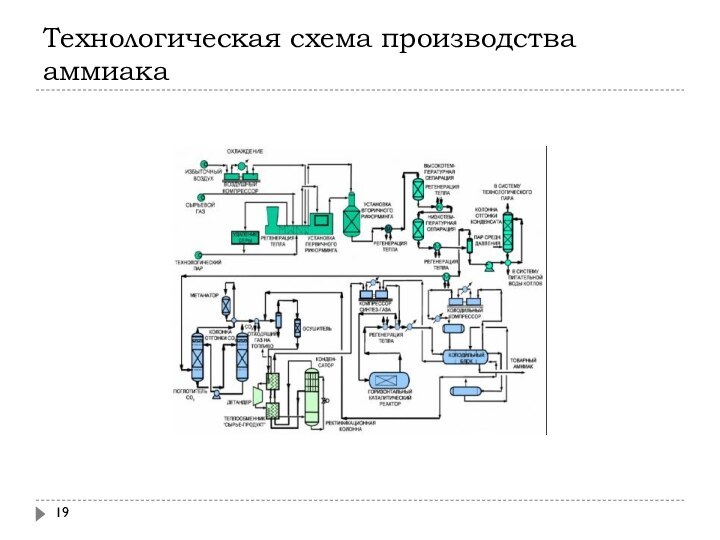
Технологические схемы разделяют на:
низкого давления (100-200 атм)
среднего давления
(200-350 атм)
высокого давления (500-1000 атм)
Наиболее распространены схемы среднего давления
Принципиальное
различие схем состоит в сепарации (выделении) аммиака.
При низком и среднем давлении нужно 2-ступенчатое охлаждение (холодной водой и жидким аммиаком).
При высоком давлении достаточно водяного охлаждения.
Слайд 19
Технологическая схема производства аммиака
Слайд 20
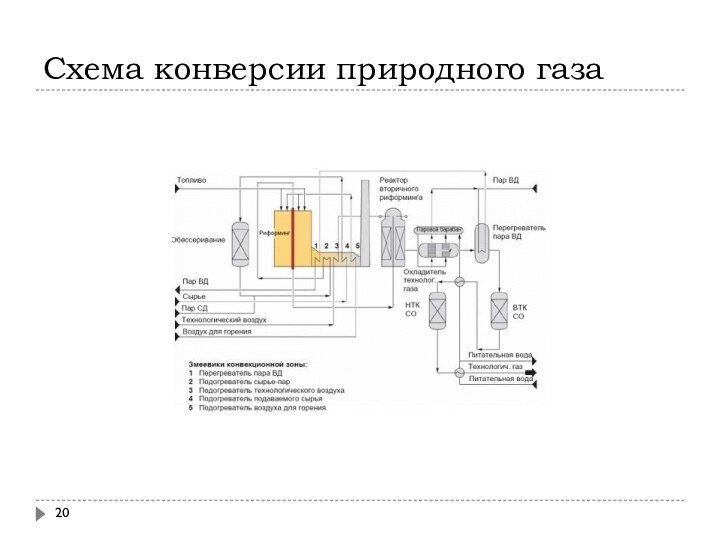
Схема конверсии природного газа
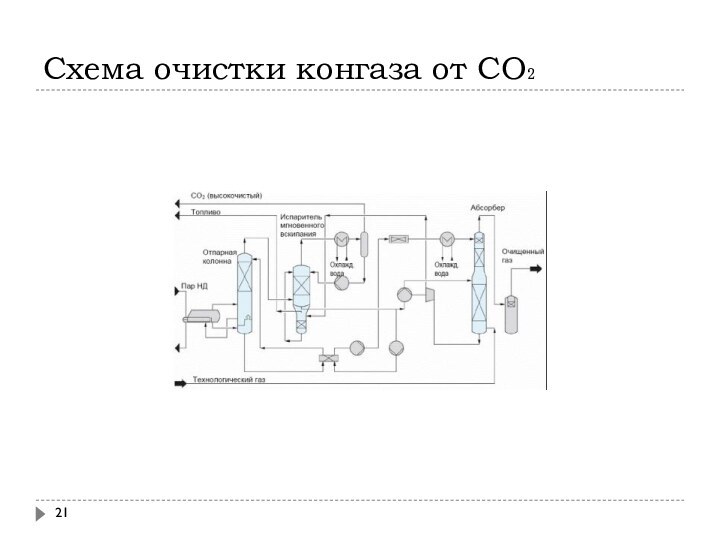
Слайд 22
Схема синтеза аммиака (рецикл)
Степень превращения АВС в аммиак
невысокая (16-30 %). Непрореагировавшие N2 и H2 рециркулируют.
Периодически
проводится продувка системы для удаления инертных примесей (CH₄; Ar).
Слайд 23
Колонна синтеза аммиака
(аппарат высокого давления)
Так как реакция
синтеза NH3 сильно экзотермична, то в реакторе организуют теплообмен
между поступающим и прореагировавшим газом. Реактор толстостенный (до 190 мм), из специальной нержавеющей стали. Н = 20 м; D = 2,8 м.
Слайд 24
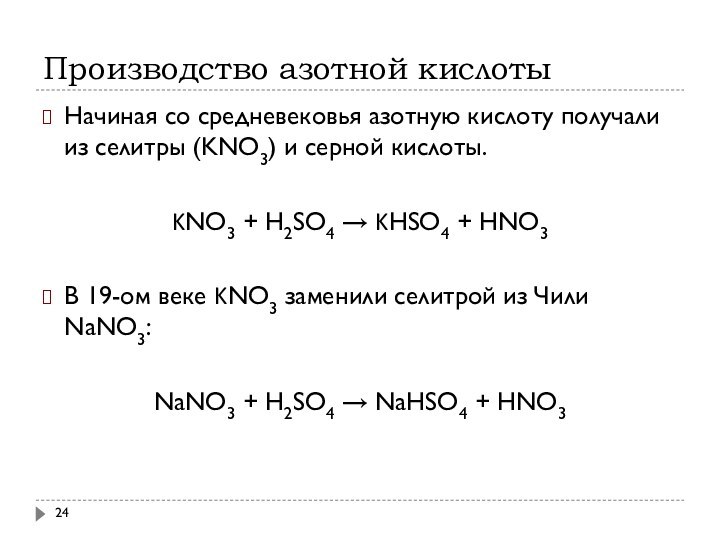
Производство азотной кислоты
Начиная со средневековья азотную кислоту получали
из селитры (KNO3) и серной кислоты.
KNO3 + H2SO4
→ KHSO4 + HNO3
В 19-ом веке KNO3 заменили селитрой из Чили NaNO3:
NaNO3 + H2SO4 → NaHSO4 + HNO3
Слайд 25
Основные стадии производства HNO₃
I стадия – окисление аммиака
4
NH3 + 5O2 → 2NO + 6H2O (Pt/Rh, 900ºС);
ΔHo298 = -907 кДж/моль
II стадия – окисление NO
2NO + O2 → 2NO2; ΔHo298 = -113 кДж/моль
IIIстадия – абсорбция NO2
2NO2 + H2O→ 2HNO3 + NO; ΔHo298 = -138 кДж/моль
Суммарная реакция:
NH3 + O2 →2HNO3 + H2O; ΔHo298 = -330 кДж/моль
Все реакции необратимы. Концентрация полученной кислоты зависит от применяемого давления и от противодавления NO над раствором кислоты.
Слайд 26
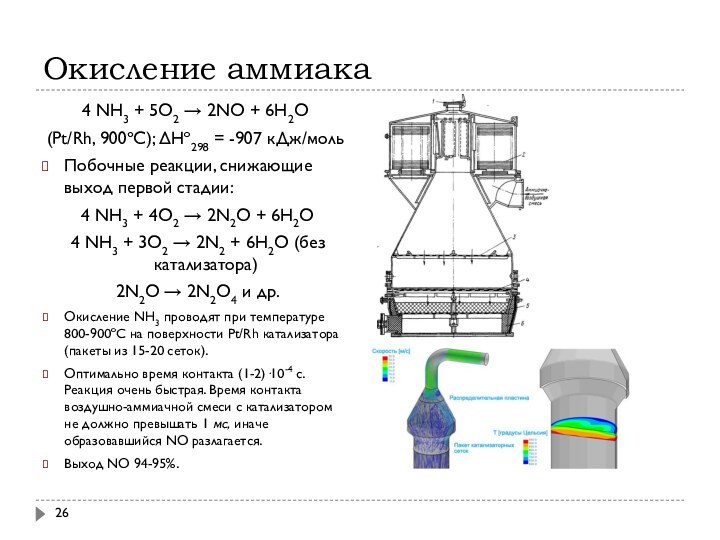
Окисление аммиака
4 NH3 + 5O2 → 2NO +
6H2O
(Pt/Rh, 900ºС); ΔHo298 = -907 кДж/моль
Побочные реакции, снижающие
выход первой стадии:
4 NH3 + 4O2 → 2N2O + 6H2O
4 NH3 + 3O2 → 2N2 + 6H2O (без катализатора)
2N2O → 2N2O4 и др.
Окисление NH3 проводят при температуре 800-900ºС на поверхности Pt/Rh катализатора (пакеты из 15-20 сеток).
Оптимально время контакта (1-2)·10-4 с. Реакция очень быстрая. Время контакта воздушно-аммиачной смеси с катализатором не должно превышать 1 мс, иначе образовавшийся NO разлагается.
Выход NO 94-95%.
Слайд 27
Окисление NO до NO2
Самая медленная и аномальная по
отношению к температуре: повышение температуры снижает скорость! Причина в
том, что реакция проходит в две ступени:
2NO ↔ (NO)2 ΔH<0
(NO)2 + O2 ↔ 2NO₂ (самая медленная стадия)
Повышение температуры снижает по первой реакции выход димера (NO)2 и тем самым скорость второй, самой медленной стадии.
Слайд 28
Абсорбция NO2
2NO2 + H2O→ 2HNO3 + NO; ΔHo298
= -138 кДж/моль
Процесс осуществляют в насадочных или тарельчатых колоннах
со значительными межтарелочными объемами.
Слайд 29
Технологические схемы
Технологические схемы производства разбавленной азотной кислоты разделяют
на:
схемы под атмосферным давлением. Для абсорбции нитрозных газов используют
3-4 насадочные башни и получают 47-50 % НNO3.
схемы повышенного давления (10-12 атм). В качестве абсорбера используется одна тарельчатая колонна из нержавеющий стали; получают 52-65 % НNO3.
комбинированные схемы (окисление NH3 приосходит под атмосферным давлением для сохранения катализатора, абсорбция NOх под давлением (~ 10 атм); получают 60-62 % НNO3.
Слайд 30
Получение концентрированной HNO3
Дистилляцией разбавленной азотной кислоты может быть
получена азотная кислота азеотропного состава (69,2% HNO3).
Более концентрированную кислоту
(до 100% ) получают перегонкой растворов азотной кислоты с концентрированной H2SO4 или прямым синтезом - взаимодействием N2O4 с водой (или разбавленной азотной кислотой) и кислородом:
2N2O4 + 2H2O + O2 → 4HNO3
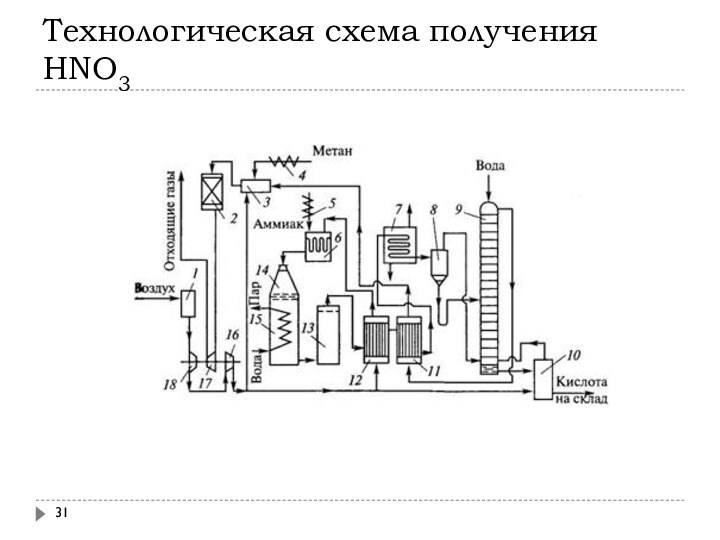
Слайд 31
Технологическая схема получения HNO3