- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Состав ядра атома
Содержание
- 2. План урока:Вопросы для повторения.Изучение нового материала.Задачи и вопросы для закрепления пройденного материала.
- 3. Вопросы для повторенияЧто такое радиоактивность?Из чего состоит
- 4. План изучения нового материалаПротон и нейтрон. История
- 5. Открытие протона В 1913 г. Э.
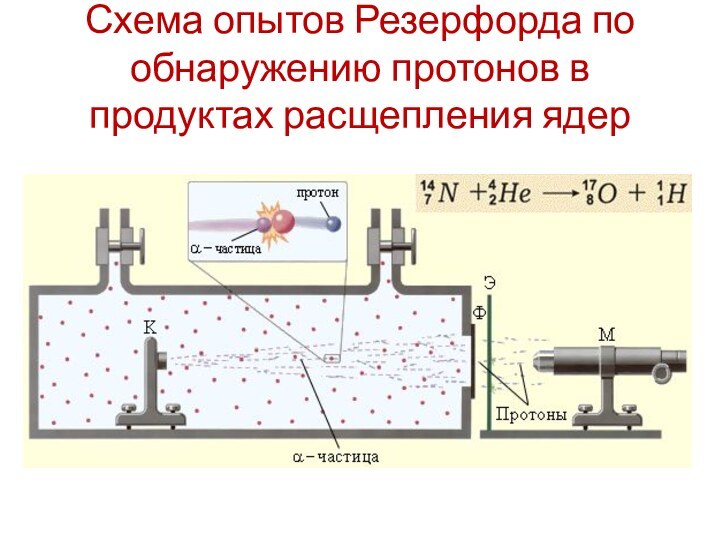
- 6. Схема опытов Резерфорда по обнаружению протонов в продуктах расщепления ядер
- 7. Открытие нейтрона. Английский ученый Дж.
- 8. Протонно–нейтронная модель ядраДмитрий Дмитриевич Иваненко (1904-1994)Вернер КарлГейзенберг(1901-1976)Советский
- 9. Протонно-нейтронная модель ядраСогласно этой модели: - ядра
- 10. Ядро атома химического элементаX – символ химического элемента.
- 11. А – массовое число, которое показывает
- 12. Z – зарядовое число, которое показывает: -
- 13. Размеры атомных ядерТак как для ядер существенны
- 14. Плотность ядерного вещества постоянна и одинакова для всех ядер
- 15. Энергия связи нуклонов в ядреЭнергия связи атомных
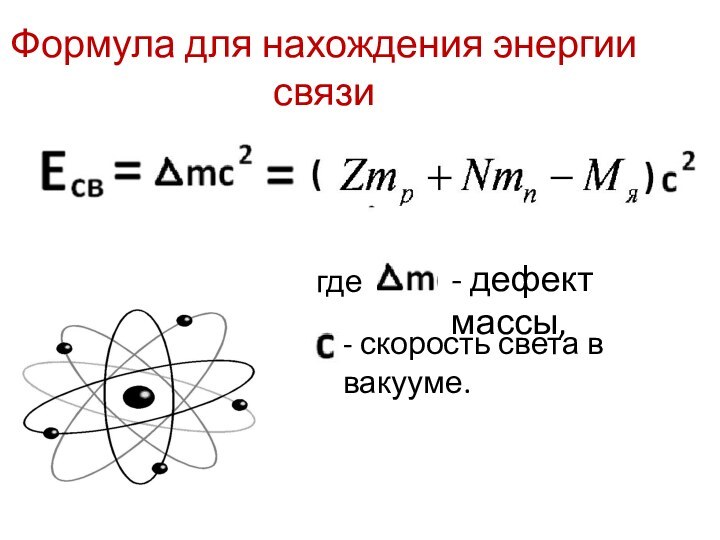
- 16. Дефект массыМасса покоя ядра Мя всегда меньше суммымасс покоя слагающих его протонов инейтронов:Дефект массы:
- 17. Формула для нахождения энергии связигде - дефект массы,- скорость света в вакууме.
- 18. Удельная энергия связи - это энергия связи,
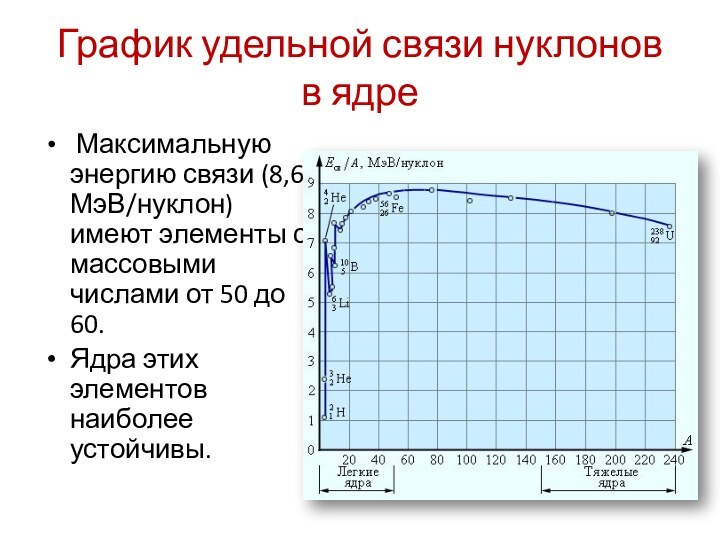
- 19. График удельной связи нуклонов в ядре Максимальную
- 20. Ядерные силыСилы, которые скрепляют отдельные протоны и
- 21. Свойства ядерных сил- малый радиус действия ядерных
- 22. Вопросы для закрепления материала:Из каких частиц состоит
- 23. Ядро атома любого элемента состоит из протонов и нейтронов.
- 26. Скачать презентацию
- 27. Похожие презентации
План урока:Вопросы для повторения.Изучение нового материала.Задачи и вопросы для закрепления пройденного материала.




















Слайд 2
План урока:
Вопросы для повторения.
Изучение нового материала.
Задачи и вопросы
для закрепления пройденного материала.
Слайд 3
Вопросы для повторения
Что такое радиоактивность?
Из чего состоит атом?
Дайте
определение понятия «относительная атомная масса».
Дайте определение изотопа.
Приведите известные вам
примеры изотопов.
Слайд 4
План изучения нового материала
Протон и нейтрон. История их
открытия.
Протонно-нейтронная модель ядра.
Состав и размер ядра.
Энергия связи нуклонов в
ядре.Удельная энергия связи.
Ядерные силы и их свойства.
Слайд 5
Открытие протона
В 1913 г. Э. Резерфорд
выдвинул гипотезу, что одной из частиц , входящих в
ядро атома любого химического элемента должно быть ядро атома водорода, т.к. было известно, что массы атомов химических элементов превышают массу атома водорода в целое число раз.Э. Резерфорд
Слайд 7
Открытие нейтрона.
Английский ученый Дж. Чедвик
выдвинул гипотезу о существовании нейтральных частиц, близких по размерам
и массе к протонам.Эти частицы он назвал нейтронами.
При прохождении через вещество нейтроны не теряют энергию на ионизацию атомов вещества, поэтому имеют огромную проникающую способность.
Дж. Чедвик
Слайд 8
Протонно–нейтронная модель ядра
Дмитрий Дмитриевич Иваненко
(1904-1994)
Вернер Карл
Гейзенберг
(1901-1976)
Советский физик
Д. Д. Иваненко
и В.Гейзенберг предложили протонно-нейтронную модель ядра:
ядра состоят из элементарных частиц двух сортов: протонов и нейтронов.
Слайд 9
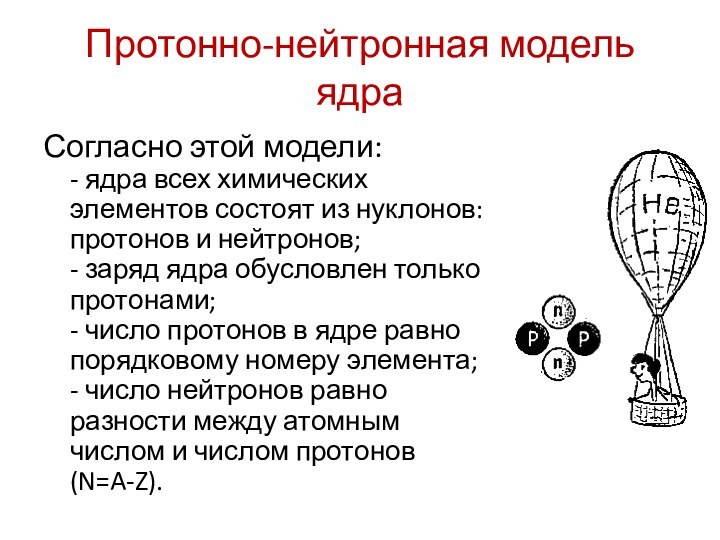
Протонно-нейтронная модель ядра
Согласно этой модели:
- ядра всех химических
элементов состоят из нуклонов: протонов и нейтронов; - заряд ядра
обусловлен только протонами; - число протонов в ядре равно порядковому номеру элемента; - число нейтронов равно разности между атомным числом и числом протонов (N=A-Z).
Слайд 11
А – массовое число, которое показывает :
- массу
ядра в целых атомных единицах массы (а.е.м.) (1а.е.м. =
1/12 массы атома углерода);- число нуклонов в ядре;
A = N + Z
где N – число нейтронов в ядре атома.
Слайд 12
Z – зарядовое число, которое показывает:
- заряд ядра
в элементарных электрических зарядах (э.э.з.) ( 1э.э.з. = заряду электрона
= 1,6 х 10 -19 Кл);- число протонов; - число электронов в атоме; - порядковый номер в таблице Менделеева.
Слайд 13
Размеры атомных ядер
Так как для ядер существенны квантовые
законы поведения, то они не имеют четко определенных границ.
Можно говорить только о некотором среднем радиусе ядра.С увеличением массового числа радиус ядра увеличивается:
Слайд 15
Энергия связи нуклонов в ядре
Энергия связи атомных ядер
–
та энергия, которая необходима
для полного расщепления ядра
на отдельные частицы.
Уравнение
Эйнштейнасвязывающее массу и энергию:
Альберт Эйнштейн
(1879 - 1955)
Слайд 16
Дефект массы
Масса покоя ядра Мя всегда меньше суммы
масс
покоя слагающих его протонов и
нейтронов:
Дефект массы:
Слайд 18
Удельная энергия связи
- это энергия связи, приходящаяся
на один нуклон.
- Если не считать самых
легких ядер, удельная энергия связи примерно постоянна и равна 8 МэВ/нуклон.
Слайд 19
График удельной связи нуклонов в ядре
Максимальную энергию
связи (8,6 МэВ/нуклон) имеют элементы с массовыми числами от
50 до 60.Ядра этих элементов наиболее устойчивы.
Слайд 20
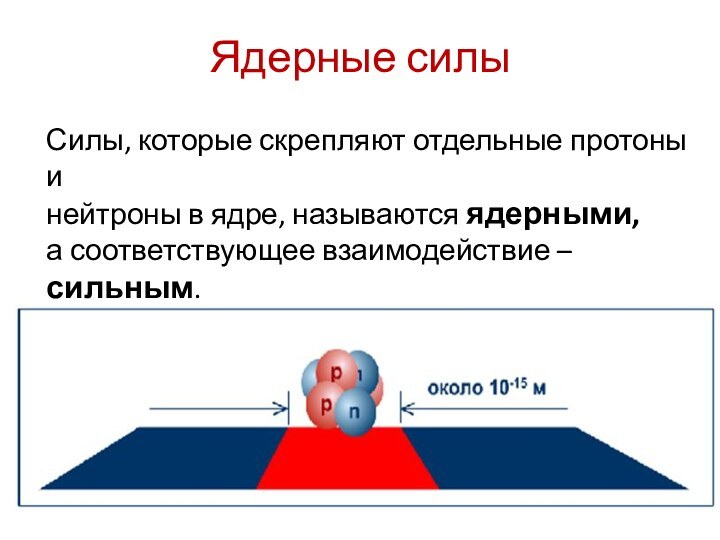
Ядерные силы
Силы, которые скрепляют отдельные протоны и
нейтроны
в ядре, называются ядерными,
а соответствующее взаимодействие – сильным.
Слайд 21
Свойства ядерных сил
- малый радиус действия ядерных сил
(R ~ 1 Фм);
- ядерное взаимодействие обладает свойством
насыщения;- зарядовая независимость ядерных сил;
- обменный характер ядерного взаимодействия;
- притяжение между нуклонами на больших расстояниях (r > 1 Фм), сменяется отталкиванием на малых (r < 0,5 Фм).
Слайд 22
Вопросы для закрепления материала:
Из каких частиц состоит ядро
атома любого элемента? Ответ.
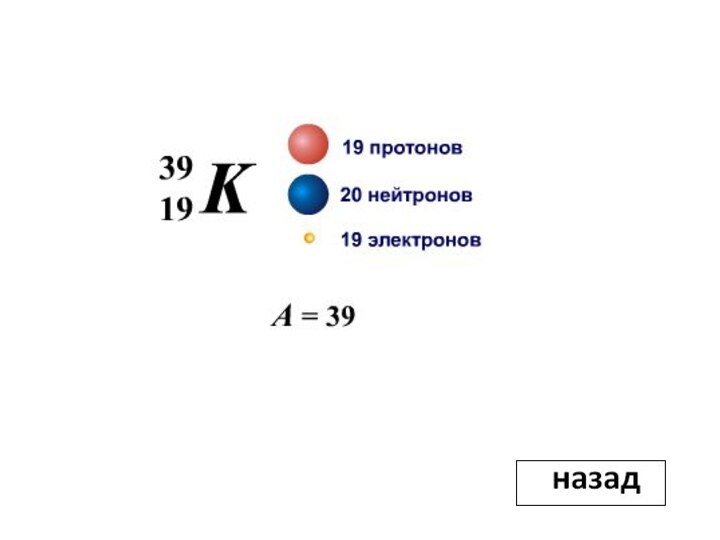
Сколько нуклонов и электронов содержит атом
калия? Ответ.3. Какому условию удовлетворяют масса покоя ядра и масса образующих его частиц при образовании ядра? Ответ.
4. Определите энергию связи ядра лития. Ответ.





























