Слайд 2
План лекции
1. Экспериментальная основа
теории
2. Корпускулярно-волновое описание электрона
3. Квантовые числа
4. Принципы построения и
способы изображения электронных структур
5. Строение атома и периодическая система элементов
Слайд 3
Атом
Устойчивая микросистема элементарных частиц, состоящая из положительно заряженного
ядра и электронов, движущихся в околоядерном пространстве
Слайд 4
Ядро атома состоит из протонов и нейтронов
Число
протонов в ядре равно атомному номеру элемента и числу
электронов в атоме
Атом - электронейтрален
Слайд 5
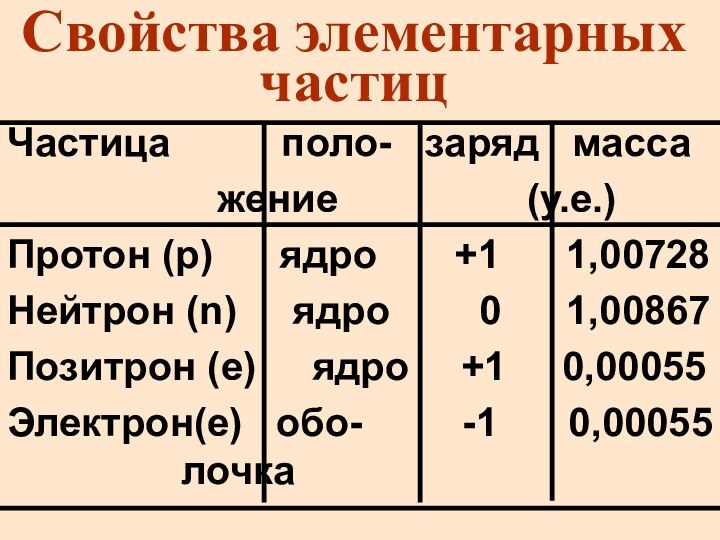
Свойства элементарных частиц
Частица поло-
заряд масса
жение
(у.е.)
Протон (p) ядро +1 1,00728
Нейтрон (n) ядро 0 1,00867
Позитрон (е) ядро +1 0,00055
Электрон(е) обо- -1 0,00055 лочка
Слайд 6
A = Z + N
A – массовое число
атома
Z – заряд ядра (число
протонов)
N – число нейтронов
Э
А
Z
Слайд 8
Cамостоятельно:
Радиоактивные превращения
химических элементов
Н.С.Ахметов «Общая и неорг. химия» стр.9 - 16
Слайд 9
Экспериментальные основы
Спектральный анализ, спектры
(Г. Кирхгоф, 1859; Дж.Бальмер,
1885, И.Ридберг)
Периодический закон
(Д.Менделеев 1869)
Фотоэффект
(А. Столетов, 1888)
Катодные лучи (Ж. Перрен, 1895)
Рентгеновские лучи (В.Рентген 1895)
Радиоактивность
(А. Беккерель, 1896)
Открытие электрона
(Дж. Томпсон, 1897)
Слайд 10
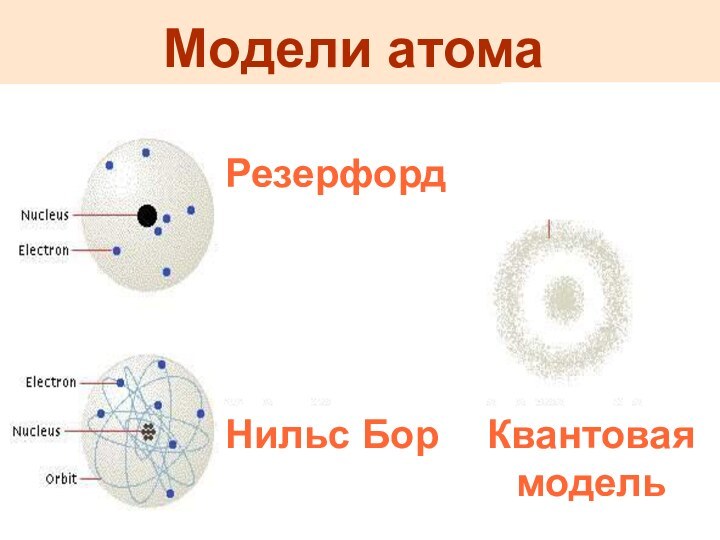
Модели атома
Резерфорд
Нильс Бор
Квантовая модель
Слайд 12
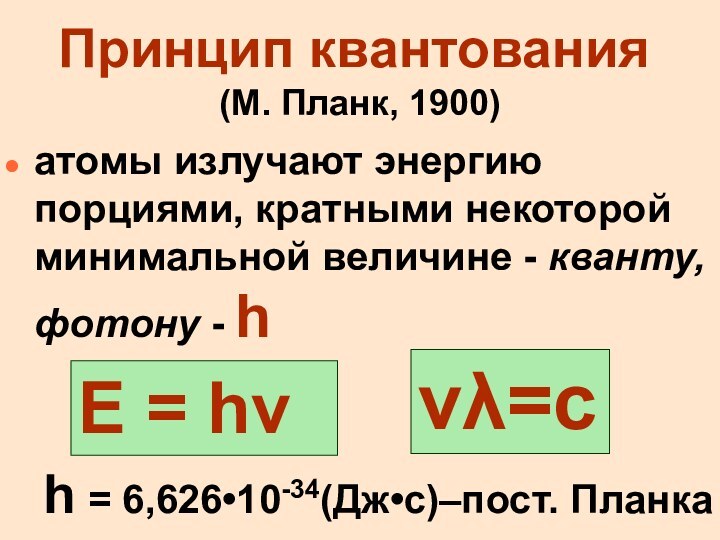
Принцип квантования
(М. Планк, 1900)
атомы излучают энергию порциями,
кратными некоторой минимальной величине - кванту, фотону - h
h = 6,626•10-34(Дж•c)–пост. Планка
Е = h
=c
Слайд 13
Принцип
корпускулярно-волнового дуализма
При движении электронов проявляются их
волновые свойства
При взаимодействии с веществом – корпускулярные
волновые и
корпускулярные свойства присущи электронам одновременно
(Л.Де-Бройль)
Слайд 14
Принцип неопределенности
(В. Гейзенберг, 1925)
Движение электрона в атоме
не может быть описано определённой траекторией
Положение и скорость
движения электрона в атоме можно найти лишь с определенной долей точности
Слайд 15
Волновое движение электрона
Для струны:
Ψ = А·Sin n(π/a)x
n –
квантовое число
а – длинна струны
х – координата точки на
струне
А – максимальная амплитуда колебаний
Слайд 16
Квантовые представления
Положение электрона характеризуется вероятностью пребывания частицы в
конкретной области пространства
Область наиболее вероятного пребывания электрона в атоме
называют атомной орбиталью - АО
Вероятность обнаружения электрона определяется квадратом волновой функцией - 2
Слайд 19
Уравнение Шредингера -
уравнение трехмерной волны
НΨ = Е·Ψ
В волновой теории движение эл-на представ-ся в виде стоячей волны, для которой характерен набор колебаний с длинами волн: , /2, /3, ....... /n; т.е. движение характеризуется квант. числом - n
Слайд 20
Квантовые числа
Уравнение Шредингера - трехмерно. Соответственно - три
набора квантовых чисел. Каждой координате свое квантовое число.
Размер, энергия,
форма и ориентация электронного облака изменяются в атоме скачками (квантами)
Слайд 21
Главное квантовое число(n)
n - 1, 2, 3,…, определяет
энергию электрона в атоме
Энергетический уровень - состояние электронов в
атоме с тем или иным значением n
Основное состояние атома - min энергия электронов
Возбужденное состояние – более высокие значения энергии электронов
Слайд 22
Орбитальное квантовое число (l) харак-ет форму электронного
облака
l = 0, 1, 2, 3….n-1
Подуровень:
s, p, d, f, g, h
Т.е. энерг-кий уровень (n) содержит совокупность энерг-ких подуровней, отличающихся по энергиям (в многоэлектронном атоме)
Слайд 23
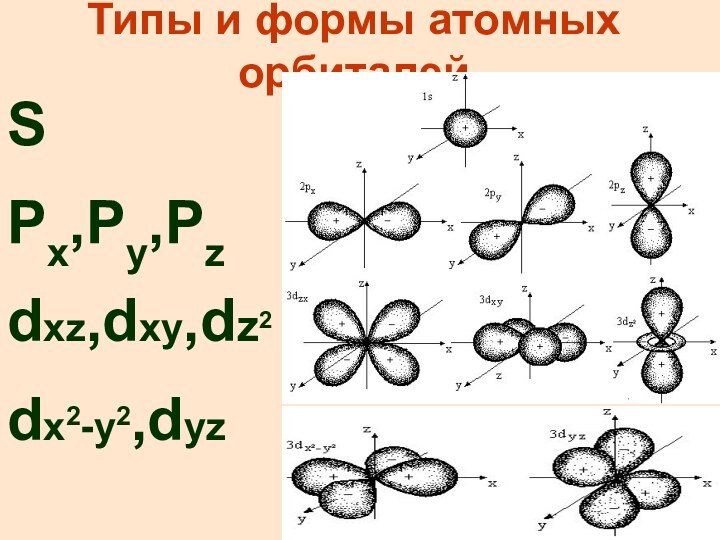
Типы и формы атомных орбиталей
S
Px,Py,Pz
dxz,dxy,dz2
dx2-y2,dyz
Слайд 24
Магнитное квантовое число (ml) характеризует ориентацию электронных облаков
в пространстве
ml меняется от –l до +l,
а всего = 2l + 1 значений
Например:
l = 0 (s); ml = 0
l = 1 (p); ml = 0, +1, -1
Слайд 25
Спиновое квантовое число (ms) характеризует собственный магнитный момент
электрона, который или совпадает с ориентацией орбитального момента, или
направлен в противоположную сторону.
ms имеет значения: +1/2 или -1/2
Слайд 26
Атомная орбиталь (АО)
это состояние электрона в атоме, которое
описывается волновой функцией с набором из трех квантовых
чисел n, l, ml
Условное изображение АО
АО обозначают с помощью кв. чисел
Например:
1s (n = 1, l = 0, ml = 0)
2p (n = 2, l = 1, ml = -1, 0, +1)
Слайд 27
Закономерности формирования электронных структур
Принцип наименьшей энергии: электрон
размещается на АО c min
энергией
Принцип Паули: в атоме не может быть двух электронов с одинаковым набором 4-х кв.чисел
Правила Гунда: (1) на одном подуровне сумма спинов электронов максимальна, (2) сумма магнитных кв-х чисел максимальна.
Слайд 28
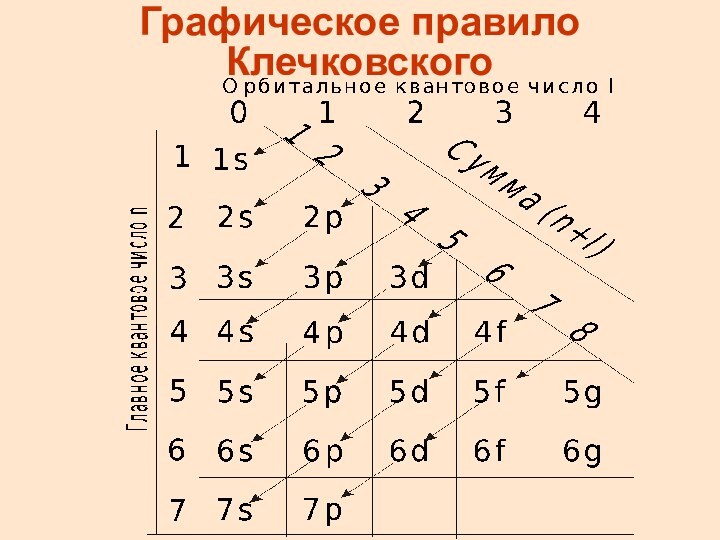
Правила Клечковского
Ниже по энергии находится та орбиталь для
которой сумма (n + l) минимальна
Если сумма (n +
l) для двух подуровней одинакова , то сначала эл-ны заполняют АО с меньшим n
Слайд 29
Графическое правило Клечковского
Слайд 30
Последовательность заполнения АО по правилам Клечковского
1sι 2s2pι 3s3pι
4s3d4pι 5s4d5pι 6s4f5d6pι 7s5f6d7p
Слайд 31
Способы изображения электронных структур
Электронная формула
Графическая структура
Энергетическая диаграмма
Слайд 32
Примеры электронных структур
Полная электронная формула
Se - 1s22s22p63s23p64s23d104p4
Краткая формула Se - 4s24p4
Электроно-графическая формула
Ti
p d
S
4
3
2
1
Слайд 33
Энергетическая диаграмма ванадия
Е
5
4
3
2
1
S
p
d
f
Слайд 34
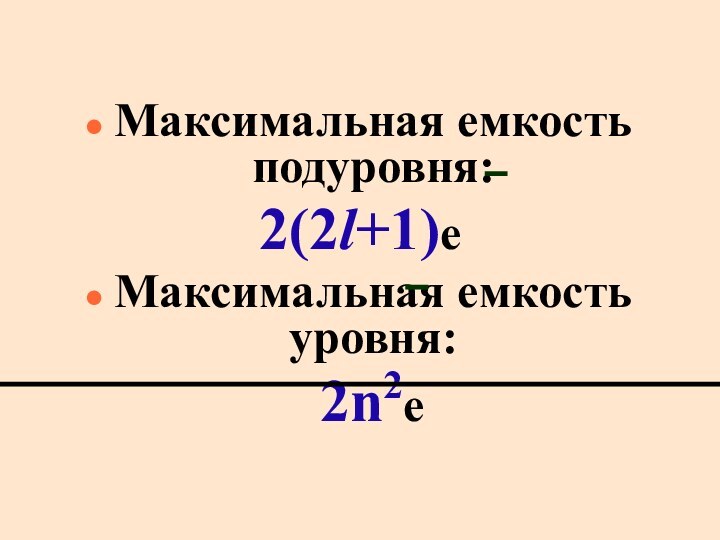
Maксимальная емкость подуровня:
2(2l+1)e
Максимальная емкость уровня:
2n2е
Слайд 35
Проскок электрона
Пример: z = 24; Cr
Ожидаемая: 1s22s22p63s23p64s23d4
Действительная:
1s22s22p63s23p64s13d5
Слайд 36
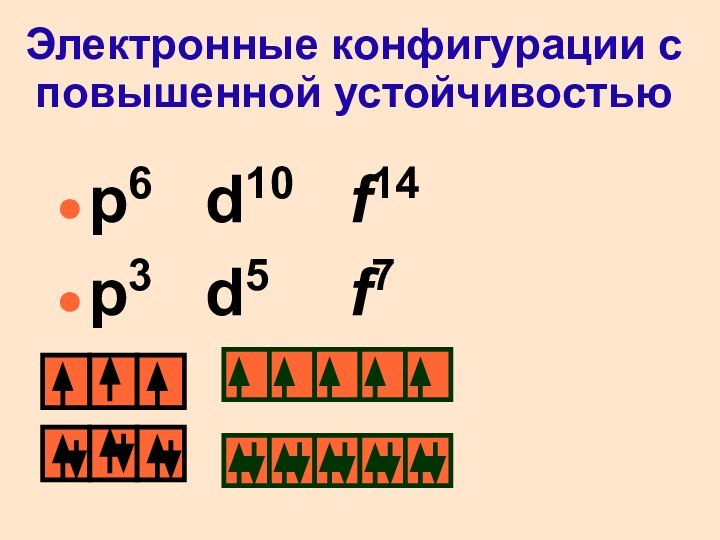
Электронные конфигурации с повышенной устойчивостью
p6 d10 f14
p3 d5 f7
Слайд 37
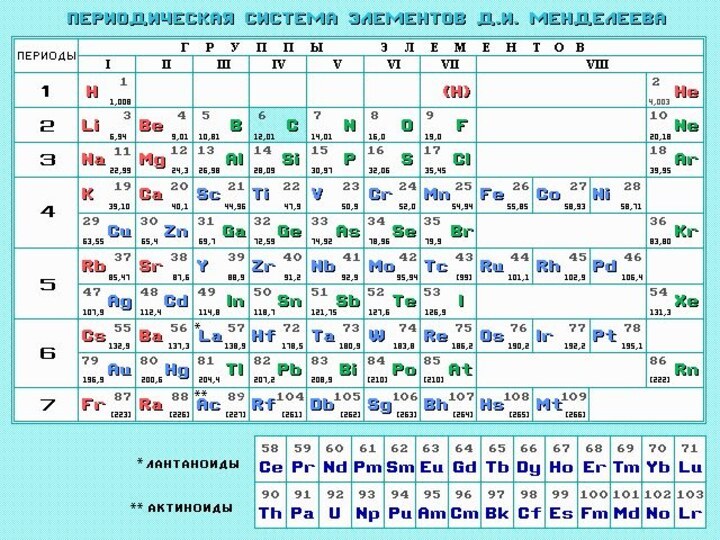
Периодическая система элементов
Д.И. Менделеева (1869г.)
Свойства элементов,
а также формы и свойства их соединений находятся в
периодической зависимости от их атомных весов
Слайд 38
Неясные моменты
В чем причина периодичности?
Почему элементы одной
группы имеют одинаковую валентность и образуют одинаковые соединения?
Почему число
элементов в периодах не одинаковое?
Почему в ПС расположение элементов не всегда соответствует возрастанию атомной массы (Аr – К, Co – Ni, Te – I)?
Слайд 39
Периодический закон
Свойства элементов, а также формы и
свойства их соединений находятся в периодической зависимости от заряда
ядер их атомов
Слайд 40
Причина периодичности
Определенная последовательность формирования электронных оболочек (принципы и
правила Паули, Хунда, Клечковского)
Периодическое повторение сходных электронных слоёв
и их усложнение при увеличении гл. кв. числа: периоды начинаются s-элементами, а заканчиваются р-элементами
Слайд 41
Короткие периоды
1 период (n=1): (2n2)
2 элемента (1s2)
2 период
(n=2): (2n2)
8 элементов (2s22p6)
3 период (n=3): (2n2 – 2*5)
8
элементов (3s23p6)
Слайд 42
Длинные периоды
4 период (n=4): (2n2 -2*7)
18 элементов (4s23d104p6)
5
период (n=5): (2n2 -2(7 + 9) )
18 элементов (5s24d105p6)
6 период (n=6): (2n2 -2(9 + 11) )
32 элемента (6s24f145d106p6)
7 период (n=7): (2n2 -2(9 + 11 + 13) )
32 элемента (7s25f146d107p6), незавершенный
Слайд 43
Период - горизонтальная последовательность эл-тов, атомы которых имеют
равное число энергетических уровней, частично или полностью заполненных электронами
Слайд 44
Группа - вертикальная последовательность элементов с однотипной электроной
конфигурацией атомов, равным числом внешних эл-нов, одинаковой max валентностью
и похожими химическими свойствами
Слайд 46
Периодичность свойств элементов
атомные и ионные радиусы
энергия ионизации
сродство
к электрону
электроотрицательность
валентность элементов
Слайд 47
Периодичность свойств простых веществ и соединений
температура плавления и
кипения
длина химической связи
энергия химической связи
электродные потенциалы
стандартные энтальпии
образования веществ
энтропии веществ и т.д.
Слайд 48
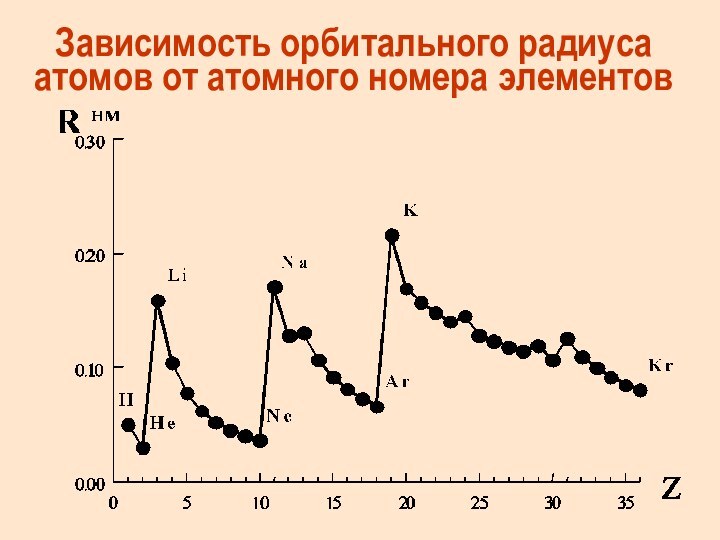
Атомные и ионные радиусы химических элементов
Орбитальный радиус атома
(иона) – это расстояние от ядра до максимума электронной
плотности наиболее удаленной орбитали этого атома
Слайд 50
Радиусы катионов и анионов
Превращение атома в катион -
резкое ум-ие орбитального радиуса
Превращение атома в анион почти не
изменяет орбитального радиуса
Rкат < Rат < Rан
Cl+ < Cl < Cl–
0,099 0,181нм
Слайд 51
Зависимость орбитального радиуса атомов от атомного номера элементов
Слайд 52
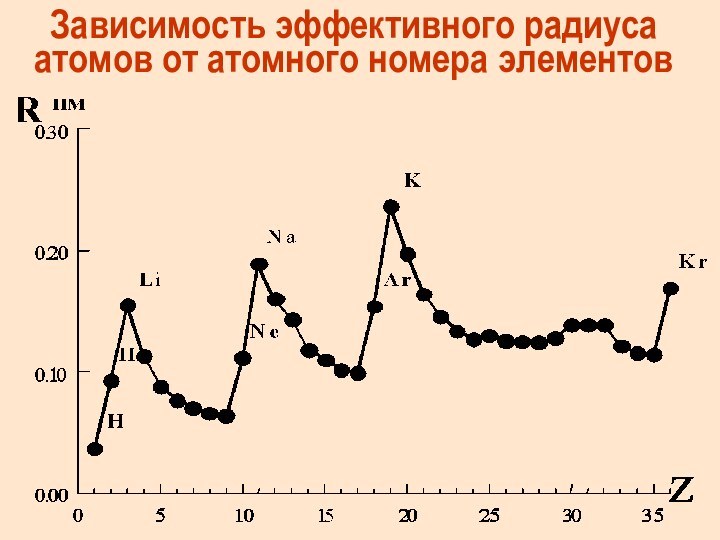
Зависимость эффективного радиуса атомов от атомного номера элементов
Слайд 53
Эффективные радиусы
атомов и ионов определяют
по межъядерным расст-ям
в молекулах
и кристаллах,
предполагая, что атомы –
несжимаемые шары
Слайд 54
Ковалентные радиусы - это эффективные радиусы, определяемые по
межъядерным расстояниям в ковалентных молекулах
Металлические радиусы - это эффективные
радиусы в металлах
Ионные радиусы – это эффективные радиусы в ионах
Слайд 55
Энергия
и потенциал ионизации атомов
Энергия ионизации –
это энергия, необходимая для отрыва электрона от атома и
превращение атома в положительно заряженный ион
Э – е = Э+, Еион [кДж/моль]
Ионизационный потенциал – это разность потенциалов, при которой происходит ионизация
J [эВ/атом]; Еион= 96,5•J
Слайд 56
1-й, 2-й, ….i потенциал ионизации
Энергия отрыва каждого последующего
электрона больше, чем предыдущего
J1 < J2
происходит тогда, когда заканчивается отрыв внешних электронов и следующий электрон находится на предвнешнем энергетическом уровне
Слайд 57
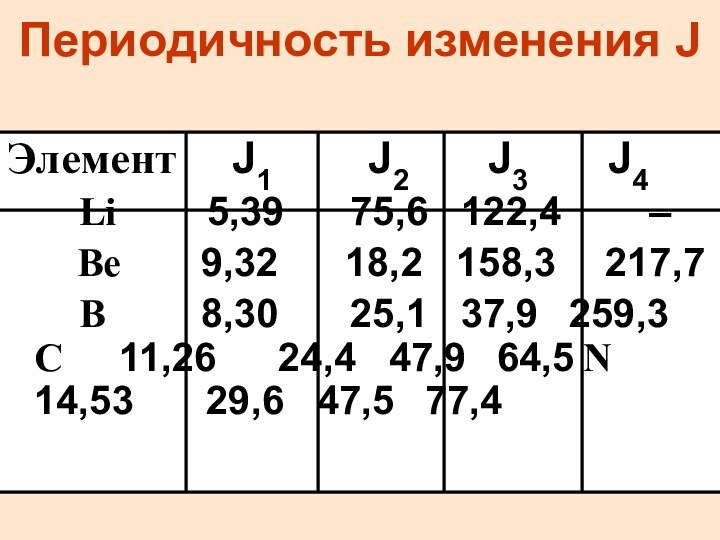
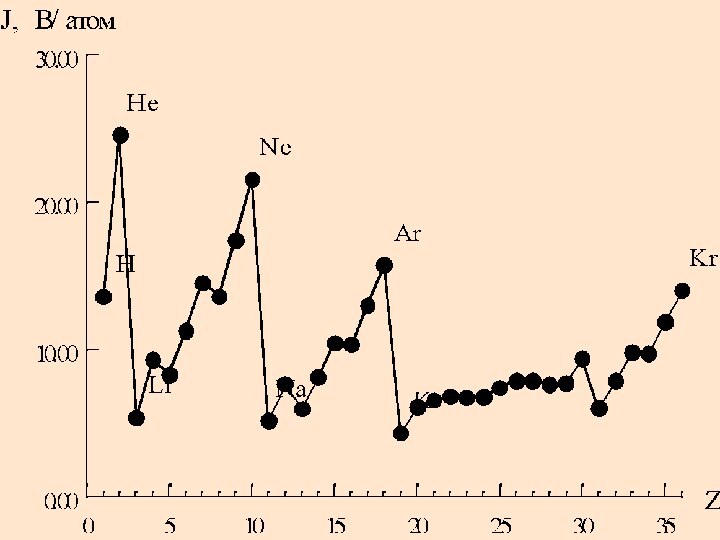
Периодичность изменения J
Элемент J1
J2 J3 J4
Li
5,39 75,6 122,4 –
Be 9,32 18,2 158,3 217,7
B 8,30 25,1 37,9 259,3 C 11,26 24,4 47,9 64,5 N 14,53 29,6 47,5 77,4
Слайд 59
Сродство к электрону
это энергия, выделяющаяся или поглощающаяся при
захвате электрона атомом или энергия, необходимая для присоединения электрона
к атому:
Э + е = Э- , F [кДж/моль]
Слайд 60
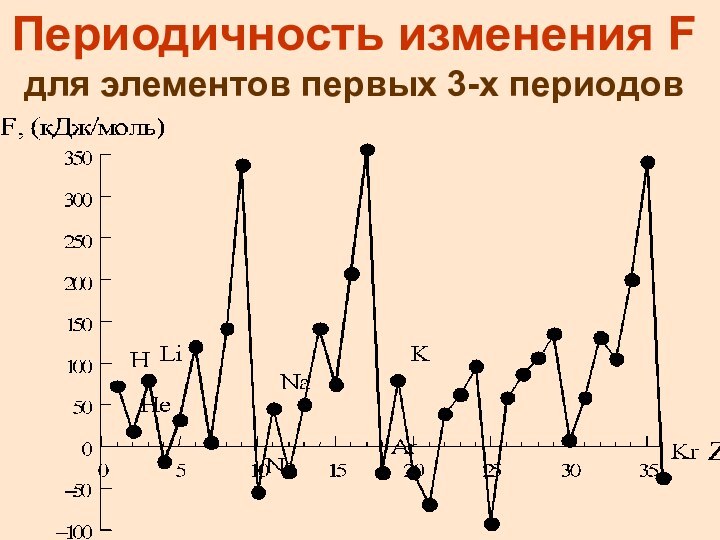
Периодичность изменения F для элементов первых 3-х периодов
Слайд 61
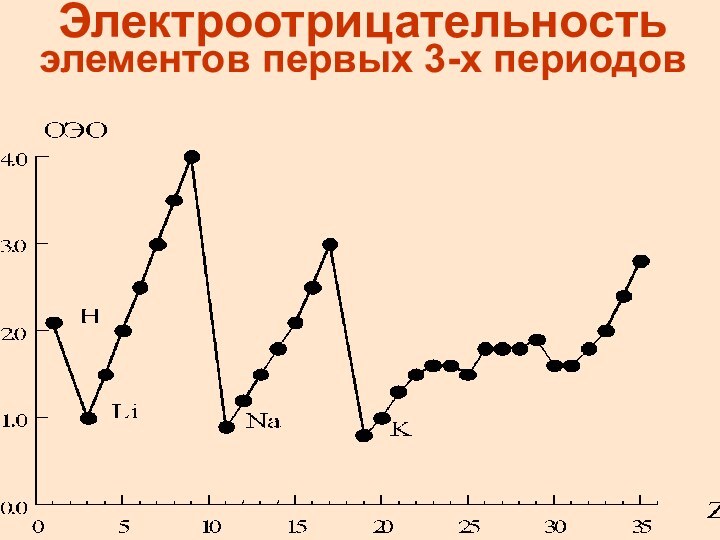
Электроотрицательность
- свойство атома притягивать электроны от других атомов,
с которыми он образует химическую связь в соединениях
Электроотрицательность
определяли Полинг, Малликен и др. ученые
Электроотрицательность выражается в относительных условных единицах
Слайд 62
Электроотрицательность элементов первых 3-х периодов
Слайд 63
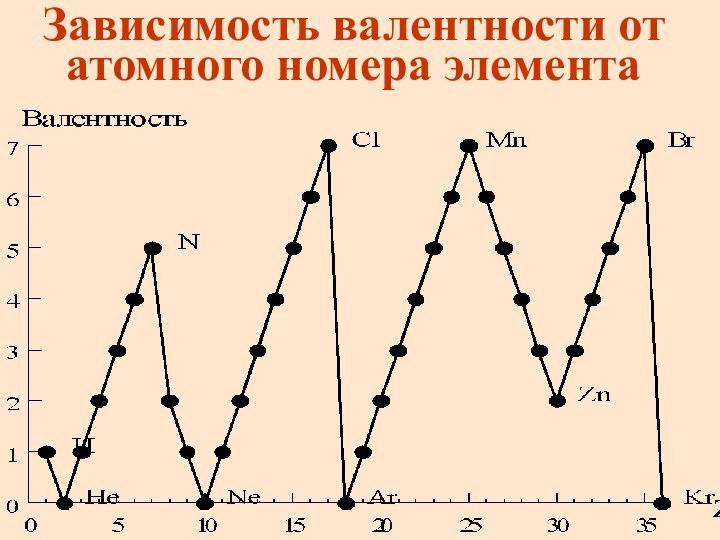
Валентность
Валентность определяется электронами внешнего уровня, поэтому высшая
валентность элементов главных подгрупп равна номеру группы
Слайд 64
Зависимость валентности от атомного номера элемента
Слайд 65
Периодические свойства соединений
основно-кислотные свойства оксидов и гидроксидов:
в
периодах ум-ся основные свойства, но ув-ся кислотные свойства этих
соединений
в группах основные свойства ув-ся, а кислотные ум-ся
Слайд 66
Периодичность
кислотно-основных свойств
Группа s-эл-ты H
p-эл-ты
Основ. d-эл-ты
Кислотные
Основые оксиды кисл.-осн. св-ва оксиды для
свойства зависят от с.о. неметалл
ув-ся
f- эл-ты - преимущественно основные
Слайд 67
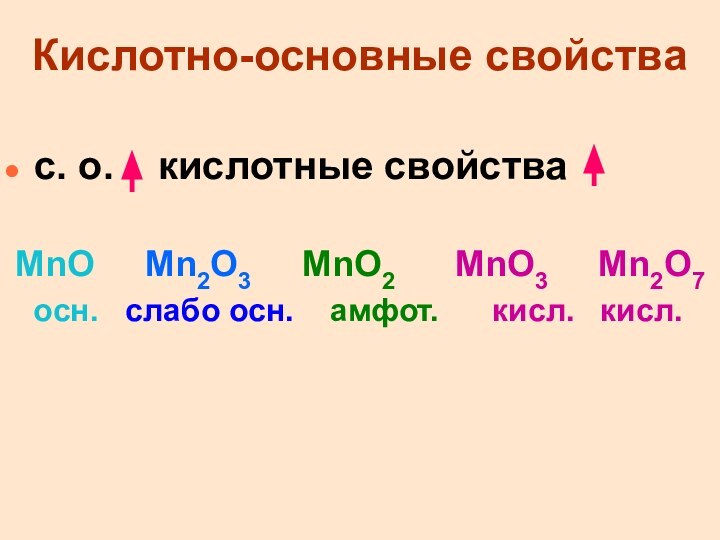
Кислотно-основные свойства
с. о. кислотные свойства
MnO
Mn2O3 MnO2 MnO3
Mn2O7
осн. слабо осн. амфот. кисл. кисл.
Слайд 68
По периоду:
(-) значения Gрo
кислотные св-ва оксидов
Na2O +
Al2O3 = 2NaAlO2 Goр= -175 kJ
Na2O + SiO2 =
Na2SiO3 Goр= -197 kJ
Na2O + 1/3P2O5 = 2/3Na3PO4 Goр= -371 kJ
Na2O + SO3 = Na2SO4 Goр= -522 kJ
Na2O + Cl2O7 = 2NaClO4 Goр= -587kJ
Слайд 69
Окислительная способность простых веществ и однотипных соединений:
в периодах
увеличивается
в группах уменьшается
Слайд 70
термическая устойчивость однотипных солей
в периодах уменьшается
и возрастает их склонность к гидролизу
в группах увеличивается
Слайд 71
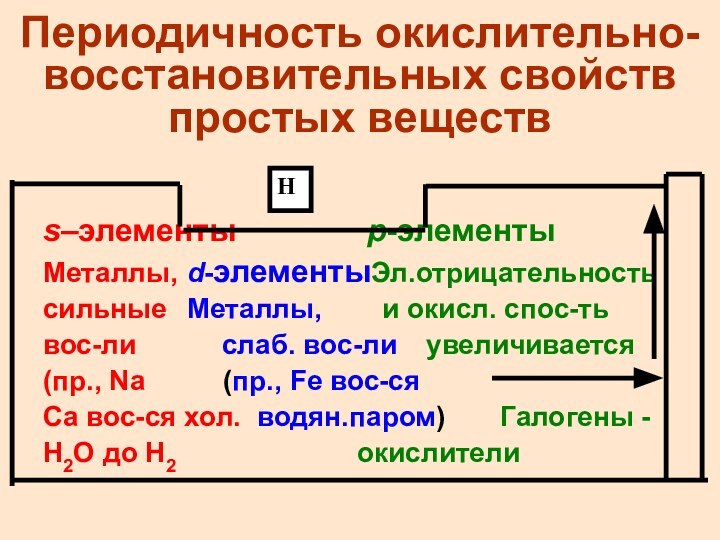
Периодичность окислительно-восстановительных свойств простых веществ
s–элементы p-элементы
Металлы, d-элементыЭл.отрицательность
сильные Металлы,
и окисл. спос-ть
вос-ли
слаб. вос-ли увеличивается
(пр., Na (пр., Fe вос-ся
Ca вос-ся хол. водян.паром) Галогены -
H2O до H2 окислители