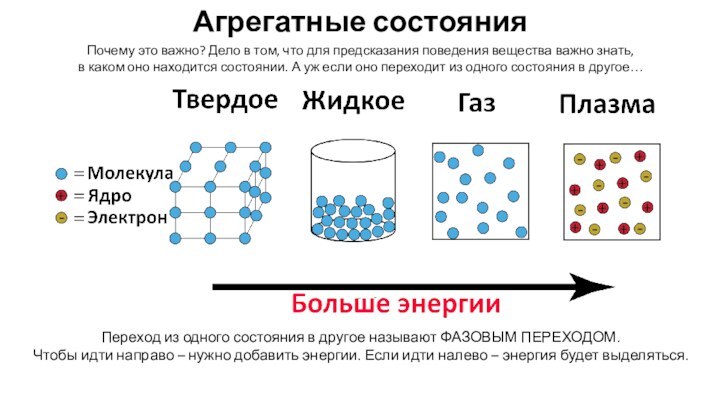
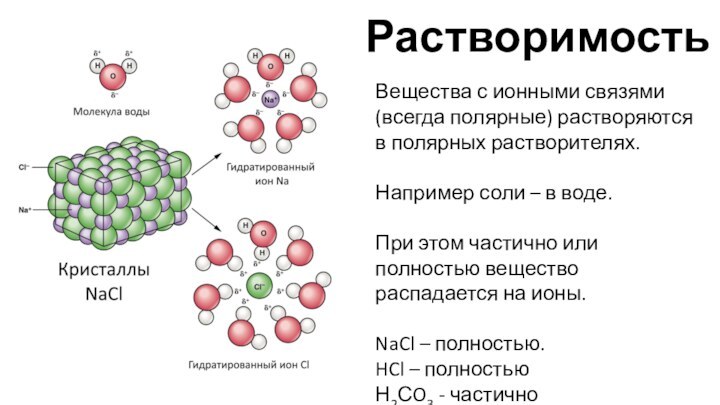
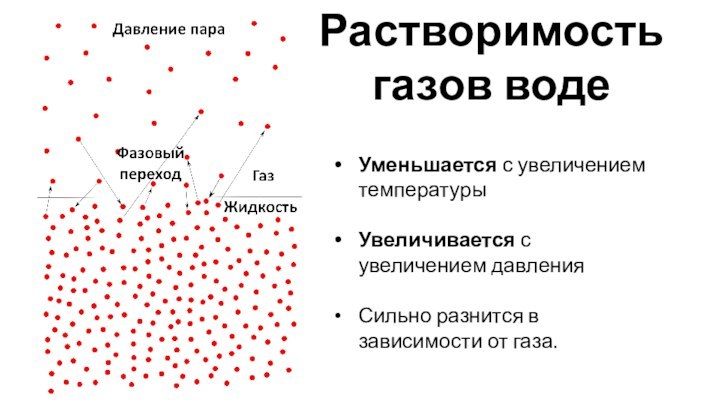
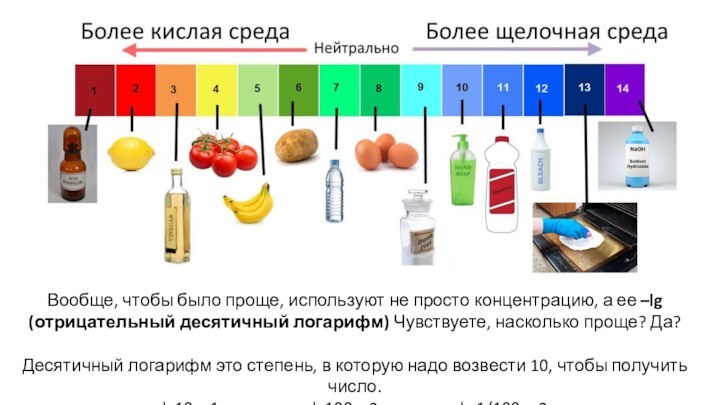
для предсказания поведения вещества важно знать,
в каком оно
находится состоянии. А уж если оно переходит из одного состояния в другое…Переход из одного состояния в другое называют ФАЗОВЫМ ПЕРЕХОДОМ.
Чтобы идти направо – нужно добавить энергии. Если идти налево – энергия будет выделяться.