Слайд 2
Цель урока:
сформировать понятие «валентность», научить осмысленно записывать химические
формулы, понимать причину различия состава веществ;
уметь определять валентность
по формуле вещества;
уметь составлять формулы веществ по валентности элементов;
уметь составлять структурные формулы веществ.
качественный и количественный состав в молекулах:
H
Cl , H2O, NH3, CH4.
– Что общего в составе молекул?
– Чем они отличаются друг от друга?
Слайд 4
Валентность
- свойство атомов одного элемента присоединять к себе
определенное число атомов другого элемента
Слайд 5
– В начале XIX века Дж. Дальтоном был
сформулирован закон кратных отношений, из которого следовало, что каждый
атом одного элемента может соединяться с одним, двумя, тремя и т.д. атомами другого элемента (как, например, в рассмотренных нами соединениях атомов с водородом).
В середине XIX века, когда были определены точные относительные веса атомов (И.Я. Берцелиус и др.), стало ясно, что наибольшее число атомов, с которыми может соединяться данный атом, не превышает определённой величины, зависящей от его природы. Эта способность связывать или замещать определённое число других атомов и была названа Э.Франклендом в 1853 г. “валентность”.
Поскольку в то время для водорода не были известны соединения, где он был бы связан более чем с одним атомом любого другого элемента, атом водорода был выбран в качестве стандарта, обладающего валентностью, равной 1.
Эдуард Франкленд
Слайд 6
Валентность обозначается римскими цифрами.
I
I I II
III I IV I
НCl H2O NH3 CH4
Атом водорода был выбран в качестве стандарта, обладающего валентностью, равной 1.
Слайд 7
Переменная и постоянная валентность
Есть элементы, которые имеют постоянную
валентность:
H, Li, Na, К, Rb, Cs, F,
Ag I
О, Be, Mg, Ca, Sr, Ba, Zn, Cd II
B, Al III
с переменной валентностью
Cu, Hg
I,II
Fe, Co, Ni II, III
Sn, Pb, C II, IV
P, As III, V
S II, IV, VI
Cr II, III, VI
Mn II, IV, VI, VII
Cl, Br, I I, III, V, VII
Слайд 9
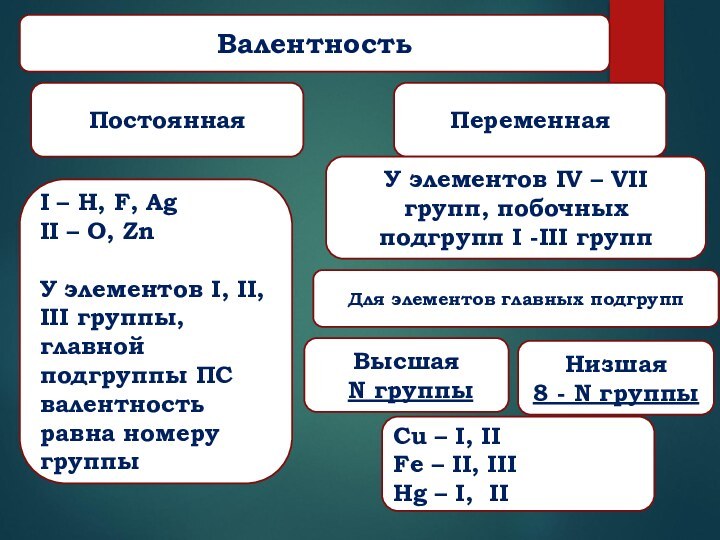
Валентность
Постоянная
Переменная
I – H, F, Ag
II – O, Zn
У элементов I, II, III группы,
главной подгруппы ПС валентность равна номеру группы
Cu – I, II
Fe – II, III
Hg – I, II
У элементов IV – VII групп, побочных подгрупп I -III групп
Высшая
N группы
Низшая
8 - N группы
Для элементов главных подгрупп
Слайд 10
Алгоритм определения валентности элемента по формуле вещества:
1. над
символами химических элементов с постоянной валентностью надписать валентность элемента
? II
Fe2O3
2. умножить валентность на число атомов этого элемента
IIx3=6
3.разделить полученное число на число атомов элемента с неизвестной валентностью; частное является значением валентности данного элемента
6:2=III
III II
Fe2O3
Слайд 11
Задание 1: определите валентность элементов по формулам следующих
веществ
1-вариант
PH3 CuO Mn2O7
2-вариант
SO2 SiH4 P2O5
Слайд 12
Определите валентность элементов в веществах
SiH4, CrO3, H2S,
CO2, CO, SO3, SO2, Fe2O3,
FeO, HCl, HBr, Cl2O5, Cl2O7,
РН3, K2O,
Al2O3, P2O5, NO2, N2O5, Cr2O3, SiO2, B2O3,
SiH4, Mn2O7, MnO, CuO, N2O3
Слайд 13
«КРЕСТИКИ-НОЛИКИ»
ВЫИГРЫШНЫЙ ПУТЬ: ОДНОВАЛЕНТНЫЕ МЕТАЛЛЫ.
ВЫИГРЫШНЫЙ ПУТЬ: ТРЁХВАЛЕНТНЫЕ МЕТАЛЛЫ.
Слайд 14
Определите валентность элементов
1 вариант Hg2О, NH3,
B2O3 , HgO, MnO2, FeCl3,
2 вариант
Cu2O, CH4, Ni2O3, SO3, CuCl2, H2O,
3 вариант Cl2O7, P2O5, KCl ,ZnCl2. CrCl3, NiO,
4 вариант FeCl3, MgS, Al2S3 , ZnS, SO2 , K2О,
5 вариант Fe2S3 , H2S, PH3, CaO, Ag2S, SnO2
Слайд 15
Алгоритм составления формулы вещества по валентности элементов
1. над
символами элементов надписать валентности элементов
VI
II
S O
2.найти НОК для чисел валентности: 6
3. разделить НОК на значение валентности этих элементов:
S (6 : VI=1); O (6 : II=3)
4.полученные числа это индексы этих элементов в формуле:
SO3
Слайд 16
Задание 2: составить формулы веществ по известным валентностям
элементов
II I III I III II
1-вариант: CaCl PCl N O
III II II I III I
2-вариант: СrO BaCl AlH
Слайд 17
СОСТАВЬТЕ ФОРМУЛЫ БИНАРНЫХ СОЕДИНЕНИЙ ПО ИЗВЕСТНЫМ ВАЛЕНТНОСТЯМ :
ВАРИАНТ
1:
ВАРИАНТ 2:
ВАРИАНТ 3:
ВАРИАНТ 4:
Слайд 18
Составьте формулы веществ согласно валентности, между атомами:
меди (II)
и кислорода,
цинка и хлора,
калия и йода,
магния и серы.
бора и
кислорода;
алюминия и хлора;
лития и серы
мышьяка и кислорода
Слайд 19
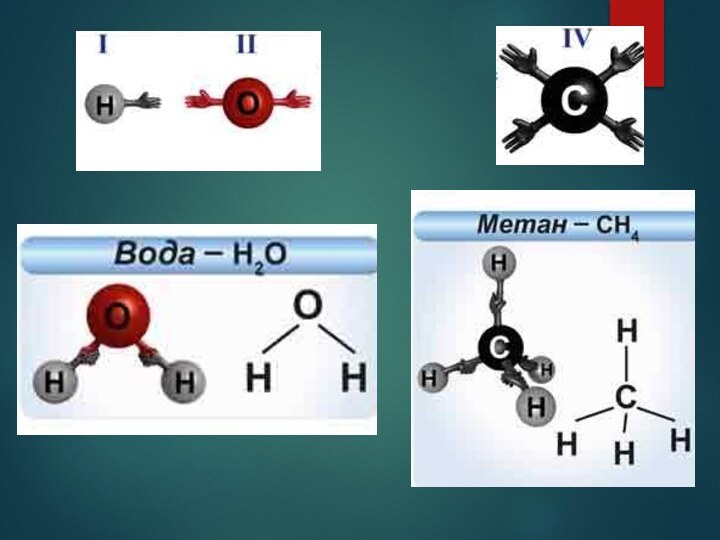
Структурная формула -
это графическое изображение химического строения молекулы вещества,
в котором показывается порядок связи атомов, их геометрическое расположение.
Кроме того, она наглядно показывает валентность атомов входящих в ее состав.
Алгоритм составления структурной формулы вещества по
молекулярной формуле вещества
IV II
CO2 O=C=O
число линий - означает валентность данного элемента
Слайд 22
Задание 3: составить структурную формулу следующих веществ
1 вариант:
PH3
CuO Mn2O7
2 вариант:
SO2 SiH4 P2O5