Слайд 2
V группа А подгруппа
К элементам этой подгруппы относятся:
N ;
P ; As ; Sb; Bi.
Особенно большое значение имеют
азот и фосфор
Азот входит в состав воздуха, в состав
белков, нуклеиновых кислот, в состав
многих горных пород и минералов(селитры)
Фосфор входит в состав белков, нуклеиновых кислот, минералов апатитов и фосфоритовю
Слайд 3
Характеристика азота и фосфора по периодической системе
Слайд 4
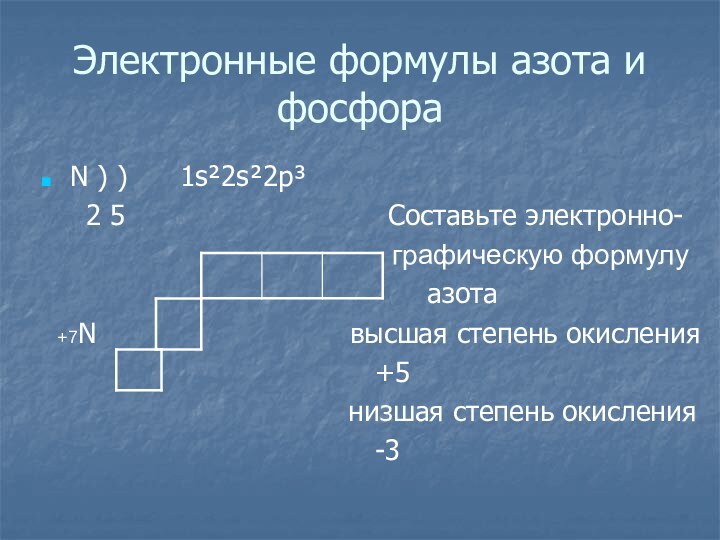
Электронные формулы азота и фосфора
N ) )
1s²2s²2p³
2 5
Cоставьте электронно-
графическую формулу
азота
+7N высшая степень окисления
+5
низшая степень окисления
-3
Слайд 5
Знаете ли вы что …
Впервые азот был открыт
ученым
Д. Резерфордом в 1772г. Свойства исследовали К
Шееле, Г. Кавендиш,
Дж. Пристли.
А. Лавуазье предложил термин азот, что в переводе с греческого «безжизненный»
Слайд 6
Азот. Физические свойства
Строение молекулы N2
Структурная формула N
Ξ N
Электронная формула : N ⋮⋮ N :
Связь ковалентная неполярная, очень прочная, тройная 1σ(сигма) и 2π ( пи)
Азот- газ без цвета и запаха, плохо растворим в воде, немного легче воздуха,
Ткип = - 196 ºС
Слайд 7
Химические свойства азота
При обычных условиях малоактивен
При Т=2000º реагирует
с кислородом
N2 + O2 ↔ 2
NO –Q
При Т=400ºС и р
N2 +3H2 ↔ 2 NH3
аммиак
С некоторыми металлами
3 Mg + N2 → Mg3 N2
нитрид магния
Слайд 8
Аммиак
Соединение азота с водородом называется аммиак NH3
Строение
молекулы
H –
N – H
|
H
Ковалентная полярная связь
Форма молекулы тетраэдр рис.11 стр. 47
Слайд 10
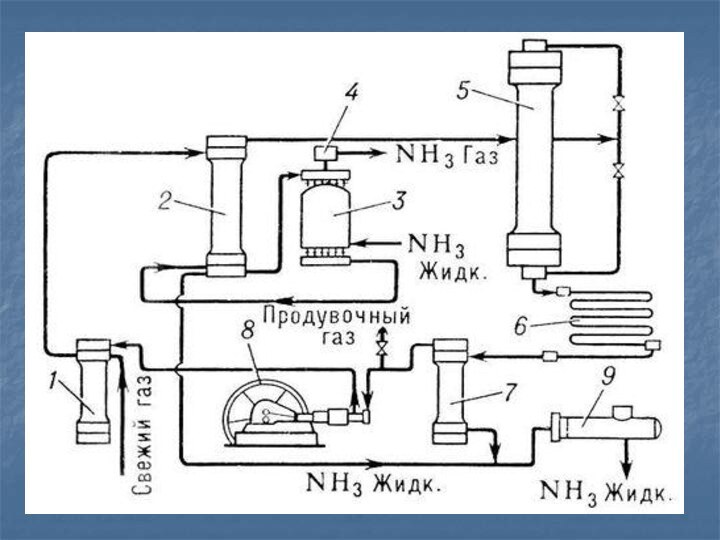
Получение в промышленности
В 1913 году в Германии был
создан первый завод каталитического синтеза аммиака
N2 + 3H2↔
2NH3 +Q
Реакция обратимая, Т=300ºС , Р = 20- 30МПа, в присутствии катализатора-
пористого железа
Слайд 12
Получение в лаборатории
При нагревании смеси солей аммония со
щелочами.
2NH4Cl +Ca(OH)2=CaCl2+2NH3↑ +2H2O
хлорид аммония
аммиак
Физические свойства
Бесцветный газ с характерным резким запахом, почти в 2 раза легче воздуха. Хорошо растворим в воде. В 1V H2O – 700V NH3
Слайд 13
Химические свойства
Активное вещество
Взаимодействует с водой
NH3 + H2O
↔ NH4OH гидроксид аммония
С кислотами
NH3
+ HCl = NH4Cl хлорид аммония
2NH3 + H2SO4 = (NH4)2SO4 сульфат аммония
Слайд 14
Химические свойства
Непрочное соединение при нагревании разлагается
2NH3↔N2 + 3H2
Горит
?NH3 + ? O2→
? N2 + ?H2O
Окисляется в присутствии катализатора Pt
? NH3 + ? O2 → ? NO + ?H2O
проверка стр. 49 табл. 13
Восстанавливает металлы из их оксидов
2 NH3 + 3 CuO = N2 ↑ +3Cu + 3 H2O
Слайд 16
Соли аммония
NH3 + HCl = NH4Cl
хлорид аммония
2NH3 + H2SO4 = (NH4)2 SO4 сульфат
аммония
NH3 + H2SO4 = NH4HSO4 гидросульфат аммония
NH3 + HNO3 = ? Дать название
NH3 + H3PO4 = ?
Качественная реакция на ион аммония
NH4 CL +NaOH =NaCl +NH3↑+H2O запах аммиака
Разлагается при нагревании
NH4NO3 = N2O +2 H2O
NH4NO2 = N2 + 2H2O
Слайд 17
Вопросы и упражнения
Какие элементы составляют VА группу?
Какого строение
внешнего электронного слоя атомов азота и фосфора?
Каковы физические свойства
проявляет азот?
Почему азот химически малоактивен?
Сколько по объему содержится азота в воздухе?
Какой тип химической связи в молекуле азота?
Где азот встречается в природе?
Как получают азот?
Назовите водородное соединение азота, его физические свойства.
Как получают аммиак в лаборатории и промышленности?
Слайд 18
Вопросы и упражнения
Какие соли образует аммиак?
Какая реакция является
качественной на катион аммония?
Где находят применение азот, аммиак, соли
аммония?
Слайд 19
Упражнения
Закончите уравнения реакций
N2 + H2 →
?
N2 + Ca → ?
N2
+ O2→ ?
NH3 + H2O →
NH3 + H2SO4 →
Ca(OH)2 + NH4Cl →
Слайд 20
Упражнение
Решить цепочку превращения
N2 →NH3 → NH4OH→
NH4Cl →NH3
Решить ОВР
NH3 + O2 → NO
+ H2O
Вычислить объем аммиака( н.у.) , который образуется из 25л азота и 25 л водорода?
Вычислить какую массу и какой объем составляет 5 молей аммиака?
Вычислить относительную плотность по водороду и по воздуху аммиака?
Слайд 21
Оксиды азота
Известно несколько оксидов азота
Слайд 22
Азотная кислота
Строение молекулы HNO3
O
//
H – O – N
\\
O
Слайд 24
Получение
В лаборатории
NaNO3 + H2SO4 = NaHSO4 +
HNO3↑
нитрат натрия
гидросульфат натрия
В промышленности
4NH3 + O2 = 4NO + 6H2O +Q
2NO + O2 = 2NO2
4 NO2 + H2O + O2 ↔ 4 HNO3 +Q
Слайд 25
Физические свойства
Бесцветная дымящаяся жидкость с резким запахом. Хорошо
растворима в воде. Концентрированная очень опасна. Под действием света
разлагается. Хранят в темной посуде. Сильный окислитель. Огнеопасна.
Слайд 26
Химические свойства
Общие с другими кислотами
.Сильная кислота, диссоциирует полностью
HNO3→ H໋ + NO3ˉ
Реагируют с основными оксидами
CuO + HNO3 = ? + ?
Реагируют с основаниями
Fe( OH)3 + HNO3 = ? + ?
Реагирует с солями более слабых кислот
Na2CO3 + HNO3 = ? + ? + ?
Слайд 27
Специфические свойства
При нагревании и на свету разлагается
4HNO3 ↔ 2 H2O + 4NO2↑ + O2↑
При взаимодействии
с белками образуется вещество ярко- желтого цвета.
По разному реагирует с металлами при этом никогда не выделяется водород Н2
Me + HNO3 = Me NO3 + H2O + газ
Слайд 30
Примеры
Сu + HNO3 = ? + ? +
?
конц
Cu
+ HNO3 = ? + ? + ?
разб
Слайд 32
Соли азотной кислоты
Соли азотной кмслоты – нитраты
Нитраты калия,
натрия, аммония и кальция – называются селитрами.
NaNO3 – нитрат
натрия , натриевая селитра
NH4NO3 – нитрат аммония, аммиачная
селитра.
Все нитраты растворимы в воде.
Являются сильными окислителями.
При нагревании все нитраты разлагаются с выделением кислорода О2↑
Слайд 34
Примеры
NaNO3 = ? + ?
Zn (NO3)2 = ?
+ ? + ?
Ag NO3 = ?
+ ? + ?
Закончить уравнения и расставить коэффициенты
Слайд 35
Вопросы и упражнения
Какие оксиды азота вам известны?
Каковы физические
свойства азотной кислоты
Опишите химические свойства азотной кислоты?
Какие специфические свойства
азотной кислоты вам известны?
Как получают азотную кислоту в лаборатории?
Как получают азотную кислоту в промышленности?
Где применяют азотную кислоту?
Как называют соли азотной кислоты и где их применяют?
Слайд 36
Упражнения
Напишите молекулярные и ионные уравнения реакций
CaO
+ HNO3 =
NaOH + HNO3 =
K2CO3 + HNO3 =
Составьте уравнение реакции конц. азотной кислоты с медью. Решите ее как ОВР
Сu + 4 HNO3 = Cu(NO3)2 + 2NO2 + 2H2O