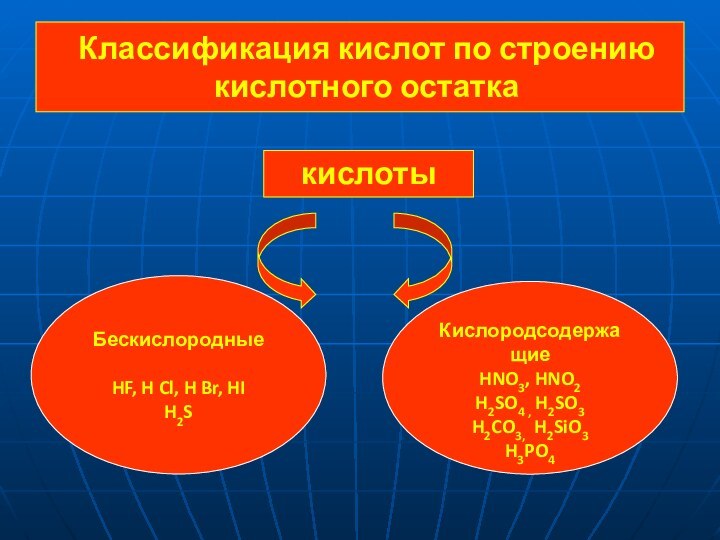
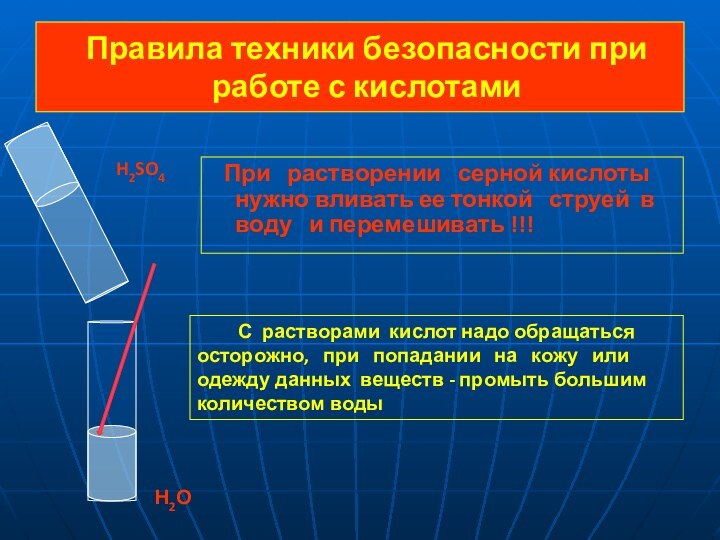
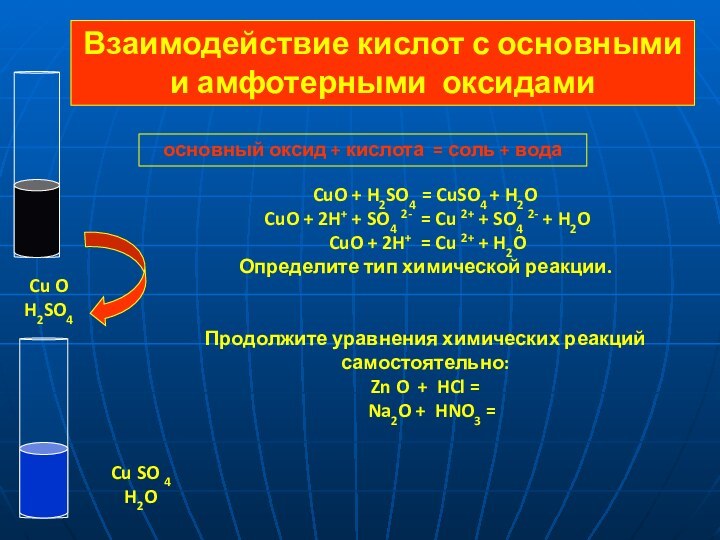
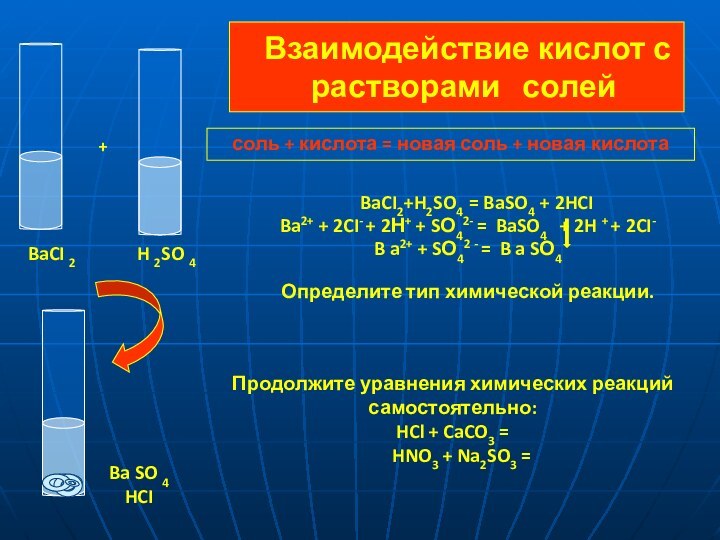
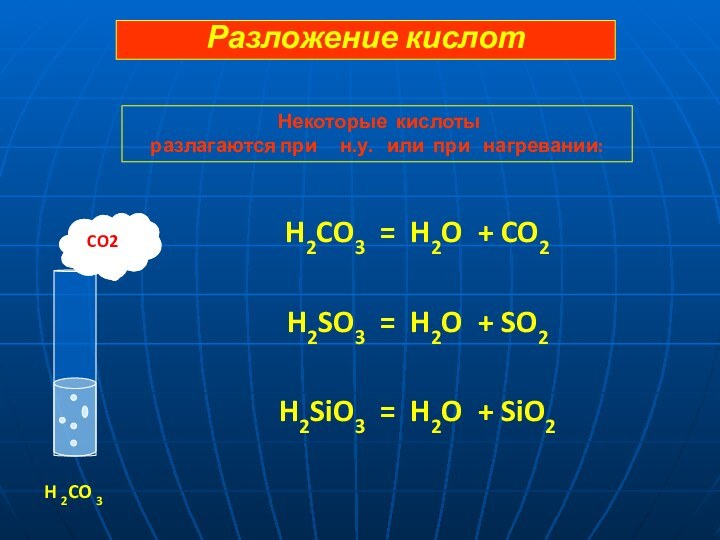
SO 4 = 2 H+ + SO42-
Кислоты –
это электролиты,которые при диссоциации образуют катионы водорода
и анионы кислотного остатка.
Что такое кислоты?
Кислотами называют сложные вещества, молекулы которых состоят из атомов водорода, способных замещаться на атомы металлов, и кислотных остатков.