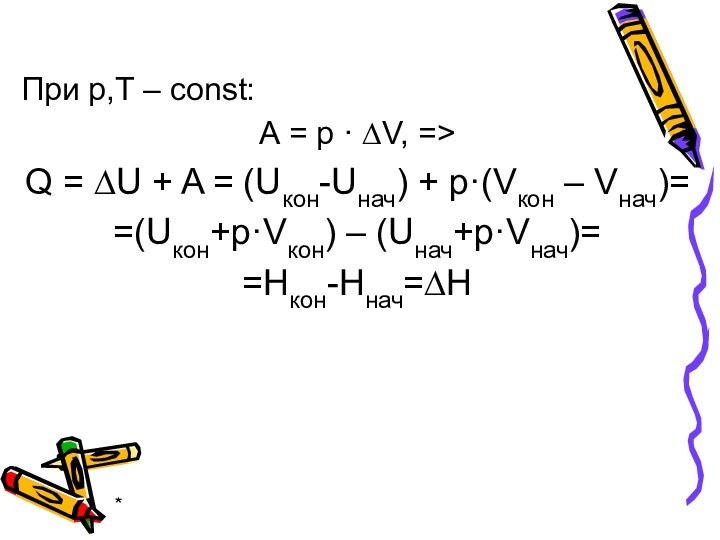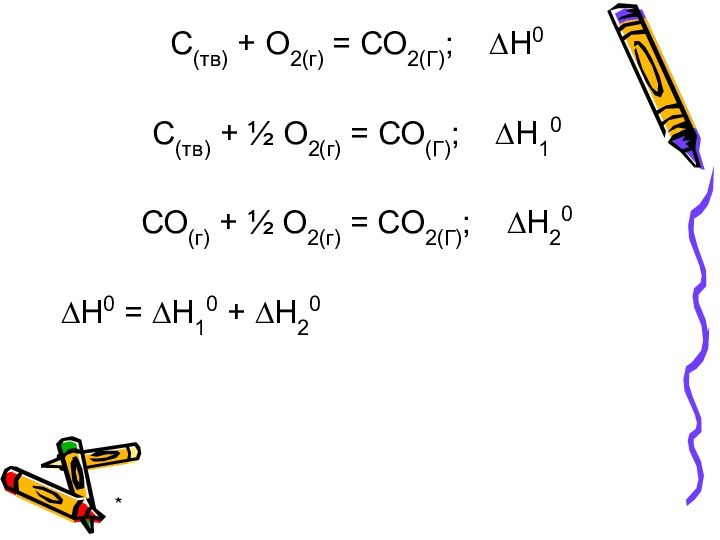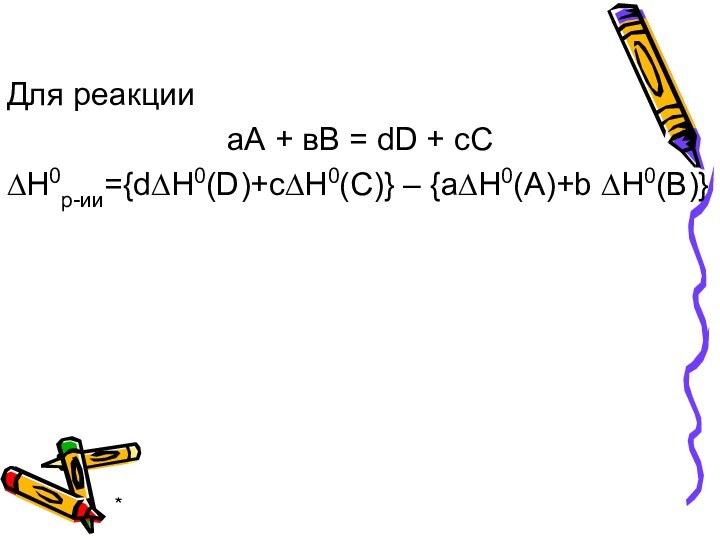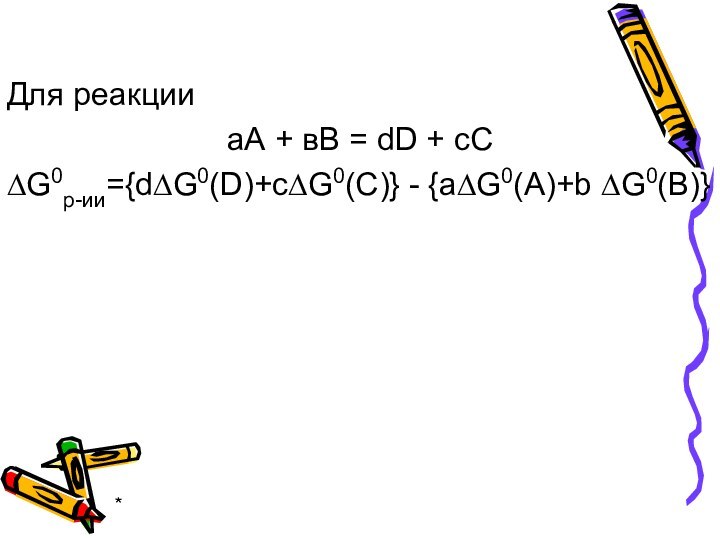Слайд 2
*
Термодинамика – это наука о взаимных превращениях различных
видов энергии друг в друга, а также о формах
передачи энергии в виде теплоты и работы.
Классическая термодинамика рассматривает вещество с точки зрения изменения макроскопических свойств, таких как давление, температура, объем, потенциал и т. п.
Слайд 3
*
Система – это совокупность материальных объектов (тел), ограниченных
мысленными или реально существующими границами от окружающей среды.
Примеры: газ
в сосуде, клетка, орган, растение…
Слайд 4
*
Системы бывают:
открытые, в которых существует обмен
энергией и веществом с окружающей средой;
закрытые, в которых существует
обмен энергией, но нет обмена веществом;
изолированные, в которых нет обмена ни энергией, ни веществом.
Живые организмы являются открытыми
системами.
Слайд 5
*
Две группы параметров характеризуют состояние любой т/д с-мы:
Интенсивные
т/д параметры (давление, температура, вязкость и др.), не зависящие
от массы или числа частиц в с-ме;
Экстенсивные т/д параметры (масса, объём, внутренняя энергия), зависящими от массы или числа частиц в с-ме.
Слайд 6
*
Наряду с параметрами состояния используют функции состояния (энергию,
энтальпию, энтропию…). Функции состояния рассчитывают исходя из параметров, описывающих
данное состояние с-мы, это всегда экстенсивные величины.
Изменение параметров т/д с-мы называется термодинамическим процессом.
Слайд 7
*
Состояние с-мы характеризуется значением параметров и функций
состояния (Т, р, V и т.д.), процесс характеризуется изменением
или постоянством параметров и функций.
Жизнедеятельность человека протекает при постоянстве температуры и давления, т. е. при изобарно-изотермических условиях (р,Т - const).
Слайд 8
*
Для описания движения материи в
живых организмах, используется:
Энергия – общая количественная мера
движения и взаимодействия всех видов материи.
Энтропия – т/д функция, характеризующая меру неупорядоченности системы, (неоднородности расположения ее частиц).
Слайд 9
*
Информация – мера организованности системы, т. е упорядоченности
расположения и движения ее частиц.
Слайд 10
*
Первый закон т/д:
1) энергия не исчезает и не
возникает из ничего, а только превращается из одного вида
в другой в строго эквивалентных соотношениях.
2) т/д система может совершать работу только за счёт своей внутренней энергии или каких-либо внешних источников энергии.
Слайд 11
*
3) если к закрытой системе подвести теплоту Q,
то эта энергия расходуется на увеличение внутренней энергии системы
∆U и на совершение системой работы А против внешних сил окружающей среды:
Q= ∆U + A
Слайд 12
*
Теплота Q – это форма беспорядочного (теплового) движения
образующих тело частиц (в Дж или кал).
Работа А –
это форма передачи энергии в виде упорядоченного движения.
Слайд 13
*
При р,Т – const:
А = р · ∆V,
=>
Q = ∆U + A = (Uкон-Uнач) + р·(Vкон
– Vнач)=
=(Uкон+р·Vкон) – (Uнач+р·Vнач)=
=Hкон-Ннач=∆Н
Слайд 14
*
Энтальпия Н – это т/д функция, характеризующая энергетическое
состояние системы при изобарно-изотермических условиях (р,Т – const).
Раздел т/д,
изучающий энергетические эффекты процессов – термохимия.
Тепловой эффект реакции – это количество энергии, которое выделяется или поглощается в результате реакции.
Слайд 15
*
Экзотермические процессы сопровождаются выделением энергии из системы в
окружающую среду, ∆Н
окружающей среды, ∆H>0.
Слайд 16
*
В т/д для оценки энергетического состояния веществ используются
значения стандартных энтальпий образования этих веществ ∆Н0 ( ∆Н
в с. у.: р=101,3 кПа и Т=298 К).
Для простых веществ ∆Н0=0, для сложных ∆Н0 равна энтальпии реакции получения 1 моль этого вещества из простых веществ при с. у.
Слайд 17
*
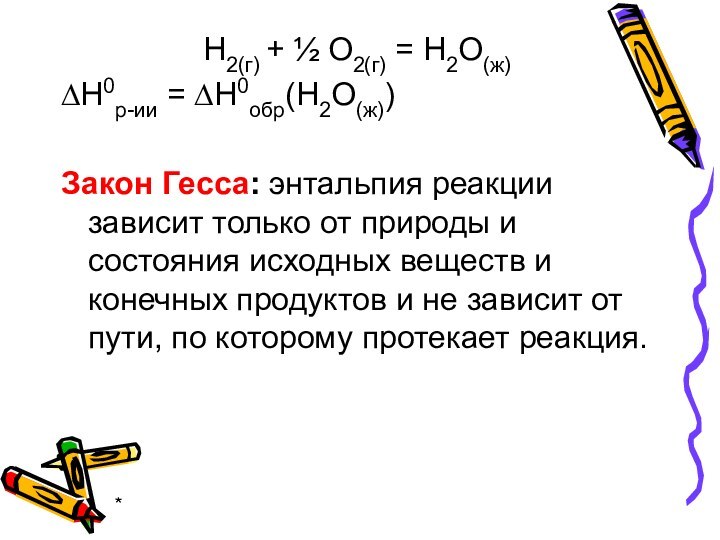
Н2(г) + ½ О2(г) = Н2О(ж)
∆Н0р-ии =
∆Н0обр(Н2О(ж))
Закон Гесса: энтальпия реакции зависит только от природы и
состояния исходных веществ и конечных продуктов и не зависит от пути, по которому протекает реакция.
Слайд 18
*
С(тв) + О2(г) = СО2(Г); ∆Н0
С(тв) +
½ О2(г) = СО(Г); ∆Н10
СО(г) + ½ О2(г)
= СО2(Г); ∆Н20
∆Н0 = ∆Н10 + ∆Н20
Слайд 19
*
Первое следствие закона Гесса: энтальпия реакции равна разности
алгебраической суммы ∆Н0обр всех продуктов реакции и алгебраической суммы
∆Н0обр всех исходных веществ с учетом стехиометрических коэффициентов
Слайд 20
*
Для реакции
аА + вВ = dD +
cC
∆Н0р-ии={d∆Н0(D)+c∆Н0(C)} – {a∆Н0(A)+b ∆Н0(B)}
Слайд 21
*
Второе следствие закона Гесса: энтальпия прямой реакции численно
равна энтальпии обратной реакции, но с противоположенным знаком.
N2(г) +
3H2(г) = 2NH3(Г); ∆Н01
2NH3(Г) = N2(г) + 3H2(г); ∆Н02
∆Н01 = – ∆Н02
Слайд 22
*
В медицине энергетическую характеристику продуктов питания принято
выражать в калориях
(1 калория = 4,18 Дж) и рассчитывать не на 1 моль, а на 1 г пищи, так как пища обычно представляет собой смесь питательных веществ сложного состава.
Слайд 23
*
Для определения калорийности пищи пользуются выражением
Q =
Q(белка) + Q(жира) + Q(углеводов)
и табличными значениями удельных теплот
полного ок-ия веществ в усл. организма:
условный белок – 17 кДж/г (4,1 ккал/г); условный жир – 39 кДж/г (9,3 ккал/г); углеводы – 17 кДж/г (4,1 ккал/г).
Слайд 24
*
обобщенной т/д функцией состояния системы, учитывающей энергетику и
неупорядоченность системы при изобарно-изотермических условиях является энергия Гиббса (изобарно-изотермический
потенциал, свободная энергия Гиббса):
G = H – T·S
Слайд 25
*
Изменение энергии Гиббса в результате любого процесса определяется
только конечным и начальным состоянием системы, независимо от пути
процесса:
∆G = Gкон – Gнач
В стандартных условиях используют стандартную энергию Гиббса образования этих веществ G0.
Для простых веществ ∆G0=0.
Слайд 26
*
Для реакции
аА + вВ = dD +
cC
∆G0р-ии={d∆G0(D)+с∆G0(С)} - {a∆G0(A)+b ∆G0(B)}
Слайд 27
*
∆G для биохимических процессов в условиях, отличных от
стандартных, можно рассчитать на основе экспериментальных значений по уравнению:
∆G
= ∆H – T·∆S
∆G характеризует возможность самопроизвольного протекания процессов (второй закон т/д).
Слайд 28
*
Второй закон термодинамики:
в системе при постоянной
температуре и давлении самопроизвольно могут совершаться только такие процессы,
в результате которых энергия Гиббса уменьшается, т. е. ∆G<0.
∆G<0 говорит только о т/д возможности протекания данного процесса и ничего не говорит о скорости процесса и необходимых условиях для его начала.
Слайд 29
*
Биохимические реакции, сопровождающиеся уменьшением энергии Гиббса, называют экзэргоническими
реакциями, они могут совершаться самопроизвольно.
Биохимические реакции, сопровождающиеся увеличением энергии
Гиббса, называют эндэргоническими реакциями, они не возможны без внешнего подвода энергии.
Слайд 30
*
Чтобы в живых системах протекали эндэргонические реакции, необходимо,
чтобы они были сопряжены с экзэргоническими реакциями. Такое сопряжение
возможно, если обе реакции имеют какое-либо общее промежуточное соединение и на всех стадиях сопряженных реакций суммарный процесс характеризуется отрицательным значением изменения энергии Гиббса.
Слайд 31
*
Например, эндэргоническая реакция
глюкоза+фруктоза = сахароза +Н2О,
∆G>0
протекает только с экзэргонической реакцией гидролиза АТФ:
глюкоза+фруктоза+АТФ =
=сахароза +Н2О+АДФ + Ф,
∆G<0
Слайд 32
*
особенности протекания обратимых биохимических реакций:
стремление достичь динамического
равновесия (равенства скоростей прямой и обратной реакций;
энергетическая выгодность
(∆G<0);