- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Фосфор: строение и свойства
Содержание
- 2. Строение атома фосфора
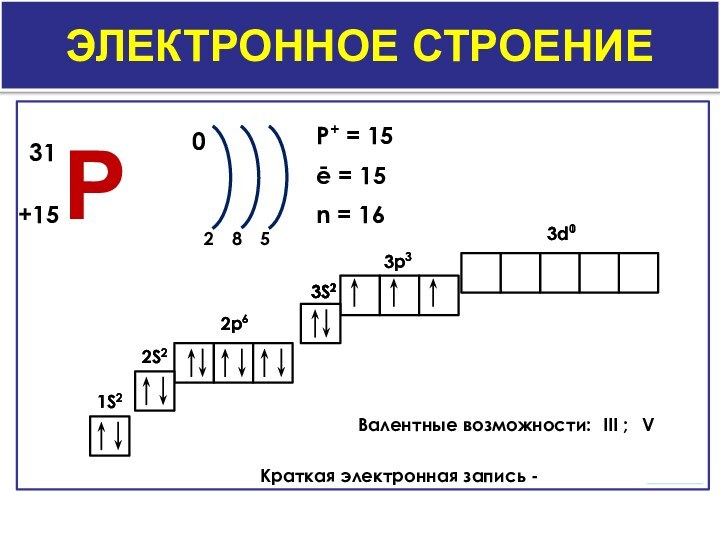
- 3. Электронное строение0285P+ = 15ē = 15n = 161S22S22p63S23p33d0Валентные возможности:Краткая электронная запись -1S22S22p63S23p33S13d1III ;V
- 4. Общая характеристика.неметалл, Ar=31V группа, главная подгруппа3 период,
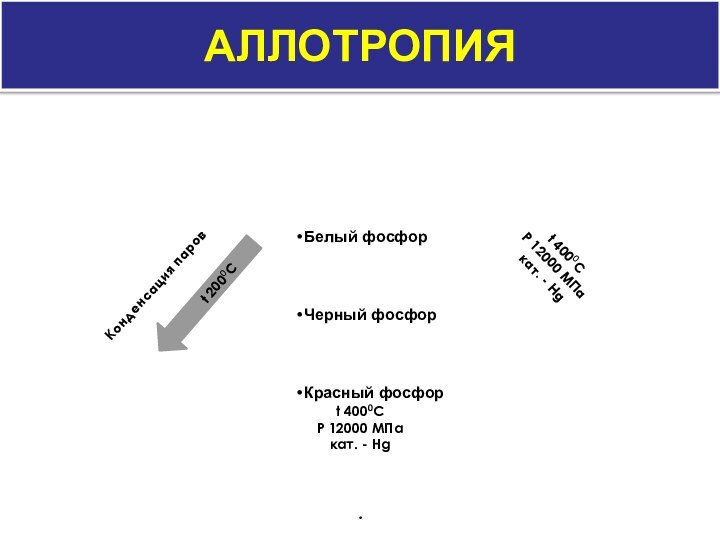
- 5. аллотропияt 2000CКонденсация паров.
- 6. Кристаллические решёткиРис. 1 Строение белого и красного
- 7. Воскообразное, прозрачное вещество с характерным запахом, в
- 8. Темно-малиновый порошок. Нерастворим в воде и сероуглероде.
- 9. Чёрное вещество с металлическим блеском, жирное
- 10. В одно колено сосуда Ландольта поместим немного
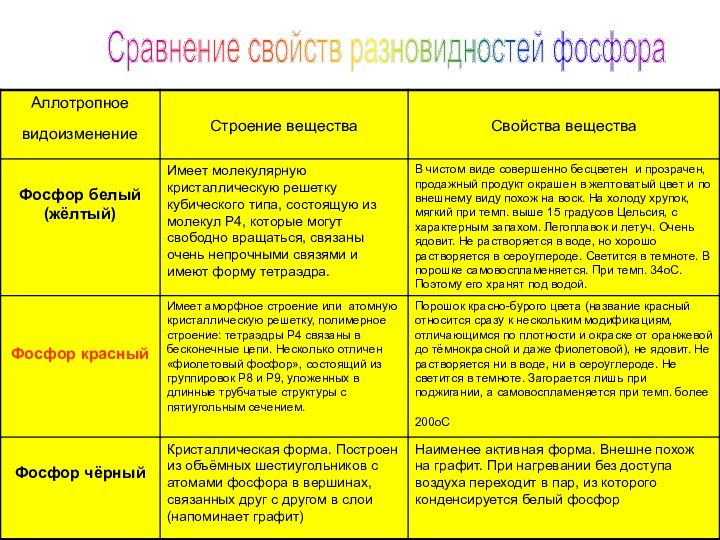
- 11. Сравнение свойств разновидностей фосфора
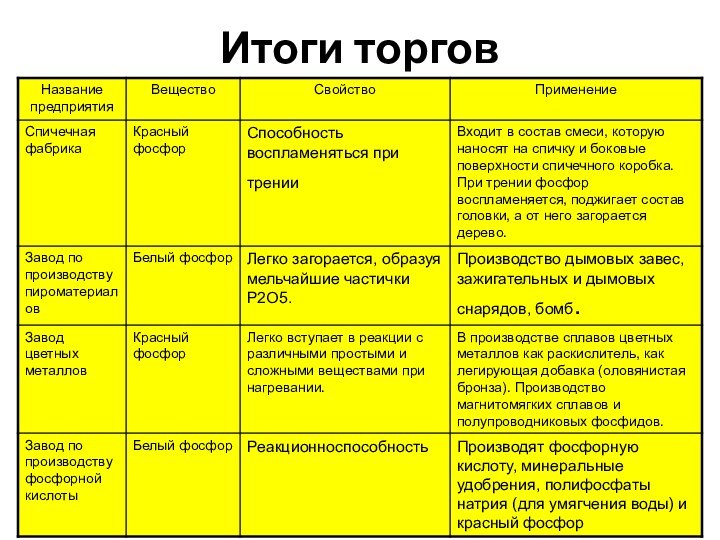
- 12. Итоги торгов
- 13. Нахождение в природе.Содержание фосфора в земной
- 14. Природные соединенияАпатитФормула Са5[PO4]3(F,Cl,ОН) Цвет белый, зеленый, сине-зеленый,
- 15. Природные соединенияФормула (Са5(РО4)3Сl или Са5(РО4)3FЦвет беловатый, сероватый, желтоватый или бурыйПрозрачность Непрозрачный, Плотность 5 г/см³Фосфорит
- 16. Получение.Фосфор получают в электрических печах по
- 17. Черный фосфор получают из белого нагреванием при
- 18. Физические свойства.Белый фосфор Он чрезвычайно
- 19. Красный фосфор Не ядовит!в зависимости от способов
- 20. Белый фосфор горит в кислороде. Удивительно, что
- 21. Безводная азотная кислота – сильный окислитель. Поэтому
- 22. Красный фосфор при нагревании взаимодействует с активными
- 23. ОКСИДЫ ФОСФОРА P2O5 - оксид фосфора
- 24. P2O5+H2O = 2 HPO3
- 25. применениеПрименяют оксид фосфора (V) для осушки газов
- 26. P2O3 (P4O6) - оксид фосфора (III) (фосфористый
- 27. ОРТОФОСФОРНАЯ КИСЛОТАH3РO4 - трехосновная минеральная
- 28. Качественная реакция на
- 29. 4.Применение.H3PO4 используют для получения фосфорных удобрений, для
- 30. Скачать презентацию
- 31. Похожие презентации








![Фосфор: строение и свойства Природные соединенияАпатитФормула Са5[PO4]3(F,Cl,ОН) Цвет белый, зеленый, сине-зеленый, голубой, фиолетовый, редко красный Блеск](/img/tmb/14/1391300/623d1ca8054e9b9fae2a0731c7177a1d-720x.jpg)















Слайд 4
Общая характеристика.
неметалл,
Ar=31
V группа, главная подгруппа
3 период, 3
ряд
степени окисления -3.0,+1,+3,+5.
оксиды Р2О3 и Р2О5
- оба оксида кислотныеКислоты:
H 3PO3 –фосфористая кислота H3PO4 –фосфорная кислота
летучее водородное соединение РН3-газ фосфин ( связь ковалентная почти неполярная)
Р Фосфор
( Phosphorus-Cветоносец)
Слайд 6
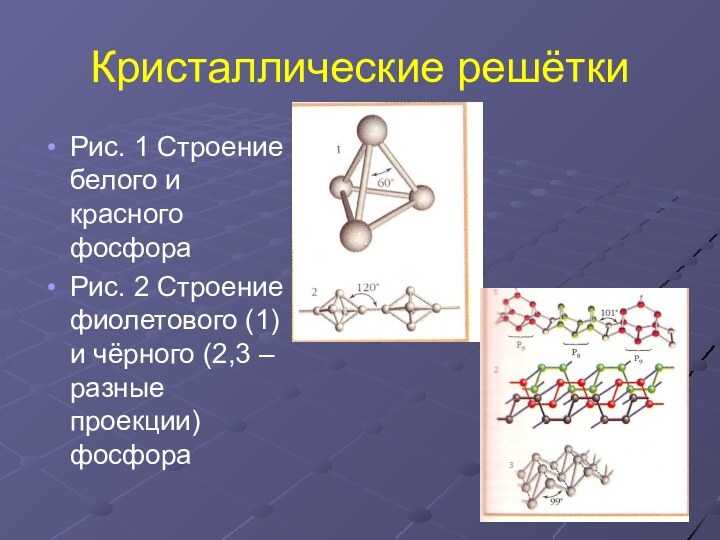
Кристаллические решётки
Рис. 1 Строение белого и красного фосфора
Рис.
2 Строение фиолетового (1) и чёрного (2,3 – разные
проекции) фосфораСлайд 7 Воскообразное, прозрачное вещество с характерным запахом, в присутствии
примесей - следов красного Фосфора, мышьяка, железа и т.
п. - окрашен в желтый цвет. Температура плавления 44,1 °С. Медленно окисляется кислородом воздуха уже при комнатной температуре и светится (бледно-зелёное свечение). Белый фосфор активен химически и весьма ядовит.Белый фосфор
Слайд 8 Темно-малиновый порошок. Нерастворим в воде и сероуглероде. Химическая
активность значительно ниже, чем у белого. На воздухе
окисляется медленно, не светится в темноте. Самовоспламеняется при трении или ударе. При нагревании превращается в пар, при охлаждении которого образуется в основном белый фосфор. Ядовитость красного фосфора в тысячи раз меньше, чем у белого.Красный фосфор
.
Слайд 9 Чёрное вещество с металлическим блеском, жирное на
ощупь и весьма похожее на графит. Не растворим в
воде или органических растворителях. Поджечь чёрный фосфор можно, только предварительно сильно раскалив в атмосфере чистого кислорода до 400 °С. Удивительным свойством чёрного фосфора является его способность проводить электрический ток и свойства полупроводника. Температура плавления чёрного фосфора 1000 °С под давлением 18·105 Па.Черный фосфор
Бортникова Г.В.
Слайд 10 В одно колено сосуда Ландольта поместим немного красного
фосфора. Закроем отверстие сосуда плотным комком ваты. Закрепим сосуд
Ландольта в штативе. Нагреем колено. Через некоторое время наблюдаем, как белый фосфор конденсируется на холодных стенках второго колена. Цвет фосфора не белый, а оранжевый, что обусловлено примесями красного фосфора. После остывания сосуда опускаем в него металлическую проволоку. Частицы белого фосфора загораются на воздухе.Оборудование: сосуд Ландольта, горелка, штатив, вата.
Техника безопасности. Опыт следует проводить под тягой. Соблюдать правила обращения с белым фосфором. Не допускать попадания белого фосфора на кожу. После проведения опыта залить сосуд Ландольта насыщенным раствором медного купороса.
аллотропия
Переход красного фосфора в белый
Слайд 13
Нахождение в природе.
Содержание фосфора в земной коре
составляет 9,3·10-2 (по массе). В природе фосфор встречается только
в виде соединений. Основными минералами фосфора являются фосфорит Ca3(PO4)2 и аппатит 3Ca3(PO4)2·CaF2.Кроме того, фосфор входит в состав белковых веществ, а также костей и зубов.
Слайд 14
Природные соединения
Апатит
Формула Са5[PO4]3(F,Cl,ОН)
Цвет белый, зеленый, сине-зеленый, голубой,
фиолетовый, редко красный
Блеск Стеклянный до жирного
Прозрачность Прозрачный,
просвечивающий Плотность 3,2—3,4 г/см³.
Апатит
Слайд 15
Природные соединения
Формула
(Са5(РО4)3Сl или Са5(РО4)3F
Цвет беловатый, сероватый, желтоватый
или бурый
Прозрачность Непрозрачный, Плотность 5 г/см³
Фосфорит
Слайд 16
Получение.
Фосфор получают в электрических печах по реакции:
Ca3(PO4)2
+ 5C+ 3SiO2 = 2P+ 3CaSiO3 + 5CO,
(t=1500 °C).При быстрой конденсации паров под водой образуется белый фосфор. Красный фосфор образуется из белого при длительном нагревании его без доступа воздуха:
P (бел.) → P (красн.),
(t = 280-340 °C)
Слайд 17 Черный фосфор получают из белого нагреванием при 200
°C и давлении 1,2·106 кПа или в присутствии Hg
(катализатора) при обычном давлении.
Слайд 18
Физические свойства.
Белый фосфор
Он чрезвычайно
ядовит
!
Мягкое, бесцветное, воскообразное вещество. Он легкоплавок (температура плавления 44,1
°C, температура кипения 275 °C), летуч, растворяется в сероуглероде и в ряде органических растворителей, светится в темноте
(в результате медленного окисления - хемилюминесценция).
Слайд 19
Красный фосфор
Не ядовит!
в зависимости от способов получения
обладает различными свойствами. Например, его плотность изменяется в интервале
2-2,4 г/см3, температура плавления 585-600 °C, цвет от темно-коричневого до красного и фиолетового. Красный фосфор практически не растворяется ни в одном растворителе,
в темноте не светится
Слайд 20 Белый фосфор горит в кислороде. Удивительно, что это
может происходить и под водой. Нагреем фосфор в пробирке
с водой до начала плавления фосфора. Подадим кислород в пробирку с расплавленным фосфором. Соприкоснувшись с пузырьками кислорода, белый фосфор загорается.P4 + 5O2 = 2 P2O5
Оборудование: газометр, стакан химический, пробирка.
Техника безопасности. Опыт следует проводить под тягой. Соблюдать правила обращения с белым фосфором. Не допускать попадания белого фосфора на кожу.
Химические свойства
Горение белого фосфора
.
Слайд 21 Безводная азотная кислота – сильный окислитель. Поэтому она
легко взаимодействует с красным и белым фосфором. Реакция с
белым фосфором протекает очень бурно. Иногда она сопровождается взрывом. В небольшую пробирку осторожно нальем немного азотной кислоты. В целях безопасности поместим пробирку в стакан. Осушим кусочек белого фосфора и бросим в пробирку с кислотой. Через несколько секунд белый фосфор расплавляется и энергично сгорает. Продуктами взаимодействия белого фосфора с кислотой являются метафосфорная кислота, оксиды азота и вода.Р4 + 20 НNО3 = 4 НРО3 + 20 NО2 + 8 Н2О
Оборудование: стакан толстостенный, закрепленная в стакане пробирка, пинцет, скальпель, фильтровальная бумага.
Техника безопасности. Опыт должен проводиться под тягой и в защитных перчатках. Соблюдать правила обращения с концентрированными кислотами и с белым фосфором. Не допускать попадания фосфора на кожу.
Химические свойства
Взаимодействие с азотной кислотой
.
Слайд 22 Красный фосфор при нагревании взаимодействует с активными металлами.
Смешаем опилки кальция с порошком красного фосфора. Поместим смесь
в стеклянную трубку. Нагреем смесь. Взаимодействие фосфора с кальцием сопровождается вспышками. В результате реакции образуется фосфид кальция – твердое вещество светло-коричневого цвета.3Ca + 2P = Ca3P2
Часть красного фосфора при нагревании и от теплоты протекающей реакции превращается в белый фосфор. Пары белого фосфора загораются при выходе из трубки.
Оборудование: штатив, трубка стеклянная, горелка, палочка стеклянная.
Техника безопасности. Соблюдать правила обращения с белым фосфором. Не допускать попадания белого фосфора на кожу. Опыт проводить под тягой.
Химические свойства
Взаимодействие с кальцием
Слайд 23 ОКСИДЫ ФОСФОРА P2O5 - оксид фосфора (V) (фосфорный ангидрид),
в парообразном состоянии имеет состав P4O10. Он представляет собой
белый порошок, температура плавления 422 °C, температура кипения 591 °C. Оксид фосфора (V) гигроскопичен .
Получают его сжиганием фосфора в избытке сухого воздуха.
4P + 5O2(изб.) = 2P2O5
Это кислотный оксид
( вспомни свойства кислотных оксидов). При соединении с водой образует две кислоты:
Слайд 25
применение
Применяют оксид фосфора (V) для осушки газов и
жидкостей, не реагирующих с ним, для получения фосфорных кислот,
оксид фосфора является компонентом фосфатных стекол.Слайд 26 P2O3 (P4O6) - оксид фосфора (III) (фосфористый ангидрид),
температура плавления -23,9 °C,
температура кипения- 175,4 °C,
плотность
-2,135 г/см3.
Получают его окислением фосфора кислородом воздуха:
P4 + 3O2 (нед.) = P2O6.
Это кислотный оксид:
P2O3 + 3H2O = 2H3PO3.
Слайд 27
ОРТОФОСФОРНАЯ КИСЛОТА
H3РO4 - трехосновная минеральная
кислота.
2.Физические свойства:
Безводная ортофосфорная кислота - это бесцветное кристаллическое вещество, плавящееся при t = 42,35 °C, хорошо растворима в воде.
Слайд 28 Качественная реакция на
3- фосфат ион - PO4
H3PO4 + 3AgNO3 =>Ag3PO4 +3HNO3
жёлтый осадок
3- +
PO4 + 3Ag => Ag3PO4
жёлтый осадок
Слайд 29
4.Применение.
H3PO4 используют для получения фосфорных удобрений, для создания
защитных покрытий на металлах, в фармацевтической промышленности, в органическом
синтезе.Ортофосфорная кислота играет большую роль в жизнедеятельности животных и растений.
Её остатки входят в состав аденозинтрифосфорной кислоты – АТФ, при разложении
которой выделяется большое количество энергии. Остатки ортофосфорной кислоты входят так же в состав рибонуклеиновых (РНК) и дезоксирибонуклеиновых кислот(ДНК