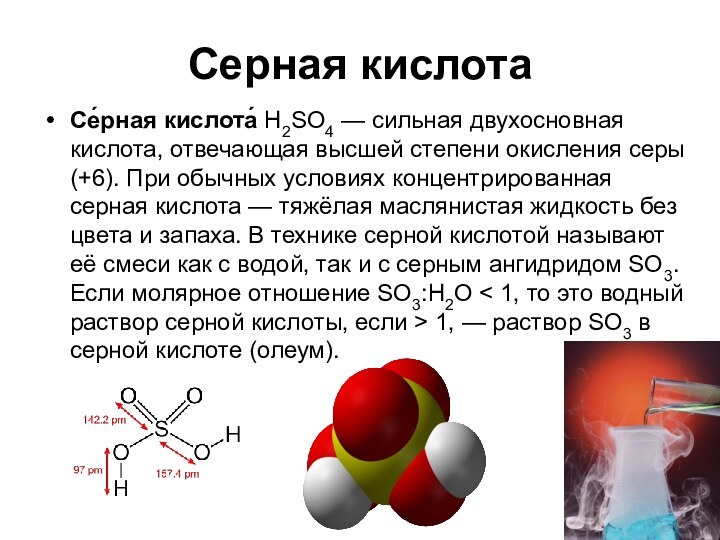
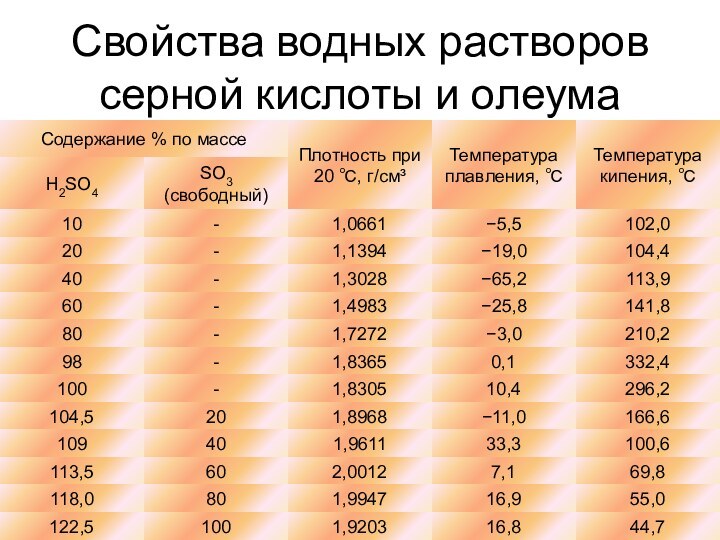
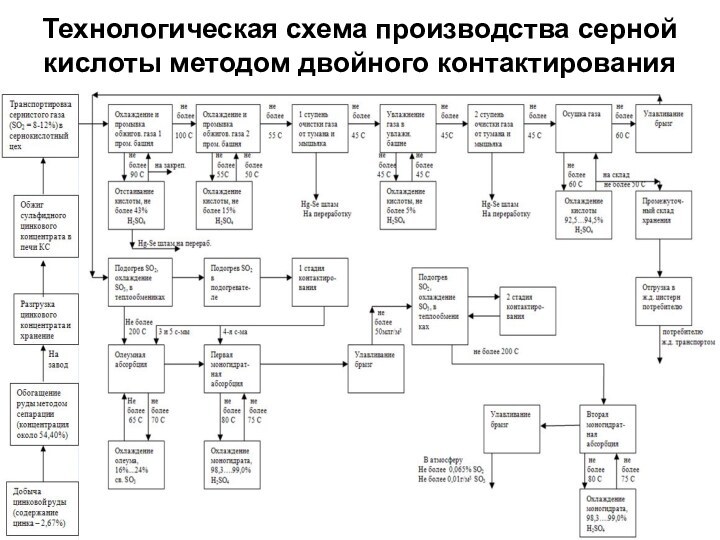
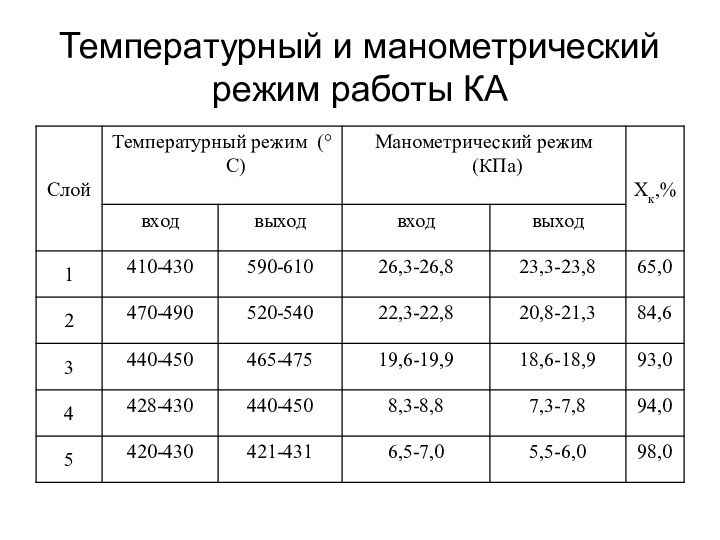
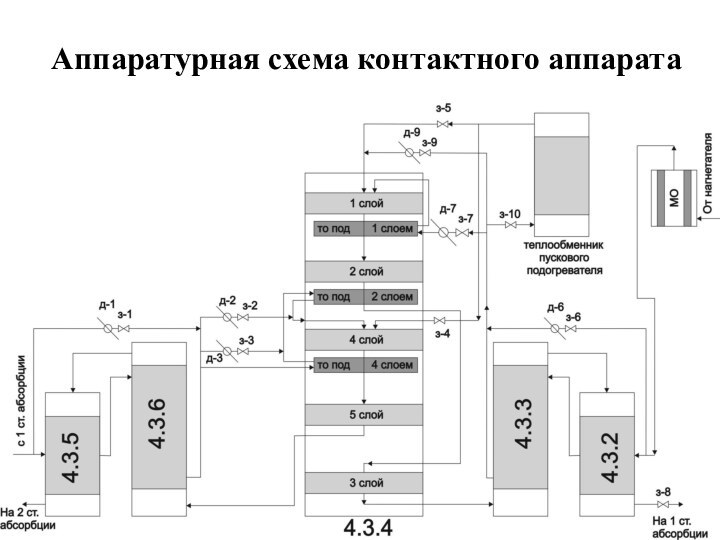
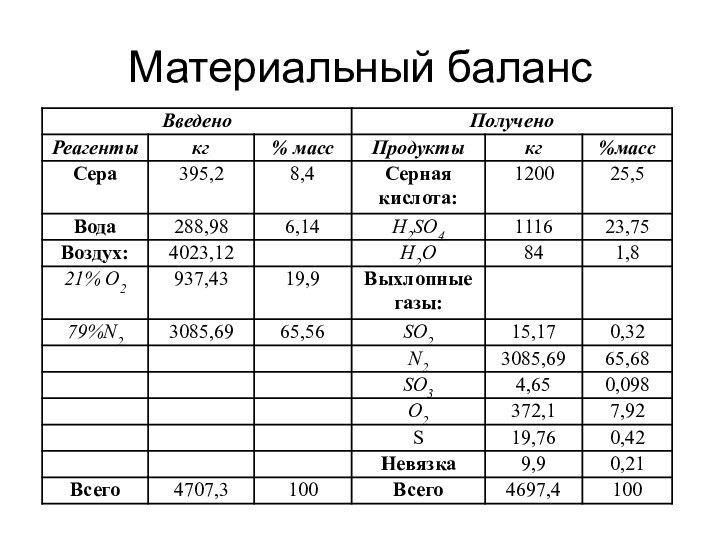
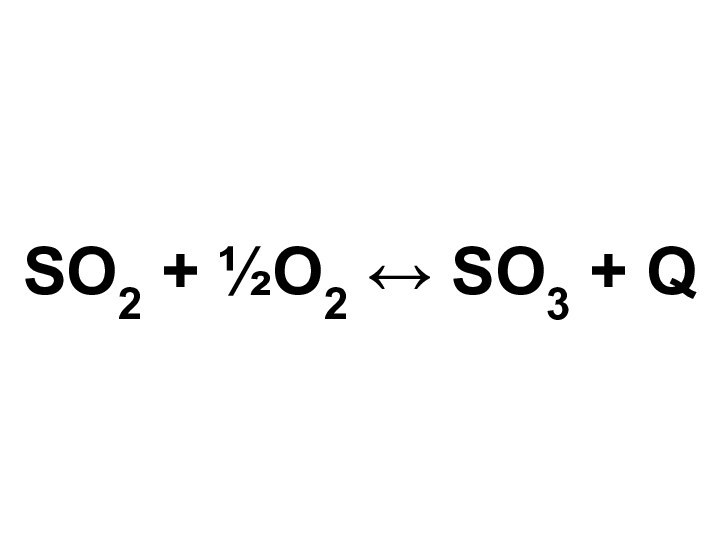о кислых газах, получаемых при прокаливании квасцов или железного
купороса «зеленого камня», встречается в сочинениях, приписываемых арабскому алхимику Джабир ибн Хайяну.Позже, в IX веке персидский алхимик Ар-Рази, прокаливая смесь железного и медного купороса (FeSO4•7H2O и CuSO4•5H2O), также получил раствор серной кислоты. Этот способ усовершенствовал европейский алхимик Альберт Магнус, живший в XIII веке.
молекула серной
кислоты по Дальтону: