при изучении химии на 1 курсе по программе НПО
по при изучении темы «Химические реакции».В презентации рассматривается классификация химических реакций, протекающих с изменением состава вещества.
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть







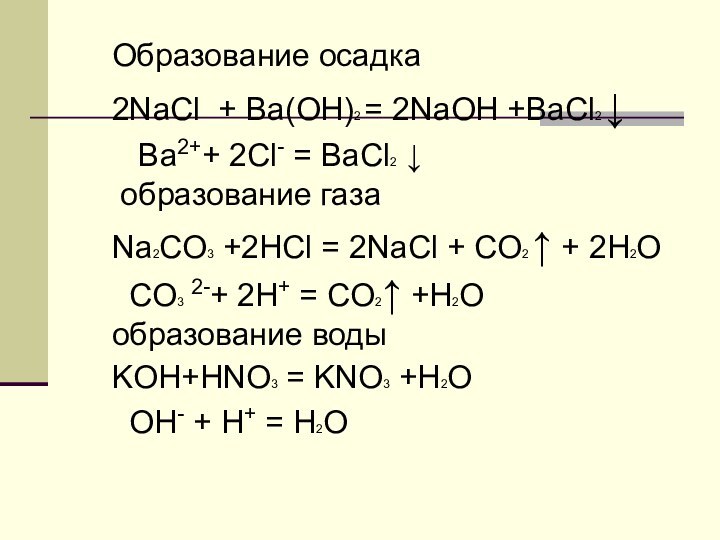



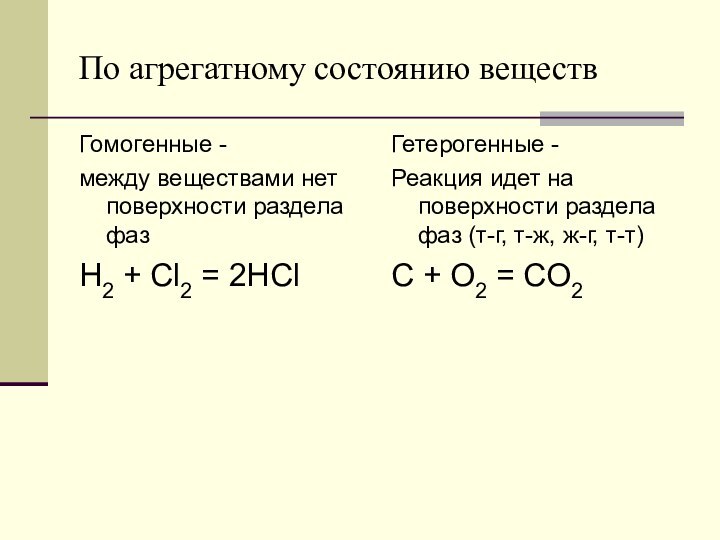

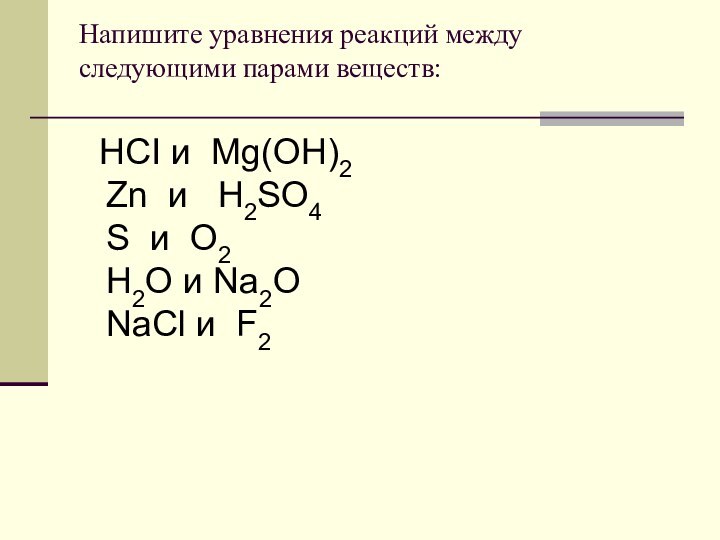


Обратимые -
Идут одновременно в двух противоположных направлениях
N2 +H2 ↔NH3↑
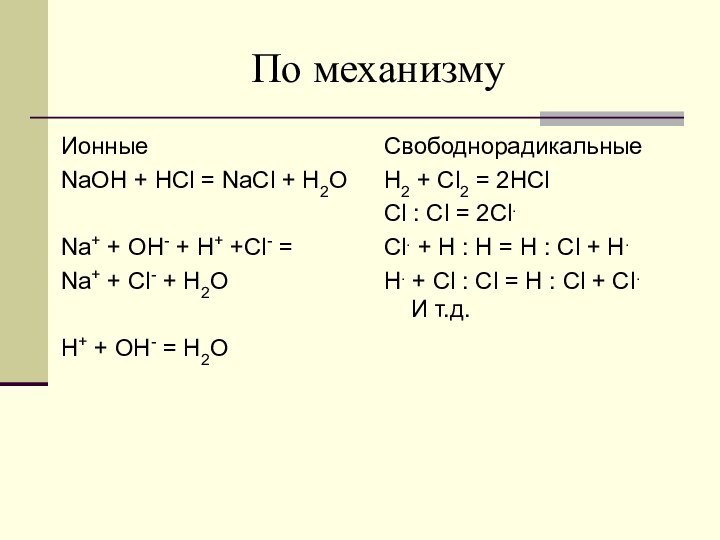
Свободнорадикальные
H2 + Cl2 = 2HCl
Cl : Cl = 2Cl.
Cl. + H : H = H : Cl + H.
H. + Cl : Cl = H : Cl + Cl. И т.д.