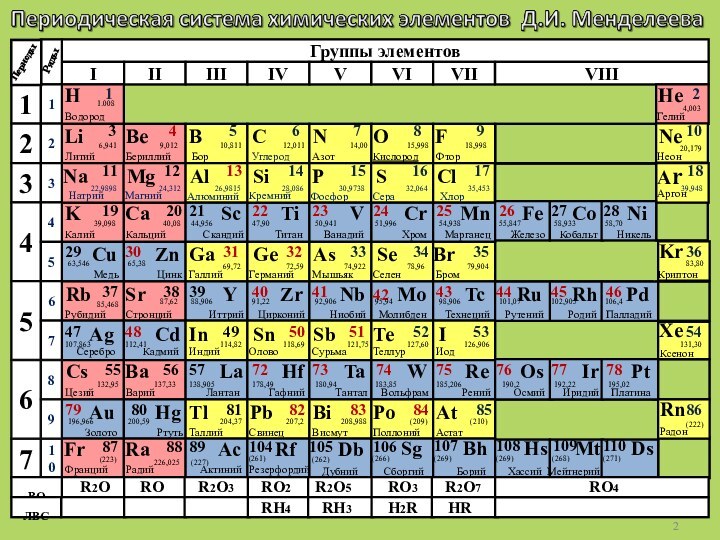
8 в;
В начале 16 в. Леонардо да Винчи опубликовал
данные, связанные с химией кислорода, не зная еще, что кислород – элемент; Реакции присоединения кислорода описаны в научных трудах С.Гейлса (1731) и П.Байена (1774);
К.Шееле в 1771–1773 занимался исследованиями взаимодействия металлов и фосфора с кислородом;
Дж.Пристли сообщил об открытии кислорода как элемента в 1774, спустя несколько месяцев после сообщения Байена о реакциях с воздухом;
Название oxygenium («кислород») дано этому элементу вскоре после его открытия Пристли и происходит от греческих слов, обозначающих «рождающий кислоту»;
А.Лавуазье (1777) принадлежит объяснение роли кислорода в процессах дыхания и горения
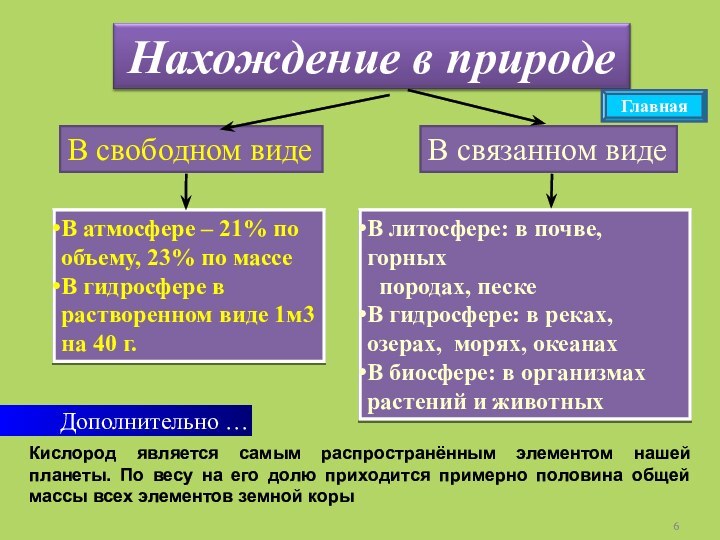
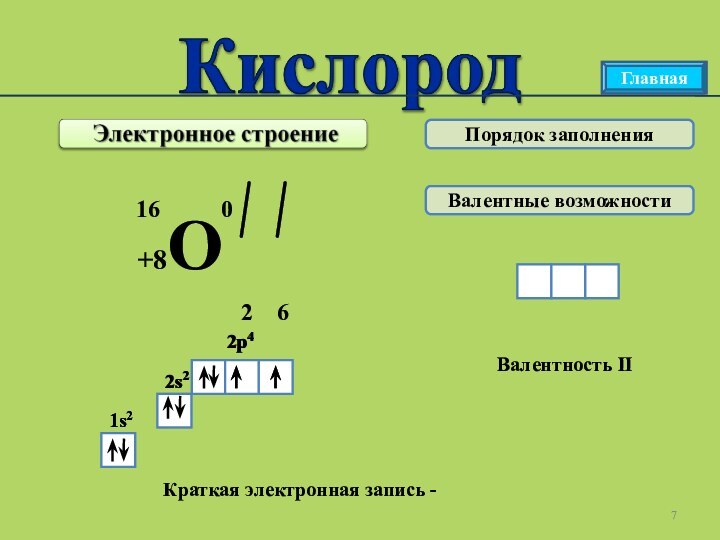
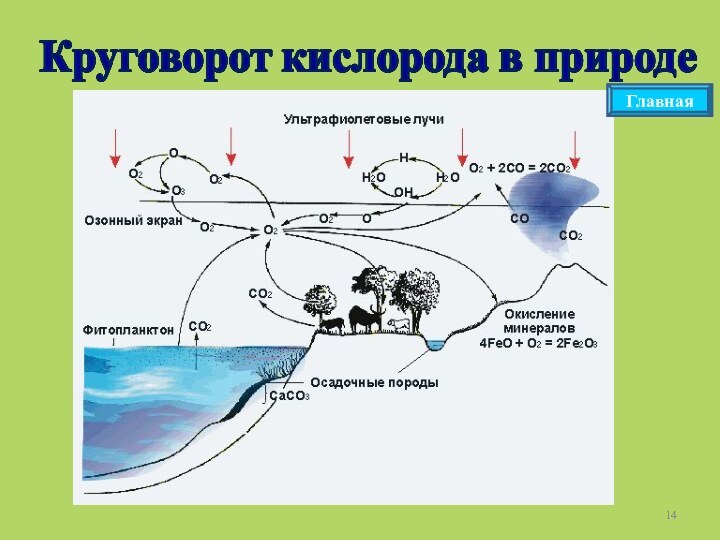
Главная