♦интересные фаткты
7.Известь
♦ негашённая известь
♦ ♦ применение
♦♦ гашённая
известь♦ ♦ применение
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть


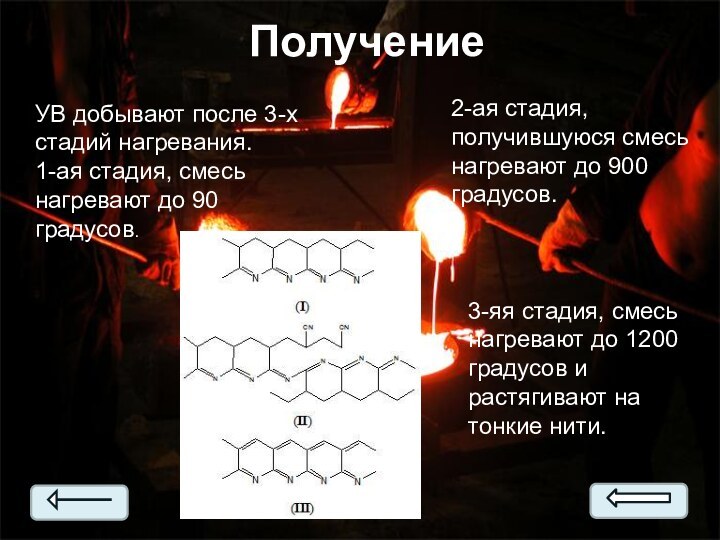

























3-яя стадия, смесь нагревают до 1200 градусов и растягивают на тонкие нити.
Получение
Формула
6P+5KClO3 5KCl+3P2O5
•Промышленный способ получения аммиака основан на прямом взаимодействии водорода и азота:
•Для получения аммиака в лаборатории используют действие сильных щелочей на соли аммония:
•Обычно лабораторным способом аммиак получают слабым нагреванием смеси хлорида аммония с гашеной известью.
NH3
Получение
CaO
•В промышленности оксид кальция получают термическим разложением известняка (карбоната кальция):
•Также оксид кальция можно получить при взаимодействии простых веществ:
Получение
Получают путём взаимодействия оксида кальция (негашёной извести) с водой (процесс получил название «гашение извести»):
CaO + H2O → Ca(OH)2