- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
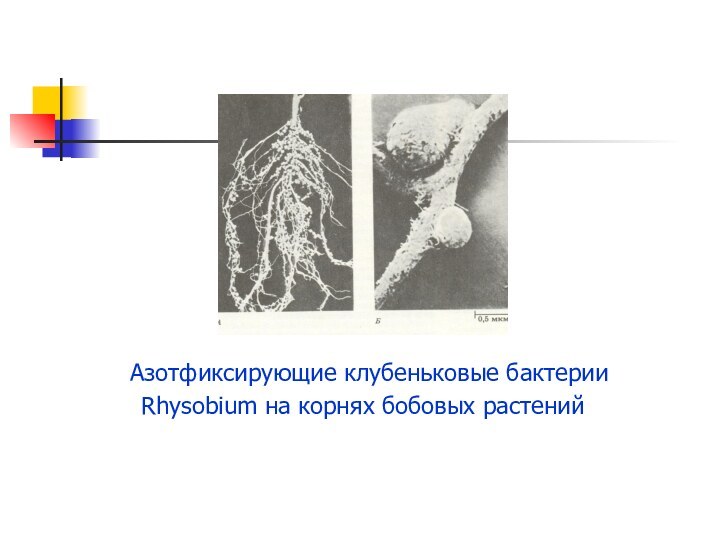
Презентация на тему Кислородные соединения азота
Содержание
- 2. Цели и задачи:Повторить классификацию и свойства оксидов
- 3. «Великое искусство научиться многому – это браться за немногое» Д.Локк
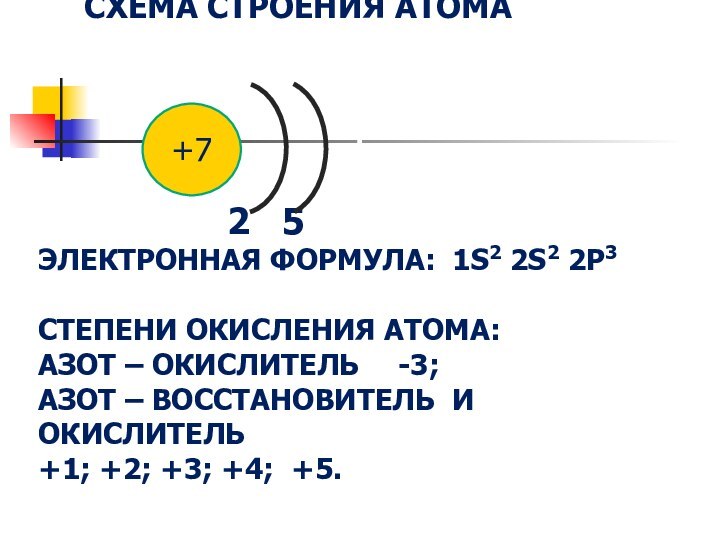
- 4. СХЕМА СТРОЕНИЯ АТОМА
- 5. В какое соединение превращается азот в верхних
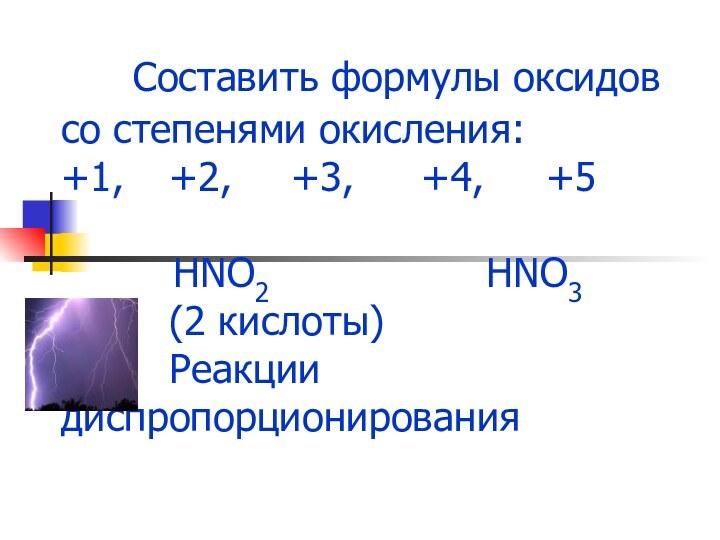
- 6. Составить формулы оксидов со степенями окисления: +1,
- 7. «Веселящий газ»-оксид азота (1)Оксид азота (2) –
- 8. Физминутка
- 9. Проблема:
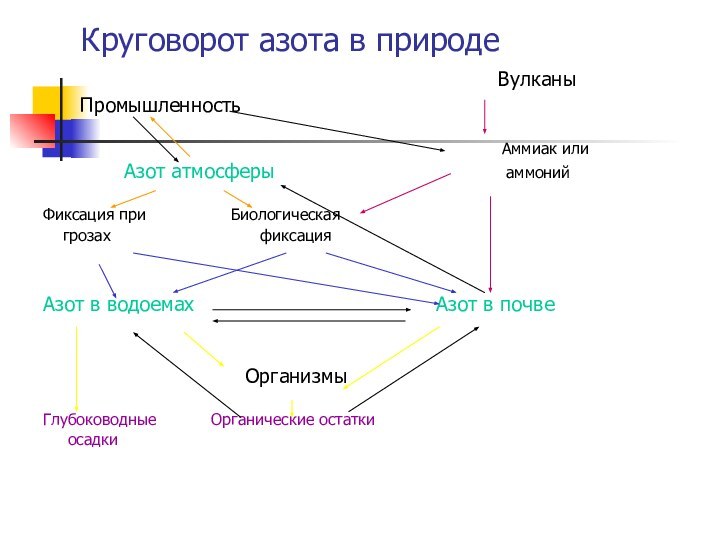
- 10. Круговорот азота в природе
- 11. Круговорот азота в природе
- 13. Скачать презентацию
- 14. Похожие презентации
Цели и задачи:Повторить классификацию и свойства оксидов азота;Изучить свойства азотной кислоты и её особенности;Выяснить о применении азотной кислоты.







Слайд 2
Цели и задачи:
Повторить классификацию и свойства оксидов азота;
Изучить
свойства азотной кислоты и её особенности;
кислоты.Слайд 4 СХЕМА СТРОЕНИЯ АТОМА
2 5 ЭЛЕКТРОННАЯ ФОРМУЛА: 1S2 2S2 2P3 СТЕПЕНИ ОКИСЛЕНИЯ АТОМА: АЗОТ – ОКИСЛИТЕЛЬ -3; АЗОТ – ВОССТАНОВИТЕЛЬ И ОКИСЛИТЕЛЬ +1; +2; +3; +4; +5.
+7
Слайд 5
В какое соединение превращается азот в верхних слоях
атмосферы во время грозовых разрядов?
Как получают азот в
промышленности? Почему азот называют «элементом жизни»?
Что такое «нашатырный спирт»? Для чего его используют?
Какие свойства аммиака лежат в основе его применения в холодильных установках?
Каким способом следует собирать аммиак? Почему?
Как можно распознать аммиак?
Что такое нашатырь? Для чего его используют?
Какое применение находит карбонат и гидрокарбонат аммония?
Какие вещества называют селитрами?
Слайд 6 Составить формулы оксидов со степенями окисления: +1, +2,
+3, +4, +5
HNO2 HNO3 (2 кислоты) Реакции диспропорционирования
Слайд 7
«Веселящий газ»-оксид азота (1)
Оксид азота (2) – при
н.у. окисляется кислородом воздуха
Оксид азота (3) – темно-синяя жидкость,
tкип.=3,5, кислотный оксидОксид азота (4) – бурый газ, сильный окислитель, хорошо растворим в воде
Оксид азота (5), азотный ангидрид, кислотный оксид, очень сильный окислитель
Слайд 11
Круговорот азота в природе
Вулканы
Промышленность
Аммиак или
Азот атмосферы аммоний
Фиксация при Биологическая
грозах фиксация
Азот в водоемах Азот в почве
Организмы
Глубоководные Органические остатки
осадки





























