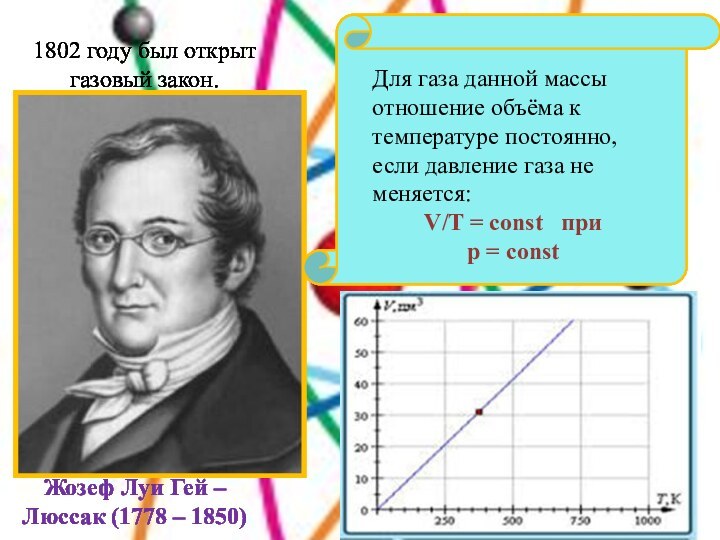
и превращениях.
Химические свойства веществ – это способность данного вещества
превращаться в другие вещества.Главный «поведенческий» девиз вещества – строение определяет свойства вещества.