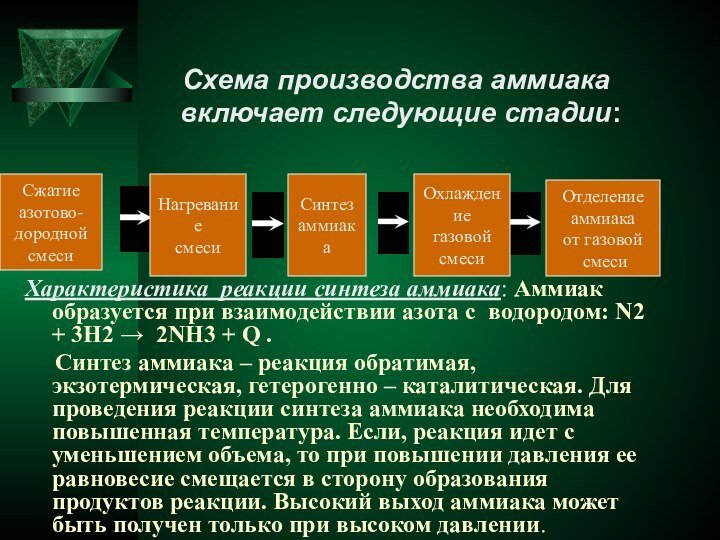
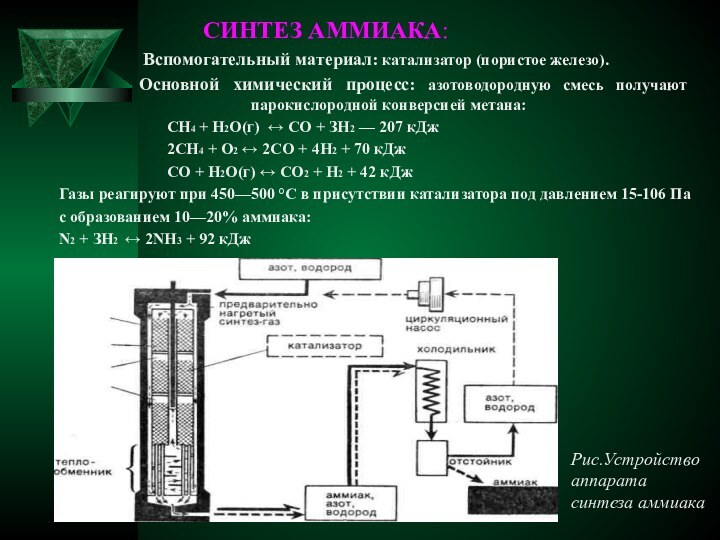
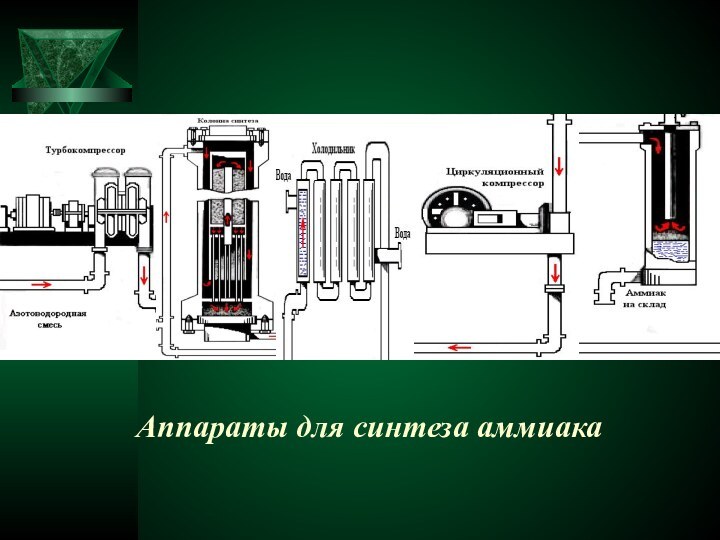
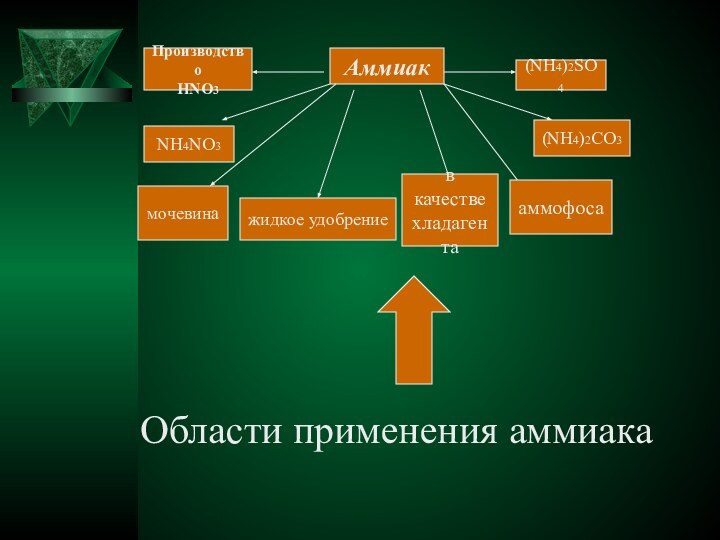
острым, характерным, вызывающим слезы запахом, состоящий из 1 объема
азота и 3 объемов водорода, а потому отвечающий формуле NH3 (связи N— Н полярны;, у атома N имеется неподеленная пара электронов, к-рая обусловливает способность аммиака к образованию донорно-акцепторной и водородной связей; для NH3 т. пл. -77,7°С, т. кип. -33,35°С)Структура молекулы NH3